经皮肾镜微创技术在重症急性胰腺炎治疗中的应用
邹晓明,石雪英
内蒙古医科大学第三附属医院普通外科,内蒙古 包头 014010
继发胰腺或胰周感染性坏死是重症急性胰腺炎(severe acute pancreatitis,SAP)最严重的并发症,发生率为10%~70%,是SAP死亡的主要原因[1-2]。其多发生在SAP发病后2~3周内,如不及时进行外科干预治疗,病死率可达100%[3]。既往对于该疾病的治疗方法多为开腹手术进行胰周坏死组织清除及引流,不仅创伤大,且导致术后并发症多、病死率高。因此,合理的手术方式可以提高SAP病人救治的成功率。本文回顾性分析我院自2015年1月至2020年1月期间收治的32例SAP病人并行经皮肾镜胰周坏死组织清除术的临床资料,探讨其在临床应用及效果。
资料与方法
一、纳入标准和排除标准
纳入标准:(1)笔者所在医院于2015年1月至2020年1月期间收治的经CT和实验室检测确诊的SAP病人,且存在胰腺或胰周坏死组织感染;包括胆源性坏死组织感染性胰腺炎。(2)病人签署知情同意书,同意行经皮肾镜治疗方案。排除标准:SAP诊断明确但未进行经皮肾镜手术治疗的病人。
二、临床资料
根据纳入标准和排除标准,最终纳入32例SAP病人,其中男性21例,女性11例;年龄(50.8±15.9)岁,年龄范围为26~80岁。均符合中华医学会消化病学分会胰腺疾病学组等制定的《中国急性胰腺炎诊治指南》[4],其中病因包括:胆源性26例,酒精性3例,高脂血症2例,特发性1例。临床表现为发热、腹痛、腹胀,恶心、呕吐等,血尿淀粉酶增高,所有病人均行超声及腹部增强CT检查。
三、治疗方法
1.术前准备 所有病人入院后即完成腹部CT平扫,72 h内完成增强CT检查,同时给予病人抗感染、抑制胰酶分泌、营养支持及器官功能维持等治疗。术前再次行腹部增强CT检查,进一步明确胰腺及周围组织坏死部位、范围、与邻近器官的关系及腹腔积液情况(图1)。
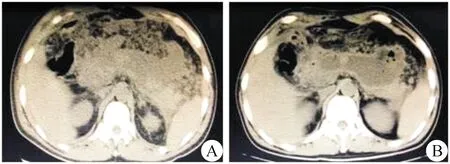
图1 术前影像 A.胰周可见坏死组织、液性区,胰腺周围脂肪间隙模糊;B.胰周可见坏死组织、液性区及气泡征
2.穿刺引流 局部麻醉下经CT引导行腹膜后途径经皮穿刺胰周感染灶置管引流术(图2A),通过导丝使用COOK公司扩条由细到粗逐步扩张窦道至可放入16 F或18 F引流管,持续进行感染灶冲洗并引流脓液,2~4周后CT重新评价胰周坏死感染灶。症状好转,引流无坏死组织,引流液清亮并少于10 mL,脓腔明显缩小,逐步退管直至拔出。对引流不畅不能有效缓解病人病情应行经皮肾镜胰周坏死感染组织清除和置管引流。
3.手术方法 首次应在全身麻醉下进行,垫高左侧腰背部10°~15°,贴皮肤保护膜,经引流管置入导丝,退出引流管,沿导丝切开皮肤1.5 cm,顺导丝使用扩张鞘管逐级扩张窦道至30 F后沿窦道置入10 mm Trocar,使脓液自行流出,再经Trocar放置26 F硅胶管进行冲洗残留脓液及部分脱落坏死组织,然后插入肾镜,直视下反复冲洗,吸尽脓液后,使用抓钳清除松动坏死组织,坏死组织清除完毕后放置双腔引流管(图2B)。
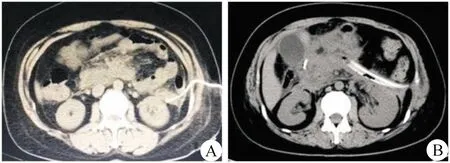
图2 引流术后影像 A.CT引导下穿刺置管引流;B.肾镜胰周坏死组织清除术后放置冲洗引流管
4.术后处理 病人术后均行生理盐水持续冲洗(3~6 L),可随时挤压引流管防止堵塞,如有堵塞应及时清理,必要时可更换引流管以保证引流通畅。术后1周复查CT,了解引流管位置、胰周坏死感染范围,评估引流效果。必要时可再次在局部麻醉下行肾镜下胰周坏死组织清除。如病人冲洗液及引流液变为清亮后,可再次复查CT,如脓腔明显缩小、塌陷,可逐渐更换到较细的引流管后逐步退管直至拔出。
结 果
本组32例病人均顺利完成经皮肾镜胰周坏死组织清除术,围手术期死亡2例,均为多器官功能衰竭。其中28例病人行1次经皮肾镜手术,3例行2次经皮肾镜手术,1例行3次经皮肾镜手术;术后出血1例,经介入治疗止血;2例出现胰腺假性囊肿;病人病情及症状术后均明显改善(图3)。术后住院时间为(27.3±22.3) d(2~106 d)。
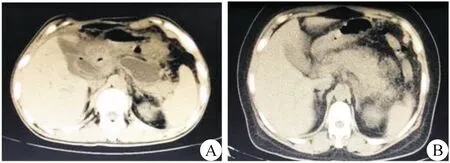
图3 经皮肾镜手术后影像 A.术后胰腺假性囊肿形成;B.术后胰周积液及坏死组织已清除,胰腺轮廓恢复,可见胰腺组织
讨 论
SAP是临床常见的急腹症,发病急、凶险性高,可导致多器官功能障碍或衰竭,死亡率高(10%~20%)[5],继发胰周感染是其严重的并发症之一。因此,胰周坏死组织的清除同时控制腹腔感染是SAP病人预后的关键。既往对于该疾病的治疗方法多为开腹手术进行胰周坏死组织清除及引流,不仅创伤大,而且有较高的并发症及病死率[6]。微创治疗正在改变SAP继发胰腺或胰周感染性坏死的治疗观念,Carter等[7]于2000年开展经皮肾镜胰周坏死组织清除术。蔡守旺等[8]于2008年开展腹膜后入路经皮肾镜下感染性胰腺坏死的治疗。郭佐铭等[9]遵循step-up的治疗策略,采用多切口入路的手术方式对8例腹膜后广泛坏死型胰腺炎病人的临床资料进行分析,结果显示同样可以降低病人的死亡率及术后并发症。均取得了良好的效果。
由于腹膜后间隙是封闭的潜在间隙,因此,腹膜后入路经皮肾镜胰周坏死组织清除术未进入腹腔,对腹腔内组织及脏器影响较少,创伤小,同时避免了胰瘘相关并发症,治疗SAP有明显优势。笔者团队完成32例病人的治疗,体会如下。
我们采用递升式分阶段治疗[10],本组病人首先行经皮穿刺置管引流术(percutaneous catheter drainage,PCD),在CT引导下完成,并根据脓肿位置同时考虑手术入路选择穿刺点,多经结肠后方与肾前筋膜之间的间隙[11],我们认为具有以下作用:(1)引流脓液;(2)促进脓肿壁成熟;(3)为肾镜治疗建立通道。由于引流管径较细,通常引流效果不理想,且无法引流固体坏死组织,Hollemans等[12]对130例SAP病人行PCD治疗,治愈率仅为35%。
肾镜下治疗是升阶梯治疗的关键[13],可以有效去除坏死组织并充分引流,且并发症发生率较开腹手术明显下降[14]。研究表明[15]对于PCD治疗失败的SAP病人采用肾镜下治疗,效果确切且安全。由于脓肿壁通常4周后成熟[16],因此,我们在PCD完成2~4周后重新评价CT,症状好转,引流无坏死组织,引流液清亮并少于10 mL,脓腔明显缩小,逐步退管直至拔出。如感染加重或无明显好转,可行经皮肾镜治疗。该时期病人病情相对平稳,多已度过多器官功能衰竭期,且坏死组织与正常组织分界相对清楚,有效包膜已形成,首次应在全身麻醉下进行,垫高左侧腰背部10°~15°,经引流管置入导丝,退出引流管,沿导丝切开皮肤1.5 cm,顺导丝使用扩张鞘管逐级扩张窦道至可置入10 mm Trocar,使脓液自行流出,再经Trocar放置26 F硅胶管进行冲洗残留脓液及部分脱落坏死组织,然后插入肾镜,气腹压维持在10 mmHg,直视下间断低压冲洗,吸尽脓液后,使用抓钳以清除松动坏死组织为主,由近及远的顺序进行,坏死组织清除完毕后放置双腔引流管。笔者认为:第1次手术应采取损伤控制原则,动作应轻柔,只清理脱落或松动坏死组织,以吸净脓液及松动坏死组织为主,若坏死组织抓取阻力过大或尚未松动应当待二次清理,同时放置管径较粗引流管,保证充分引流。第2次及以后手术可在局部麻醉下经原通道进行,并可重复实施,直至坏死组织完全清除。Mathers等[17]报道经皮内镜治疗胰周组织坏死感染和厚壁脓肿并发症发生率为8%,而成功率高达92%。
本组32例病人均接受经皮肾镜胰周坏死组织清除术,其中28例病人行1次经皮肾镜手术,3例2次,1例3次。通过治疗后,30例病人痊愈,其中2例出现胰腺假性囊肿;死亡2例,分析原因我们考虑这2例病人入院时病情重且处于全身炎症反应综合征及多器官功能障碍综合征阶段,在入院后第2天即进行PCD,同时进行肾镜手术,由于坏死组织与正常组织分界不明显,未形成有效包膜,清创不能得到有效保证,大量坏死组织残留,感染未能得到及时控制而发生多器官功能衰竭,最后死亡。由于肾镜下清除坏死组织引起出血风险较大,手术应分次进行。本组病人肾镜治疗后出血1例,分析原因可能是在清除坏死组织过程中过度钳夹窦道内尚未松动的坏死组织所致,后经介入治疗止血。因此,肾镜治疗的目的是脱落或松动坏死组织,放置较大的引流管充分冲洗引流,缓解脓毒血症,并不是第1次就要彻底清除所有坏死组织,否则极易引起致命性出血可能。
综上所述,经皮肾镜胰周坏死组织清除术创伤小、并发症少、易于重复、疗效好,肾镜下治疗模式,遵循了胰腺炎治疗的“损伤控制”原则,是治疗SAP的一种有效方法。

