睾丸酮丛毛单胞菌中多种蛋白与SDRx的生物学作用研究
张海鸥,杨鑫蕾,尉建,嵇冶
(长春理工大学 生命科学技术学院,长春 130022)
随着工业的发展,工厂所排放的大量甾体类化合物,对人类和动物的生长发育带来巨大的危害[1-2]:如引发人类不孕不育、生殖疾病、肿瘤及生物变性等严重问题[3]。近年科学家在自然界发现了属于丛毛单胞菌属的睾丸酮丛毛单胞菌(Comamonastestosteroni,CT)ATCC11996,它 是以甾体作为唯一碳源的革兰氏阴性细菌,并以甾体激素作为碳源和能源物质,进行代谢活动。在之前的研究中已报道了CT的基因组序列,并描述和表征了几种甾体代谢酶与甾体结合的反应过程[4]。CT菌分解甾体激素的过程错综复杂,一共有几十种酶先后共同参与了它的代谢过程[5],SDR短链脱氢酶就是众多代谢酶家族中的一员。
过去研究表明LuxR、LysR、TetR蛋白对睾丸酮丛毛单胞菌(CT菌)中的很多脱氢酶具有调控作用[6-8],它们可以与短链脱氢酶及甾体激素互相结合并对甾体激素进行降解。因此研究CT菌中SDRx脱氢酶的调控作用具有重要的研究价值。本研究采用基因克隆、重组质粒构建、质粒共转化、ELISA、高效液相等方法,研究这三种蛋白对SDRx的调控作用,从而为更好的利用CT菌修复环境中甾体激素的污染的研究做贡献,可为睾丸酮丛毛单胞菌在自然界中甾体激素的生物降解及基因调控研究提供实验依据[9-12]。
1 实验材料
CT菌,pCR2.1-TOPO自杀质粒由德国基尔大学熊光明教授惠赠。质粒小提试剂盒来自上海Songon公司,DNA凝胶回收试剂盒来自北京TIAN GEN公司,睾丸酮、孕酮、雌酮、17a-乙炔基雌二醇、甲睾酮均来自德国Dr.Ehrenstorfer公司,羊抗鼠抗体来自上海Chemicon公司。大肠杆菌DH5α为实验室保存,pK18、pUC19质粒均为实验室所有;重组质粒pUC19-LuxR为实验室保存。所用化学试剂均为分析纯。
2 实验方法
2.1 SDRx基因位点及其引物设计
SDRx基因属于3-氧酰基-(酰基载体蛋白)还原酶(3-oxoacyl-[acyl-carrier-protein]-reduc‐tase)一员,以NAD+或NADP+为受体、作用于供体CH-OH基团上的氧化还原酶,如图1所示,它位于 glutathione-dependent formaldehy-de-activating下游344 kb处,在CT菌基因组中具有相同的转录方向。作为SDR超家族的一员,该SDR基因包含SDR的共同序列基序,N末端Gly-XXX-Gly-XGly辅因子结合基序和Tyr-XXX-Lys区段。
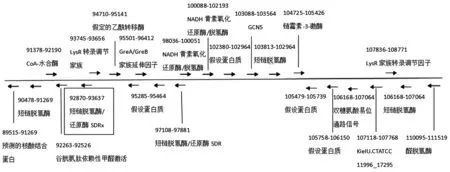
图1 SDRx基因位点
2.2 SDRx敲除菌株构建及活性测定
参照张昊等人[13-14]的方法,设计SDRx基因201-500bp中心部位的敲除引物时,在上游第三、四碱基之间加入G(P1)并在下游末端引入终止子TAA(P2),引物列表如表1所示,并进行PCR扩增,将PCR片段克隆至pCR2.1-TOPO中,得到pCR2.1-TOPO-SDR300,电转到CT菌感受态细胞中,27℃,180 rpm条件下置于Amp+/Kan+双抗平板,得到多个SDRx敲除株,利用P1和TOPO质粒的敲除通用验证引物(P3),以敲除株基因组为模板进行PCR验证。利用基因同源重组将目的基因导入CT菌基因组中,由于TOPO质粒的自杀特性和引物加G进行移码突变从而达到基因敲除目的。
用终浓度为 0.5 μmol/L的睾丸酮(T)、孕酮(P)、雌酮(ES)、雌二醇(E2)、甲睾酮(ME),对野生型、敲除株进行诱导培养,并设置空白对照组(相同培养基体系下只加入等浓度的激素不加菌液)。每种激素在27℃,180 rpm/min条件下诱导16 h,用等体积的氯仿萃取,重复3次,收集氯仿后通风橱中晾干,分别溶于1 mL甲醇作为样品,岛津液相色谱仪进行HPLC分析。检测波长分别为雌二醇280 nm;睾丸酮280 nm;孕酮280 nm;甲睾酮208 nm;雌酮241 nm;流动相水与甲醇的比为20∶80;每次进样50 μL;色谱柱的温度为40℃。
2.3 SDRx脱氢酶表达载体构建及目的活性蛋白的表达纯化
以野生型CT菌基因组为模板进行PCR得到目的基因片段SDRx,扩增引物P4、P5(见表1)。连接至pET-15b载体上,构建重组表达质粒pETSDRx,转入至表达菌株 BL21(DE3)中,得到疑似阳性克隆子并进行测序及双酶切验证,无突变成功构建表达工程菌。

表1 引物设计
对pET-15b和pET-SDRx进行大量表达,在IPTG终浓度0.8 mmol/L条件下进行诱导,16℃,110 rpm,恒温震荡培养24 h。分别收取菌液后,PBS重悬3次,冻融超声,镍柱纯化获得目的蛋白,将所得蛋白进行SDS-PAGE鉴定。
2.4 SDRx蛋白多克隆抗体的制备及效价测定
取得小鼠阴性血清后,对其进行特异性免疫。将上述工程蛋白过滤,分三次进行免疫,第一次免疫将工程蛋白与完全弗氏佐剂1∶1混合,第二、三次免疫将工程蛋白与不完全弗氏佐剂1∶1混合,每次免疫间隔时间为一周,完成第三次免疫后,进行眼球取血,得到阳性血清。
ELISA法测定SDRx小鼠多克隆抗体效价,加入阴性血清为阴性对照(N),加入抗原作为阳性标准(P),P/N>2.1时该比例为抗体效价。将抗原稀释至2 μg/mL 37℃包被1 h,洗涤液清洗3次后,每孔加入100 μL(1∶8 000),37 ℃包被1 h;洗涤3次,每孔加入100 μL Chemicon公司购得的二抗羊抗鼠(1∶4 000)37 ℃包被1 h,洗涤液清洗5次,去离子水洗涤2次,加入TMB应用液作为显色液避光包被30 min,加入终止液后,酶标仪450 nm波长测OD值,空白对照为490 nm。制备标准曲线并得到线性回归方程y=0.068 1 ln(x)+0.270 7,R2=0.999 5,得到最终抗体效价为1∶800 0。
2.5 三种调控蛋白对SDRx脱氢酶调控作用的研究
参照熊光明的实验方法[15],引物设计如表1(P6-P11)所示,将LysR、TetR的PCR片段分别转入pUC19;SDRx与在其前端107bp的预测启动子区域(107SDRx)片段转入pK18,活化实验室保存的pUC19-LuxR菌种。向HB101感受态细胞中加入等浓度pK18-107SDRx质粒与pUC19-LysR质粒,重组为LysR共转株,命名“pLysR”;pK18-107SDRx质粒与pUC19-TetR质粒,重组为TetR共转 株 ,命 名“pTetR”;pK18-107SDRx质 粒 与pUC19-LuxR质粒,进行共转化,重组为LuxR共转株,命名“pLuxR”。Amp+/Kan+双抗平板筛选出多个阳性克隆子,并以其基因组为模板进行PCR验证,成功构建共转化菌株。以睾丸酮为诱导激素,取上述阳性克隆子活化扩大后,加入终浓度 0.5 μmol/L睾丸酮,37℃ 180 rpm条件下诱导14 h,提取总蛋白,设置对照组与平行试验组各三组,对照组为相同体系下无水乙醇进行诱导的重组菌株,平行试验组分别为相同体系下终浓度为0.5 μmol/L的孕酮、睾丸酮进行诱导的重组菌株,分别提取总蛋白,方法参照2.3部分。
将所得蛋白稀释至1 mg/mL进行包被,野生型总蛋白稀释为2 mg/mL进行包被。上述抗体以1∶8 000的效价进行一抗包被。ELISA方法详细步骤参照上述2.4.实验部分。将抗原稀释至2 μg/mL 37℃包被1 h,洗涤液清洗3次后,每孔加入 100 μL(1∶8 000),37 ℃包被 1 h;洗涤 3次,每孔加入100 μL Chemicon公司购得的二抗羊抗鼠(1∶4 000)37℃包被1 h,洗涤液清洗5次,去离子水洗涤2次,加入TMB应用液作为显色液避光包被30 min,加入终止液后,酶标仪450 nm波长测OD值,空白对照为490 nm。利用t检验及方差分析的统计学方法对三组数据进行分析,将LysR、LuxR、TetR重组共转质粒与pUC19重组共转质粒分组后对其显著性差异进行分析。
3 结果与分析
3.1 SDRx基因突变株(M-CT)鉴定
如图2原理图所示,利用基因同源重组将目的基因导入CT菌基因组中,由于TOPO质粒的自杀特性和引物加G进行移码突变从而达到基因敲除目的。SDRx敲除株PCR鉴定如图3可知,1道以M-CT基因组为模板,在530 bp处有明亮单一条带,而相应2道以野生型CT为模板并未出现对应条带,证明SDRx基因的敲除株M-CT构建成功。
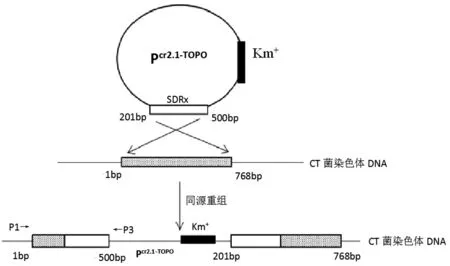
图2 SDRx敲除原理图
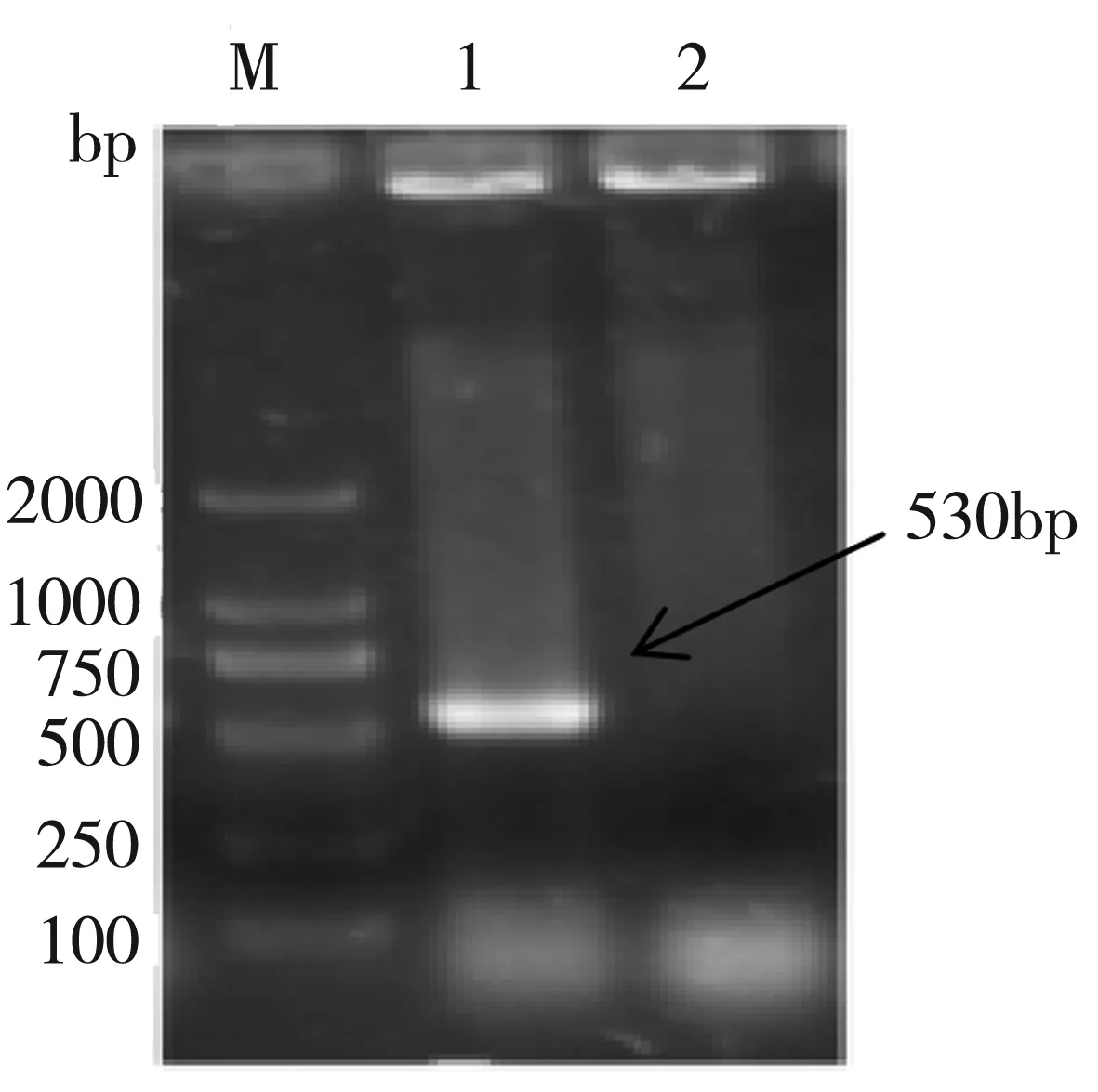
图3 SDRx敲除株PCR鉴定图
3.2 高效液相数据分析
高效液相结果如图4可知,为野生型CT与敲除株M-CT的三组平行实验均值,加入终浓度为0.5 μmol/L的不同种类甾体激素,其中敲除突变株在各激素培养条件下,降解量均明显少于野生型,SDRx基因敲除后其降解激素的能力受到了很大的影响,柱状图显示了CT菌中SDRx敲除后,对不同激素的降解能力影响程度为睾丸酮>甲睾酮>孕酮>雌酮>雌二醇。
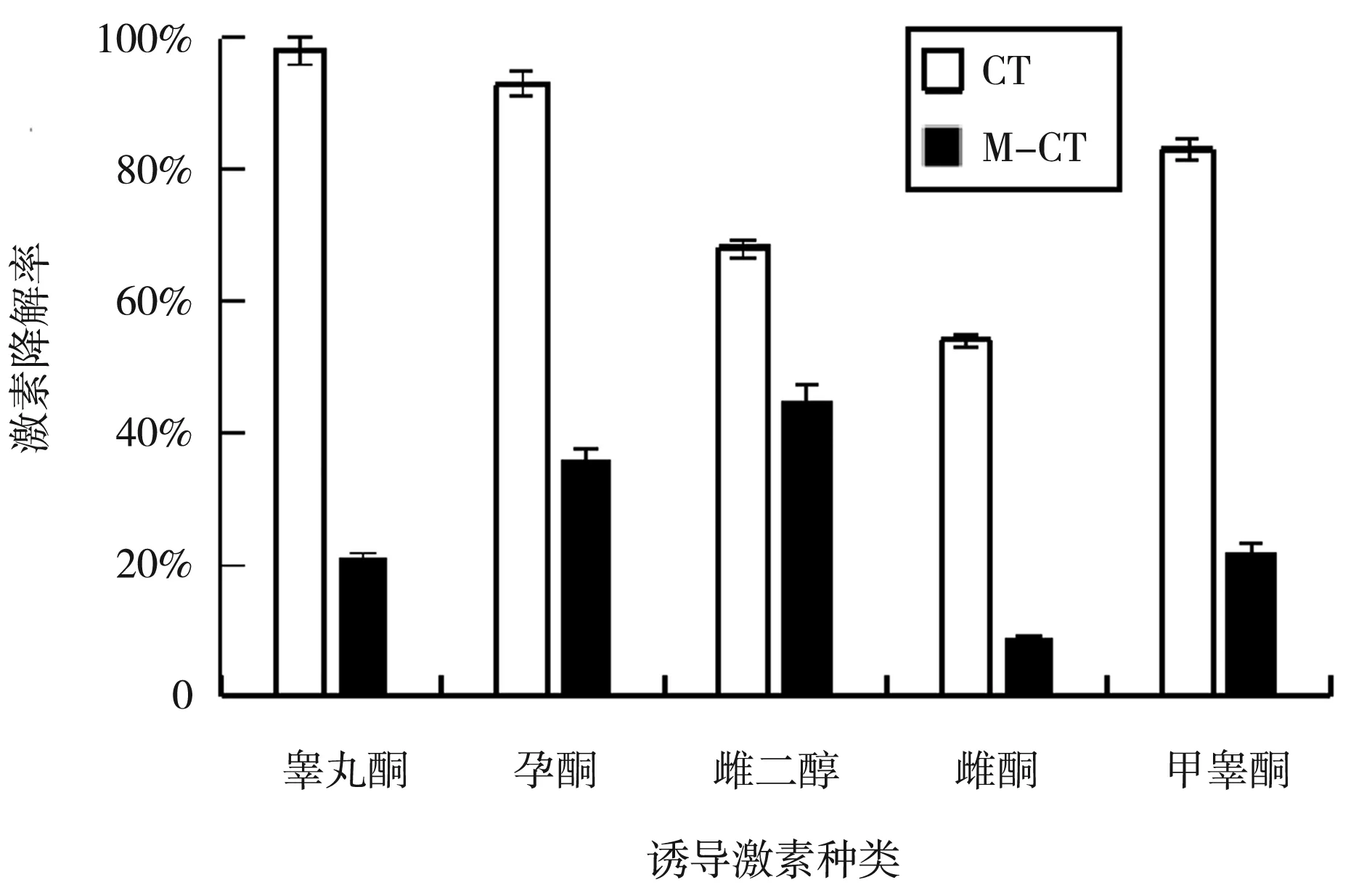
图4 野生型及敲除株激素降解量数据图
3.3 SDRx目的蛋白的表达纯化结果图
利用上述方法构建SDRx表达载体,将疑似阳性克隆子质粒进行双酶切并送由库美公司进行测序鉴定,基因序列未发生突变,并将阳性克隆子质粒转化到大肠杆菌BL21(DE3)p-LysS中,得到正确无突变的pET-SDRx-BL21(DE3)表达菌株。
经软件Protein Molecular Weight对SDRx的查询计算,带有组氨酸标签的重组蛋白分子量为29.2 kDa。如图5所示,第10泳道为NPI-200下洗脱的目的蛋白,条带清晰大小准确为29.2 kDa,纯化效果良好。
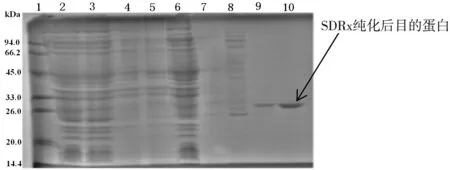
图5 SDRx蛋白聚丙烯酰胺凝胶电泳表征结果图
3.4 LysR,LuxR,TetR三种调控因子重组质粒验证
图6为pK18-107SDRx上启动子和SDRx基因的结构示意图。图7为以上述构建成功的pK18-107SDRx分别与pUC19-LysR/LuxR/TetR的共转菌株基因组为模板的PCR验证结果,其中1道的LysR为912 bp;2道的LuxR为1 125 bp;3道的TetR为660 bp,均为理想数值,即表明成功构建了三种共转化质粒。
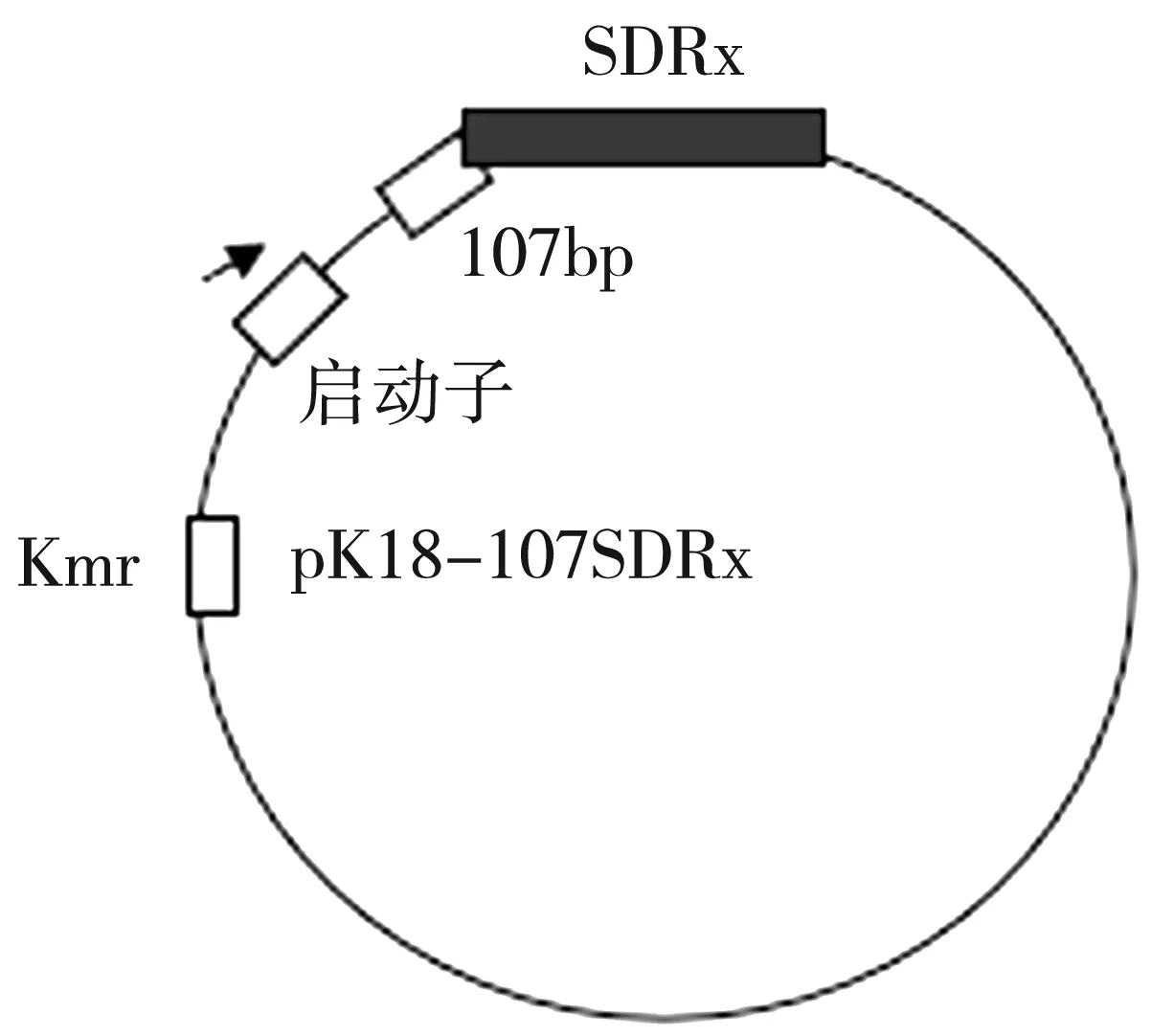
图6 pK18-107SDRx上启动子和SDRx基因的结构示意图
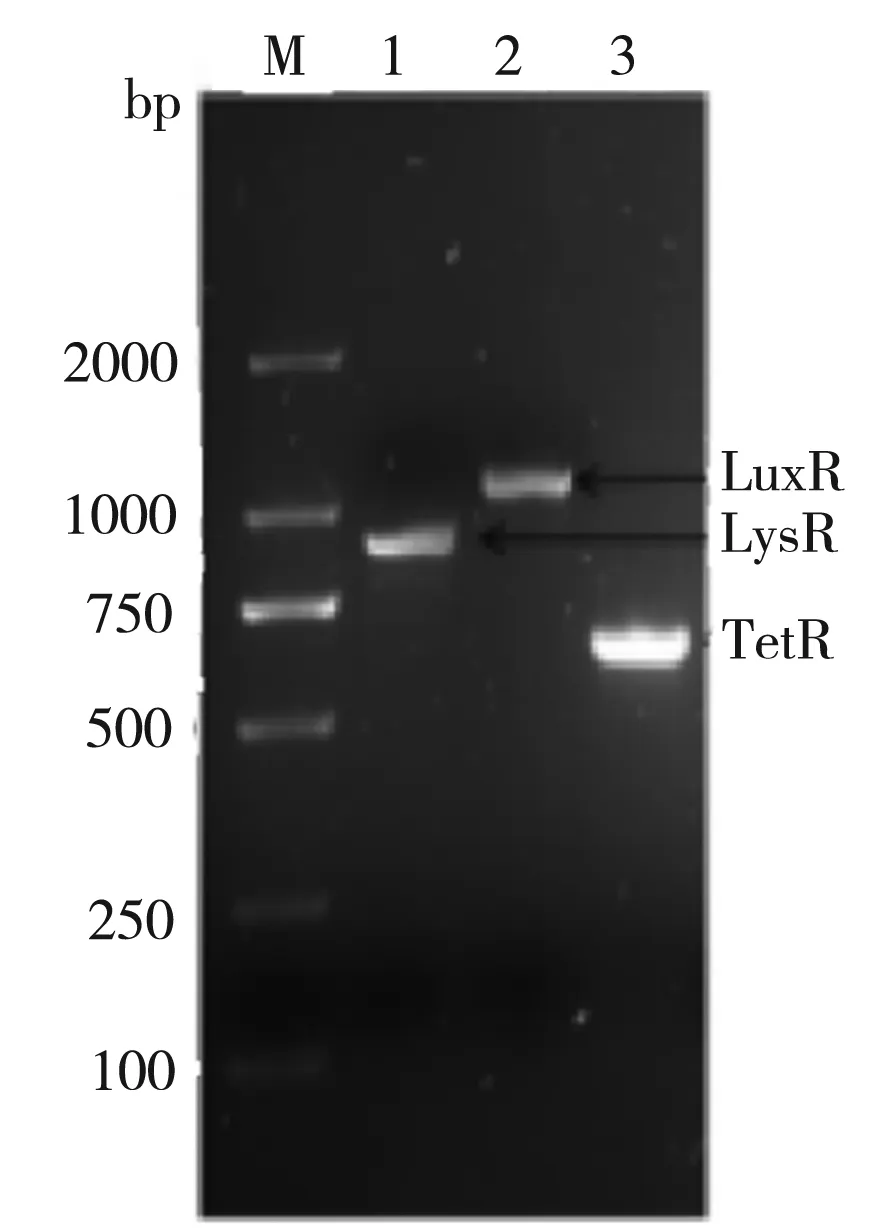
图7 LysR,LuxR,TetR重组质粒PCR鉴定
3.5 三种调控蛋白对SDRx脱氢酶调控作用的结果图
由3.2实验结果,即野生型CT菌对睾丸酮、甲睾酮及孕酮三种激素的降解能力较好,本实验选取了较有代表性的睾丸酮和孕酮作为底物,如图8所示。利用t检验及方差分析的统计学方法对三组数据进行分析,将LysR、LuxR、TetR重组共转质粒与pUC19重组共转质粒分组后对其显著性差异进行分析。与无调控蛋白的共转化菌株(pUC19空白对照组)数据对比,LysR调控蛋白在两种激素条件下对SDRx脱氢酶的表达量基本不变;LuxR和TetR调控蛋白在两种激素条件下对SDRx脱氢酶的表达起促进作用,且睾丸酮诱导条件下的促进作用尤为显著,其中睾丸酮条件下TetR的促进作用更明显大于LuxR。
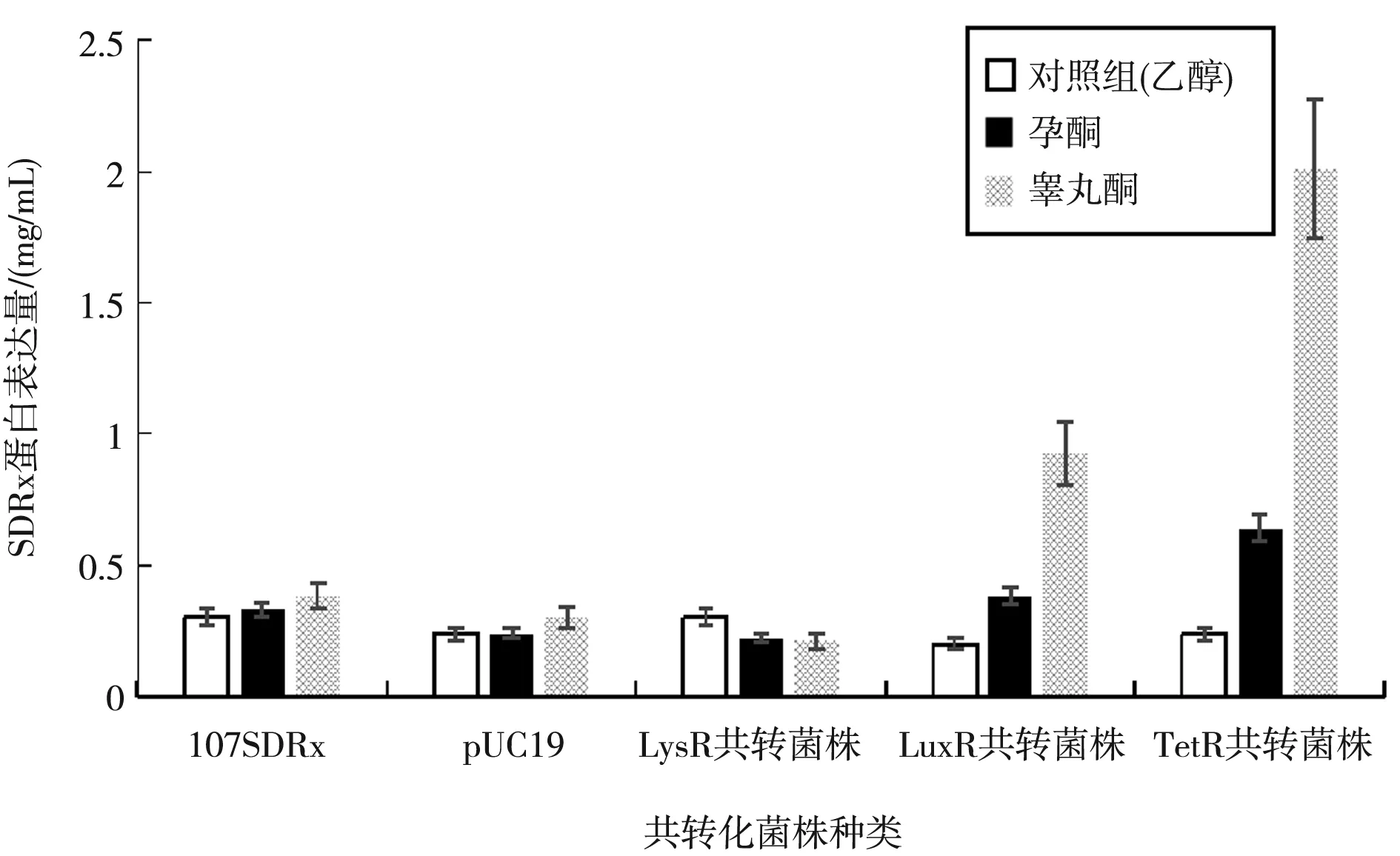
图8 三种调控蛋白共转菌株中SDRx蛋白的表达情况
4 结论与展望
本研究中的降解激素结果表明:敲除株对甾体类激素的降解能力均呈现出不同程度的减弱而不是完全丧失,这与之前发表的BKR,AKR,LuxR等基因敲除株[16-17]出现的情况相类似。可能是由于CT菌本身有一些同工酶或代偿途径,使得SDRx基因被敲除后,也会有其他途径(或酶)来完成激素降解,表现为其降解能力的减弱而不是消失。
LysR,LuxR,TetR分别对SDRx的调控结果可以得出如下结论:(1)在诱导物为睾丸酮时:与无调控蛋白的共转菌株(pUC19空白对照组)相比,“pTetR”的SDRx表达量提高了5.3倍,明显表现为正向促进作用;“pLuxR”的SDRx表达量提高了2.1倍,增加并不明显,但仍有正向促进调控作用;而“pLysR”的SDRx表达量则降低了0.3倍,可忽略不计,表明没有调控作用;(2)当诱导物为孕酮时,与无调控蛋白的共转菌株(pUC19空白对照组)相比,“pTetR”的SDRx表达量提高了1.6倍,表现为正向促进作用,但效果明显低于在睾丸酮的条件下;“pLuxR”、“pLysR”的 ELI‐SA结果对比无调控蛋白的共转菌株(pUC19空白对照组)分别为提高了的0.58倍、降低了0.08倍,数值较小可忽略不计,没有表现出调控作用。
在前人的工作中证明了CT菌中某些调控蛋白可以与诱导物、被调控基因三者之间的相互作用关系,并构建了动态调控模型[15],而本实验中又进一步证明了TetR能够对SDRx脱氢酶产生正调控。目前,对CT菌中甾体激素的全部代谢网络尚处于逐渐了解的过程中,在今后的工作中,随着研究的不断深入,还有几个问题亟需解决:(1)TetR作为调控蛋白,如何结合到SDRx的调控区?(2)作为诱导物的睾丸酮如何结合到TetR蛋白上?结合位点在哪里?这个结合中心空间大小与睾丸酮(孕酮)分子是否匹配?(3)睾丸酮和孕酮在作为诱导物时,三种调控蛋白分别与SDRx共转化后的ELISA结果所表现出的差异,是否是由于其与诱导物结合中心的匹配效果不同所引起的?(4)用分子互做的方法来检测TetR蛋白与睾丸酮分子的亲和常数是多少?(5)当TetR蛋白结合了睾丸酮后,它与SDRx基因的结合区又是否会产生变化?(6)CT菌中有大量的调控基因存在,TetR调控蛋白是否会与其他调控蛋白共同作用于SDR家族并对其产生调控?(7)所用的检测方法是否可以应用于环境中甾体类激素的微量检测等。随着研究的深入,可以更好地了解分析CT菌的代谢作用机理,构建出安全可靠、降解能力更强大的基因工程菌株。

