雄鼠生殖细胞中FHAD1表达与功能的初步研究
张茜,刘辰辰,张舒雅
(1.南京医科大学附属淮安第一医院,淮安市第一人民医院,淮安 223300;2.南京医科大学生殖医学国家重点实验室 组织胚胎学系,南京 210000;3.南京医科大学康达学院基础医学部,连云港 222000)
叉头相关的磷蛋白结合结构域(forkhead-associated phosphopeptide-binding domain,FHAD)普遍存在于原核生物和真核生物的多种蛋白质中[1-5]。在真核生物中DNA损伤检控点介导因子1(mediator of DNA damage checkpoint-1,MDC1)定位于DNA断裂位点,通过其FHAD区域募集到活化的细胞周期检查点激酶2(cell cycle checkpoint kinase 2,CHK2),并且在CHK2介导的DNA损伤应答中起关键作用[6]。在酵母和人类的细胞核中发现了许多含有FHAD的蛋白质,它们参与DNA损伤修复,细胞周期检测点调控、mRNA预处理等[3]。例如,发芽酵母的酿酒酵母检查点激酶RAD53(serine/threonine/tyrosine protein kinase RAD53,RAD53)中的FHAD2突变可阻止与磷酸化的细胞周期检测点蛋白Rad9(checkpoint clamp complex protein Rad9)结合,从而消除了DNA损伤引起的细胞周期停滞[7]。在人类中,酵母磷脂酸胞苷转移酶(CDP-diacylglycerol synthase 1,CDS1)的同源物CHK2/hCDS1包含FHAD,其参与了对DNA损伤的细胞周期检查点反应[7-11]。研究表明有FHAD的蛋白参与调控G2/M DNA损伤检查点,可防止带有DNA 损伤的细胞进入有丝分裂(M期)[7]。但当DNA损伤不能及时或准确地修复,就会导致基因突变、引起细胞死亡或肿瘤的发生。
已知叉头相关的磷蛋白结合结构域1(FHAD1)位于小鼠4号染色体,编码由236个氨基酸组成的蛋白。目前为止,对于FHAD蛋白家族中的FHAD1在小鼠雄性生殖功能领域的研究几乎为零。基于FHAD的相关功能性,本研究主要采用RT-PCR技术和Western Blot技术分别在基因和蛋白水平上对其在雄性小鼠生殖细胞的表达进行研究。磷酸化组蛋白H2AX(γH2AX)是检测细胞DNA双链断裂的敏感而有效的指标[12],磷酸化奈梅亨破损症候群1(Phosphorylated Nijmegen breakage syndrome 1,p-NBS1)是DNA损伤修复关键蛋白,并和其他蛋白组成基因修复复合体,其在DNA双链修复方面发挥重要作用[13]。利用RNA干扰技术,siRNA转染GC-2细胞干扰FHAD1表达,检测γH2AX、p-NBS1水平,初步探讨FHAD1在生精细胞DNA损伤修复中的作用机制。
材料和方法
一、实验材料
1.动物:0.5 d龄C57BL/6J雄性小鼠(0周龄)5只,体重约1.5 g;1周龄(5.5 d)雄鼠3只,体重约3 g;2周龄(14 d)雄鼠3只,体重约7 g;3周龄(21 d)雄鼠3只,体重约15 g;4周龄(28 d)雄鼠3只,体重约22 g;5周龄雄鼠(35 d)3只,体重约28克。成年雌、雄鼠(42 d)各3只,体重约32 g。均购于南京医科大学实验动物基地生产部,实验动物生产许可证号SCXK(苏)2021-0001。
2.细胞:小鼠精母细胞系GC-2来自美国ATCC细胞库。
3.主要试剂和仪器:蛋白酶抑制剂Cocktail(Merck,美国);DNA标志物DL1000(TaKaRa,日本);RNA抽提试剂盒(Qiagen,德国);反转录试剂盒 PrimeScriptRT Master Mix(TaKaRa,日本);牛血清白蛋白BSA(上海化学试剂有限公司);胎牛血清(Gibco,美国);DMEM(Invitrogen,美国);羊抗单克隆FHAD1抗体(Santa Cruz Biotech,美国);兔抗多克隆GAPDH、NBS1、pNBS1抗体(Abcam,英国);兔抗多克隆γH2AX抗体(Cell Signaling Technology,美国);山羊抗兔IgG、驴抗羊IgG(Thermo scientific,美国);ECL试剂盒(Perkin Elmer,美国);细胞转染试剂LipofectamineTM2000、Opti-MEM 无血清培养基(Invitrogen,美国)。
二、实验方法
1.动物取材、处理:颈椎脱臼法处死小鼠。取成年小鼠的心、肝脏、脾、肺、肾脏、脑、肌肉、肠、脂肪、卵巢和睾丸,取各周龄小鼠的睾丸组织,分别放入蛋白裂解液和Trizol中分别用于下一步的蛋白提取和RNA的提取。
2.细胞培养及RNA干扰实验:GC-2细胞用DMEM培养基加10%胎牛血清培养,培养在37℃、5%CO2的细胞培养箱中。细胞以2×105/孔的密度接种于6孔板。当细胞生长密度达到50%~60%时,转染siFHAD1(FHAD1敲低组)与siNC(南京吉玛,阴性对照组);siRNA:脂质体Lipofectamine 2000=1∶0.1(pmol∶μl),48 h后收集细胞。其中siFHAD1序列:正义链UUAAGACGUUUUCUUUCUGCU,反义链CAGAAAGAAAACGUCUUAAAU。
3.不同阶段生精细胞分离:利用密度梯度沉降法分离生精细胞,精原干细胞从0周小鼠睾丸获得,粗线期精母细胞从3周小鼠睾丸获得,圆形精子细胞从5周小鼠睾丸获得。颈椎脱臼法处死小鼠,取出睾丸并去白膜,用小剪刀将曲细精管剪碎至浆糊状,转移到50 ml离心管中,用克-亨氏液(武汉普诺赛)补至20~25 ml,冰上静置5 min,弃去上清。加入10 ml(1 mg/ml)胶原酶及10 μl(1 mg/ml)的脱氧核糖核酸酶I,37 ℃水浴振荡约10 min并不时用吸管吹吸,至生精小管消化成极小片段,镜检大部分生精细胞从生精上皮分离出来,后加入约30 ml预冷的克-亨氏液,终止消化。4℃、1 200 r/min离心5 min,弃上清,加入5 ml(浓度1 mg/ml)胰蛋白酶及10 μl(1 mg/ml)的脱氧核糖核酸酶I,37 ℃水浴振荡约10 min,并不时用吸管吹吸,至镜检视野里绝大部分是散在的单细胞,加入约30 ml预冷的0.5% BSA/克-亨氏液,终止消化。4℃,1 200 r/min,离心5 min,弃上清。细胞沉淀用0.5% BSA/克-亨氏液洗1次,4℃、1 200 r/min离心5 min,弃上清。最后细胞沉淀用15~20 ml 0.5% BSA/克-亨氏液悬浮并经40 μm细胞网筛过滤。重力密度梯度形成及上样等步骤参考文献报道[14]。
4.RT-PCR:Trizol法提取小鼠的各组织脏器以及各周龄小鼠睾丸RNA。用 RNA抽提试剂盒提取支持细胞、间质细胞、精原干细胞、粗线期精母细胞和圆形精子的RNA。然后反转录为cDNA,而后进行RT-PCR。引物序列见表1。PCR扩增条件:94℃ 5 min,94℃ 30 s,fhad1 57℃、β-actin57.5℃ 30 s,72℃ 30 s,72℃ 5 min。重复35个循环,4℃保存。

表1 扩增基因片段的引物序列
5.Western Blot:选用北京碧云天的RIPA蛋白裂解液以及细胞裂解液分别匀浆裂解成年小鼠各组织脏器和GC-2细胞,BCA法测定蛋白浓度,蛋白上样量为25 μg,SDS-PAGE电泳分离蛋白后转印至PVDF膜上;5%脱脂牛奶室温封闭1 h后弃去封闭液,TBS-T溶液洗3次,每次10 min;FHAD1抗体、NBS1抗体、pNBS1抗体、γH2AX抗体均按照1∶500比例稀释,GAPDH抗体按照1∶2 000比例稀释,4℃过夜;TBST溶液洗膜3次,每次10 min,加入1∶5 000稀释的二抗,室温下孵育2 h;TBS-T洗膜后加入ECL化学发光液显影。
三、统计学处理
结 果
一、fhad1基因在成年小鼠不同组织脏器表达水平
RT-PCR结果显示Fhad1 mRNA在小鼠的肺中略有表达,在睾丸中高表达,其他脏器中不表达(图1)。

图1 成年小鼠不同组织脏器fhad1 mRNA表达情况
二、FHAD1在成年小鼠不同组织脏器的蛋白表达情况
Western Blot检测结果显示,FHAD1蛋白情况与mRNA表达一致,在小鼠睾丸中高度表达,在肺中也有所表达(图2)。

图2 成年小鼠不同组织脏器FHAD1蛋白表达情况
三、fhad1基因在不同周龄小鼠睾丸的表达
RT-PCR结果显示fhad1 mRNA在2周小鼠睾丸开始表达,至3周开始表达量明显升高并持续表达至成年小鼠睾丸(图3)。

图3 不同周龄小鼠睾丸中的fhad1 mRNA表达情况
四、FHAD1蛋白在不同周龄小鼠睾丸中的表达情况
Western Blot检测FHAD1在不同周龄小鼠睾丸中的表达,结果显示FHAD1在2周小鼠睾丸开始表达,至3周开始表达量明显升高并持续表达至成年小鼠睾丸(图4),与RT-PCR结果一致。

图4 不同周龄小鼠睾丸中FHAD1蛋白表达情况
五、fhad1基因在小鼠不同阶段生精细胞中的表达
为了进一步探究fhad1基因在小鼠睾丸中的具体表达定位,我们采用STA-PUT分选出不同阶段的生精细胞后,RT-PCR检测在小鼠不同阶段生精细胞中fhad1基因表达情况。结果显示fhad1 mRNA主要在粗线期精母细胞和圆形精子细胞中表达(图5)。
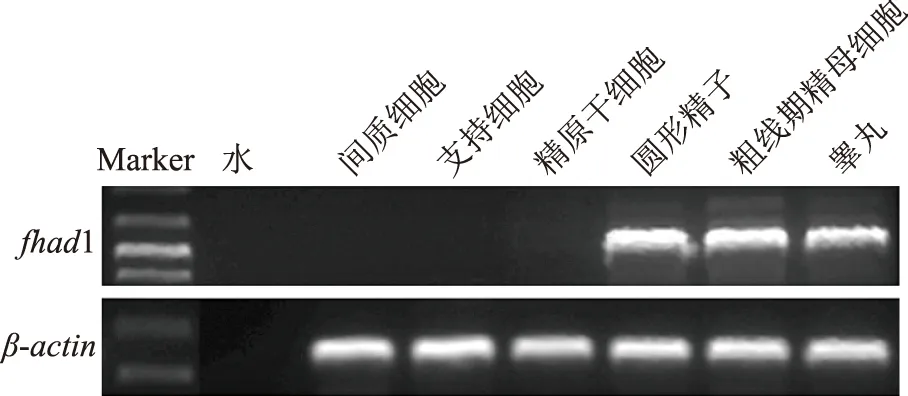
图5 小鼠不同阶段生精细胞中fhad1 mRNA表达情况
六、干扰FHAD1对DNA损伤修复相关蛋白的影响
为了研究FHAD1是否参与了DNA损伤修复,我们在GC-2细胞中瞬时转染外源性siFHAD1后继续培养48 h去敲低FHAD1的表达。Western Blot实验结果显示,转染siFHAD1后,FHAD1被成功敲低,表明siFHAD1转染效率较好;与阴性转染对照组相比,敲低FHAD1后DNA损伤分子标记物γH2AX水平显著上升[(1.99±0.14)vs.(0.99±0.10)]、DNA损伤修复关键蛋白p-NBS1水平显著下降[(0.24±0.07)vs.(1.01±0.10)](P<0.001)(图6)。

与阴性转染对照组比较,*P<0.001图6 FHAD1敲低后GC-2细胞γH2AX、NBS1、p-NBS1蛋白的表达变化
讨 论
DNA损伤会破坏机体细胞、组织及器官。DNA损伤的类型包括:点突变、缺失、插入、倒位或转位和双链断裂。为了确保细胞周期有序进展,有许多被称为细胞周期检查点蛋白的质量控制点。这些检测点蛋白能及时修复问题以保证细胞周期安全有序进行。目前,依据细胞周期的顺序循环分为:G1-S期检查点,S期检查点,G2期检查点和M期检查点。细胞周期调控需要大量的胞内外信号的配合,如果缺乏适当的信号,细胞将不能从一个阶段进入下一个阶段,这种现象称为细胞周期阻滞。当细胞周期正常时,如果DNA出现损伤,细胞周期停在相应检查点,细胞周期阻滞为细胞提供额外的时间用于修复损伤,从而减少突变的发生,避免肿瘤的产生。其中G2/M期阻滞,可以防止带有DNA损伤的细胞进入有丝分裂期,如果检查点失活,使损伤DNA进入有丝分裂期,引起基因的不稳定性,最终导致癌突变的积聚。因此细胞进化出了一种DNA损伤应激反应来修复DNA损伤,高度保守的DNA损伤修复应答机制可以维持基因组的完整性[15]。众所周知,与体细胞相比,生殖细胞对于DNA损伤更加敏感。在精子发生过程中,生物体自有DNA损伤修复机制能及时修复来源于外界环境或生物体自身产生的损伤[16]。目前已知的DNA损伤修复方式至少有5种,包括碱基切除修复、核苷酸切除修复、错配修复、双链断裂修复、直接修复等[17],其中DNA双链断裂(DNA doublestrand breaks,DSB)修复是非常重要的一种。已有研究表明包含FHAD的蛋白在细胞周期检验点调控和DNA损伤修复过程中起重要作用[18]。
精子发生是一个复杂的雄性生殖细胞分裂和分化的过程,其中包括精原细胞的有丝分裂,精母细胞的减数分裂和精子细胞的变形最终形成精子[19-21]。在小鼠精子发生过程中,2周左右开始出现粗线期精母细胞[22]。初级精母细胞的减数分裂,其前期时间很长,变化过程也很复杂,包括细线期、合线期、粗线期、双线期及终变期。粗线期时同源染色体联会完全,同源染色体之间非姐妹染色单体交换,此过程发生主要的遗传物质重组事件,细胞启动程序性的DSB并通过同源重组途径进行修复,以促进同源染色体的交换和分离。如果精母细胞在程序性DSB修复起始过程中染色体结构不能正常疏松,进而DNA损伤修复因子不能正确及时地招募到断裂位点,从而严重影响了程序性DSB的修复、同源染色体的联会及交叉互换等过程,最终造成雄性不育[23]。本研究中,RT-PCR和Western Blot实验均显示FHAD1在2周龄小鼠睾丸开始有所表达,并且随着周龄增加,表达量随之增多;而不同阶段生精细胞的RT-PCR结果显示fhad1 mRNA主要表达在粗线期精母细胞和圆形精子。以上结果提示我们FHAD1在雄性小鼠中可能参与了生精细胞的早期发育,并且可能参与了生精细胞的DNA损伤修复。
在DSB发生的同时,位于丝氨酸139位C-端保守区域内的H2AX磷酸化形成γH2AX。因此γH2AX的形成是DSB的一个标志[12]。本研究结果显示,干扰FHAD1表达后,DNA损伤分子标记物γH2AX蛋白表达增高,提示DNA损伤变多。NBS1在人类中也称为Nibrin,通常认为它是一种支架蛋白,用于指导DSB位点上的其他DNA损伤反应因子并与之结合。NBS1与DNA损伤位点附近的磷酸化组蛋白变体H2AX(γH2AX)相互作用,将MRE11/RAD50复合体转运到核中,复合体检测到断裂并激活共济失调毛细血管扩张突变基因(ataxia telangiectasia mutated Protein,ATM)。NBS1被ATM磷酸化,并激活下游蛋白质,如人体抑癌基因p53、乳腺癌1号基因(breast cancer susceptibility1,BRCA1)和CHK2来协助修复和控制细胞周期进程。因此NBS1作为激活DNA损伤修复信号传导的关键因子,在维持基因组的稳定和DNA损伤修复过程中起着重要的作用[24]。本研究发现干扰FHAD1表达能显著抑制DNA修复关键蛋白NBS1的磷酸化表达,因此,我们认为,FHAD1可能通过促进NBS1蛋白的磷酸化,进而促进精母细胞DNA的损伤修复能力。但是FHAD1参与DNA损伤修复的具体机制仍需要进一步深入研究。
综上所述,本研究初步探讨了FHAD1在雄性小鼠睾丸中的表达及功能,FHAD1为雄性小鼠睾丸特异蛋白,主要表达在粗线期的精母细胞以及圆形精子细胞中。下调FHAD1基因的表达使GC-2细胞的DNA损伤增加,机制可能与NBS1蛋白的磷酸化有关,为FHAD1在生殖细胞中的功能探讨提供了实验基础。

