甘草素抑制HMGB1的表达缓解造血干细胞移植后肝损伤
房 婷,孙鹏帅,刘 洁
(1.解放军第960医院,山东 济南 250031 2.解放军第69241部队(卫生连),新疆 昌吉回族自治州 831700 3.江苏省常州市第二人民医院血液内科,江苏 常州 213000)
造血干细胞移植是目前临床上治疗血液系统疾病的重要措施,但移植后的肝功能损伤严重影响预后及患者生活质量[1]。已有报道造血干细胞移植后肝损伤发生率约为60~80%[2,3]。如果总胆红素在4~7 mg/dL左右,移植后200d内患者死亡率达到50%;而如果总胆红素高于10 mg/dL,则患者死亡率将高达70%[4]。其发病机制比较复杂,造血干细胞移植后引起的肝小叶结构异常,中心静脉和肝窦狭窄、阻塞以及纤维蛋白沉积,肝细胞炎性细胞浸润是公认的普遍发病机制。目前,尽管在临床上采取毒性较小的预处理方案,如使用抗病毒和抗真菌药物进行预防、使用免疫抑制策略预防移植物抗宿主病和引入熊去氧胆酸等,在治疗以及预防造血干细胞移植引起的肝损伤方面取得了较大进步,但疗效并不尽人意[5]。因此,探求更加有效的临床药物对于缓解造血干细胞移植后引起的肝损伤迫在眉睫。高迁移率族蛋白B1(High mobility group box 1,HMGB1)是存在于真核生物细胞内一类典型的非组蛋白染色体结合蛋白,参与基因转录、DNA修复、细胞分化及细胞外信号传导[6]。当其释放到细胞外时,可以诱导多种细胞(如中性粒细胞、单核/巨噬细胞、树突细胞等)分泌并表达炎性介质,这些炎性介质的分泌又可反过来增加HMGB1的分泌,进而导致一系列炎症级联反应[7,8]。甘草素(glycyrrhizin,GL)是甘草根中的主要活性成分,具有抗炎、抗病毒等多种药理作用,在慢性病毒性肝炎的治疗中发挥重要作用。研究表明,甘草素可通过抑制HMGB1的活性缓解肝缺血再灌注损伤[9]。然而甘草素是否可以通过抑制HMGB1的表达改善造血干细胞移植后肝损伤还未见有报道,因此,本实验通过构建造血干细胞移植后肝损伤模型小鼠,并对模型小鼠进行甘草素灌胃给药处理,以探讨甘草素通过抑制HMGB1的表达,对造血干细胞移植后肝损伤的影响。
1 材 料
1.1动物:选用C57BL /6小鼠为供鼠(动物特征及来源同受体BALB /C小鼠),BALB/C小鼠为受鼠,清洁级雄性,8周龄,体重22~25g,购于上海斯莱克实验动物责任有限公司,许可证号:SCXK(沪)2017-0005。
1.2仪器:Fcc-8000型钴60(60Co)治疗机(山东新华医疗器械厂);Synergy H1型酶标仪(美国Bio-tek公司);SYD-S3050型石蜡切片机(沈阳誉德电子仪器有限公司);CX33型光学显微镜(美国奥林巴斯)。
1.3试剂:HMGB1 ELISA试剂盒(批号:CSB-E08225m,武汉华美生物工程有限公司);伊红染液和苏木素溶液(批号:714095,珠海贝索生物技术有限公司);两步法免疫组化试剂盒(批号:K92413A,北京中杉金桥生物技术有限公司);抗HMGB1抗体(批号:ZRB1002,美国Sigma);外源性HMGB1蛋白(批号:H4652,美国Sigma)。
1.4药物:甘草素(成都曼斯特生物科技有限公司,规格:20mg/支,纯度≥98%,批号:A0042)
2 方 法
2.1实验分组:受鼠按照初始体重随机分成对照组,模型组和甘草素处理组,每组各8只。其中对照组正常饲养,模型组和甘草素处理组进行手术。为了进一步验证HMGB1的作用,受鼠分为模型组、抗HMGB1组、甘草素处理组和甘草素+HMGB1组。
2.2小鼠造血干细胞移植后肝损伤模型建立
2.2.1手术前预处理:模型组和甘草素处理组小鼠在移植前一周饮用含抗生素(32万U/L庆大霉素+0.25g/L头孢曲松钠))饮用水。在移植前4h,接受60Co γ射线全身照射7.5Gy,剂量率为:0.67Gy/min。抗HMGB1组处理前腹腔注射100g/20g抗HMGB1(抗HMGB1溶于生理盐水,浓度为0.5mg/kg)。甘草素+HMGB1组处理前腹腔注射20mg/L的HMGB1蛋白,每只0.5mL。
2.2.2造血干细胞移植:将供体C57BL/6小鼠采用颈椎脱臼处死,碘伏浸泡5~8min后在超净工作台上取胫、股骨骨髓及脾脏,在无菌条件下制备骨髓细胞和脾细胞的单细胞悬液,调整细胞浓度为1×107/mL,通过尾静脉回输骨髓细胞(5×106个,0.5mL)和脾细胞(1×106个,0.1mL)细胞悬液诱导造血干细胞移植后肝损伤。
2.3给药方法:造血干细胞移植后,甘草素处理组小鼠采用甘草素灌胃(40mg/kg/d)。对照组和模型组给予同等剂量生理盐水,连续灌胃14d。
2.4肝脏脏器系数测定:小鼠处死前称每只活鼠的体质量,处死后称取肝脏的湿重。肝脏脏器系数=肝脏湿重(g)/活鼠体质量(g)×100%。
2.5标本采集:移植后第15天麻醉小鼠并处死,收集全血和肝组织。取血采用摘眼球取血法,具体操作为:操作者左手固定小鼠,拇指轻压取血侧眼部皮肤使眼球充血突出,再用弯镊夹取眼球,收集眼眶内流出的血液。将血液分别置于两个含有乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的采血管中,其中一个采血管在室温静置30 min后,3000 rpm离心10 min取上清获得血浆,备用,另一个采血管不做处理,置于4℃冰箱保存备用。摘取肝组织后其中一部分放入液氮速冻并保存于-80℃冰箱;另一部分用10%中性甲醛溶液固定后,用乙醇进行梯度脱水,石蜡包埋。
2.6指标检测
2.6.1ELISA检测血浆HMGB1含量,谷丙转氨酶(ALT)、谷草转氨酶(AST)及总胆红素(TBIL)含量,以及肝组织中炎性相关因子的水平:在移植术后第15天,小鼠摘取眼球采血,按照相应的ELISA试剂盒说明检测血浆中HMGB1、ALT、AST以及TBIL含量。
2.6.2免疫组化法观察肝组织中HMGB1的表达:切片经脱蜡、水化、室温孵育、抗原修复、封闭非特异性位点后,切片滴加稀释为1∶100的兔抗HMGBl一抗,37℃孵育1h,4℃冰箱过夜,滴加适当稀释比例的HRP标记的二抗,37℃孵育1h,以二氨基联苯胺(DAB)显色,苏木素复染封片。阴性对照以PBS替代一抗。在光镜下观察染色结果,其中呈棕黄色的细胞为阳性表达细胞。
2.6.3实时荧光定量PCR法检测肝组织中HMGB1 mRNA的表达水平:①RNA提取:小鼠处死后,取肝组织,置于无菌EP管中冻存。按照RNA提取试剂盒的说明书抽提各组小鼠的肝组织总RNA,储存于-20℃。②逆转录合成cDNA:提取的RNA根据逆转录试剂盒的说明分两步法进行逆转录。③实时荧光定量PCR扩增:以cDNA为模板,对肝组织HMGB1、IL-1β、IL-6和TNF-α进行实时荧光定量PCR扩增。引物见表1。

表1 实时荧光定量PCR引物序列
2.6.4HE染色观察肝组织病理:摘取的肝脏组织用10%中性甲醛固定后,用石蜡将组织标本包埋,后进行切片。将石蜡切片用二甲苯脱蜡,用不同浓度梯度的乙醇脱水,后进行苏木精-伊红(hematoxylin-eosin,HE)染色,于显微镜下观察各组受鼠肝细胞、血管内皮损伤、炎症细胞浸润以及肝小静脉闭塞情况。

3 结 果
3.1甘草素对受鼠肝脏指数的影响:模型组的肝脏脏器指数较对照组显著增加(P<0.05);与模型组相比,甘草素处理组肝脏指数明显降低(P<0.05)。见表2。
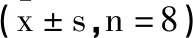
表2 甘草素对受鼠肝脏指数的影响
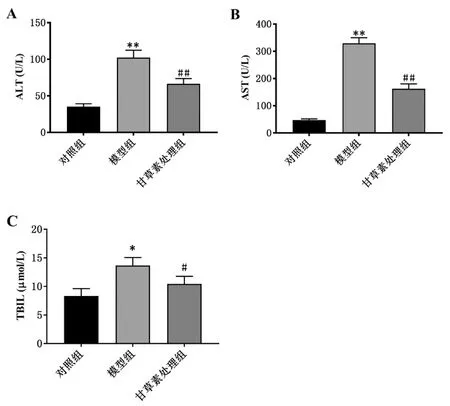
图1 各组小鼠血浆ALT、AST水平及TBIL的比较
3.2甘草素对受鼠血浆中ALT、AST和TBIL的影响:为了解各组小鼠肝功能水平,检测血浆ALT、AST和TBIL含量变化,见图1。结果显示:造血干细胞移植后,小鼠血浆ALT及AST值相对于对照组均显著升高(P<0.01),TBIL水平升高(P<0.05)。经甘草素处理后,小鼠血浆ALT和AST水平相对于模型组显著降低(P<0.01),TBIL水平较模型组降低(P<0.05)。
3.3甘草素对受鼠肝组织病理学的影响:对各组小鼠肝脏进行HE染色,根据肝脏组织形态变化及肝脏病理学变化,评价肝损伤情况(图2)。对照组肝小叶结构清晰,肝细胞排列整齐有序,无病理改变。造血干细胞移植后小鼠出现不同程度的肝损伤:其中模型组小鼠肝小叶正常结构受损,肝细胞排列紊乱,胞质内出现空泡,胞核固缩甚至坏死,出现炎性细胞浸润;移植后经甘草素处理的小鼠,肝组织病理改变明显好转,肝小叶结构部分恢复,肝细胞坏死减轻,炎症细胞浸润减少。
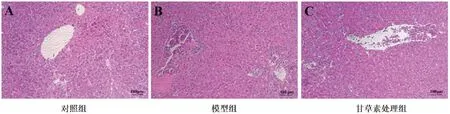
图2 各组小鼠肝组织HE染色(×200)
3.4甘草素对受鼠肝组织TNF-α、IL-6及IL-1β的影响:用实时荧光定量PCR法检测各组小鼠肝组织TNF-α、IL-6和IL-1β水平(图3)。结果表明:与对照组相比,模型组肝组织中TNF-α、IL-6及IL-1β的水平显著升高(P<0.01);与模型组相比,甘草素处理组TNF-α和IL-6的水平显著降低(P<0.01),IL-1β水平降低(P<0.05)。
图3 各组小鼠肝组织TNF-α、IL-6和IL-1β水平
3.5甘草素对受鼠肝组织和血浆HMGB1表达的影响:免疫组化法检测结果显示(图4A),对照组核内及胞浆内均有少量浅褐色颗粒;造血干细胞移植后可见胞浆内褐色颗粒显著增多,甚至部分在肝组织内融合成片,形成褐色片状;经甘草素处理后,小鼠肝组织中褐色颗粒明显变少。半定量分析结果显示(图4B):与对照组相比,模型组肝组织中HMGB1蛋白表达量显著升高(P<0.01);与模型组相比,甘草素处理组肝组织中HMGB1蛋白表达量显著减少(P<0.01)。运用实时荧光定量PCR检测肝组织中HMGB1 mRNA表达情况(图4C),结果显示:与对照组相比,模型组肝组织中HMGB1 mRNA表达水平显著升高(P<0.01);与模型组相比,甘草素处理组HMGB1 mRNA表达水平显著降低(P<0.01)。ELISA检测血浆HMGB1含量(图4D),与对照组相比,模型组血浆中HMGB1水平显著升高(P<0.01);与模型组相比,甘草素处理组血浆HMGB1水平显著降低(P<0.01)。
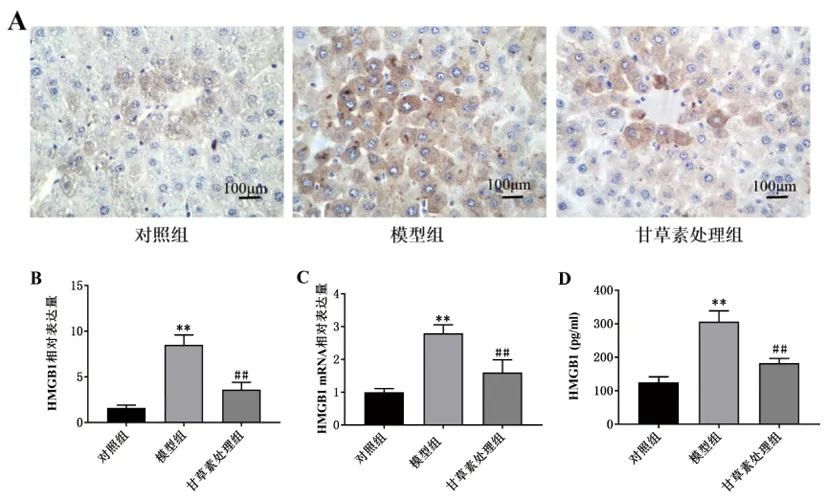
图4 各组小鼠肝组织和血浆中HMGB1水平
3.6抗HMGB1小鼠的血浆和肝组织中HMGB1的表达:抗HMGB1组小鼠和甘草素处理组小鼠的血浆和肝组织HMGB1较模型组降低(P<0.01)。HMGB1处理逆转了甘草素对HMGB1的抑制作用(P<0.01)。见图5。
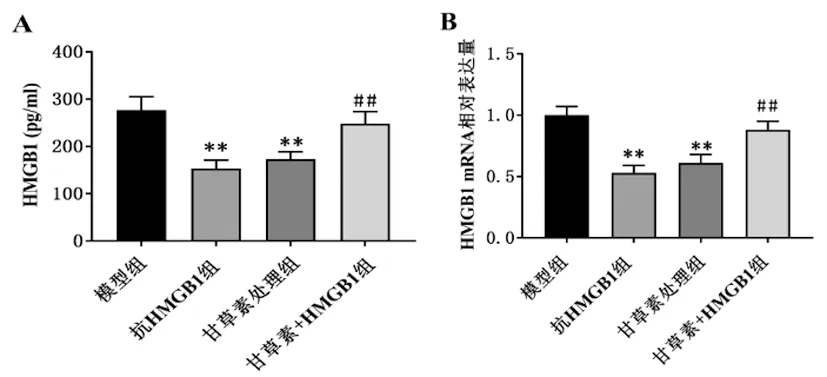
图5 HMGB1在血浆和肝组织中的表达
3.7HMGB1在造血干细胞移植后肝损伤中的作用:抗HMGB1组小鼠和甘草素处理组小鼠的血浆ALT、AST和TBIL水平较模型组显著降低(P<0.01)。HMGB1处理逆转了甘草素对ALT、AST和TBIL水平的抑制作用(P<0.05)。抗HMGB1组小鼠和甘草素处理组小鼠的肝组织中TNF-α、IL-6和IL-1β的表达显著低于模型组(P<0.01)。HMGB1处理小鼠逆转了甘草素对TNF-α、IL-6和IL-1β表达的抑制作用(P<0.05)。见图6。
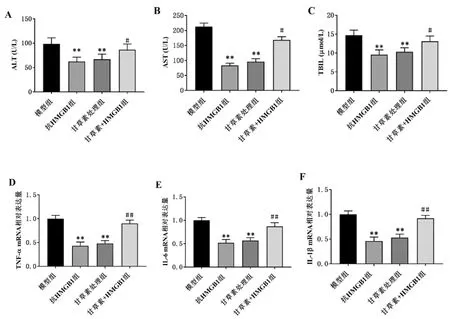
图6 HMGB1在造血干细胞移植后肝损伤中的作用
4 讨 论
肝脏损伤是造血干细胞移植后的重要并发症之一。研究表明,炎性相关因子在肝脏损伤的发生发展中起着重要作用,与肝损伤的程度有密切关系[10]。张景豪等[11]研究表明肝损伤时肝组织内存在明显的炎性细胞的浸润及肝细胞变性坏死,经治疗肝损伤减轻时观察到肝组织内炎性细胞浸润情况明显好转。本研究以C57BL/6小鼠为供鼠,BALB/C小鼠为受鼠建立造血干细胞移植后肝损伤模型。结果显示,移植后小鼠肝小叶正常结构受损,肝细胞排列紊乱,胞质内出现空泡,胞核固缩甚至坏死,出现炎性细胞浸润。同样地,对肝组织中炎性因子的检测也说明移植后小鼠炎症水平明显升高。而经甘草素灌胃处理后,小鼠肝组织病理改变好转,肝小叶结构部分恢复,肝细胞坏死减轻,炎症细胞浸润减少。以上研究结果说明甘草素具有优良的抗炎活性,可以缓解造血干细胞移植后肝损伤。
甘草的主要化学成分以三萜类皂苷和黄酮类为主。三萜类皂苷,如甘草酸及甘草酸二铵等具有明显的抗炎活性。黄酮类,包括甘草素、异甘草素和甘草苷等也表现出明显的抗炎活性。说明甘草中的三萜类皂苷和黄酮类物质在抗炎中均表现出巨大的潜力。而有研究发现甘草素是高迁移率族蛋白B1(HMGB1)的抑制剂,可以直接与细胞外的HMGB1结合,减少其与下游信号的作用,并且可以反过来减少HMGB1的主动分泌[12]。HMGB1是HMG蛋白超家族中的一员,是一种保守的非组蛋白核蛋白,广泛分布于淋巴、肝、脑、肺、心等组织中,由215个氨基酸组成,分子量在25~30kDa之间[13]。以往研究表明,HMGBl在多种疾病的发生发展中起重要作用,如肝缺血再灌注损伤[14]等。黄镇林[15]的研究表明:在肝损伤小鼠模型中,血清HMGB1水平明显升高,而甘草素和甘草苷可减少血清HMGB1水平。本研究使用甘草素和抗HMGB1抗体处理小鼠可降低血浆及肝组织中HMGB1表达,并缓解造血干细胞移植后的肝损伤,而腹腔注射HMGB1逆转了甘草素对肝损伤的缓解作用,说明HMGB1对造血干细胞移植后肝损伤有促进作用,且甘草素可以通过抑制HMGB1的表达缓解造血干细胞移植后肝损伤。
在本研究中,模型组小鼠血浆HMGBl水平显著升高,经甘草素处理后血浆HMGB1显著降低;免疫组化法检测结果显示,造血干细胞移植后可见胞浆内褐色颗粒即HMGB1显著增加,甚至形成褐色片状;经甘草素处理后,肝组织中褐色颗粒明显变少,即HMGB1含量降低;肝组织中HMGB1 mRNA的表达也显示出同样的趋势。抗HMGB1抗体处理缓解造血干细胞移植后肝损伤,而HMGB1处理可逆转甘草素对造血干细胞移植后肝损伤的缓解作用。综上所述,本研究探索了HMGB1在造血干细胞移植后肝损伤中的表达情况,并初步明确HMGB1对造血干细胞移植后肝损伤的促进作用,明确了甘草素可以通过抑制HMGB1的表达缓解造血干细胞移植后肝损伤,为造血干细胞移植后肝损伤的临床治疗提供新的思路。

