栉孔扇贝对8:2FTCA的代谢转化与氧化应激响应
刘晓玉,国 佼,王 智,谭志军,翟毓秀,郭萌萌*
栉孔扇贝对8:2FTCA的代谢转化与氧化应激响应
刘晓玉1,2,国 佼3,王 智4,谭志军2,翟毓秀2,郭萌萌2*
(1.上海海洋大学食品学院,上海 201306;2.中国水产科学研究院黄海水产研究所,农业农村部水产品质量安全检测与评价重点实验室,山东 青岛 266071;3.广州燃石医学检验所有限公司,广东 广州 510300;4.青岛市产品质量监督检验研究院,青岛市产品质量检验技术研究所,山东 青岛 266101)
以栉孔扇贝()为受试生物,研究了栉孔扇贝对8:2氟调聚羧酸(8:2FTCA)的代谢转化特征以及代谢过程中靶器官的氧化应激响应.结果发现,栉孔扇贝可将8:2FTCA转化为8:2氟调聚不饱和酸(8:2FTUCA)、7:3氟调聚羧酸(7:3FTCA)、全氟辛酸(PFOA)、全氟壬酸(PFNA)和全氟庚酸(PFHpA)等代谢产物.栉孔扇贝鳃和肝脏中代谢产物总量最高,为8:2FTCA的主要代谢靶器官.与本课题组前期虾夷扇贝的相关研究相比,8:2FTCA在栉孔扇贝与虾夷扇贝体内的生物转化行为主要有3方面相似之处:检测到的代谢产物相同、代谢靶器官相同以及鳃是最终代谢产物PFOA生成和蓄积的主要场所;不同之处主要体现在栉孔扇贝中代谢产物以7:3FTCA占比较高,虾夷扇贝中则是PFOA占比较高.同时在8:2FTCA暴露过程中,栉孔扇贝靶器官的关键抗氧化酶出现了一定的应激效应.丙二醛(MDA)和谷胱甘肽(GSH)等氧化应激指标以及谷胱甘肽过氧化物酶(GSH-Px),超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等抗氧化酶系出现不同程度变化:GSH-Px在整个代谢转化过程中呈现抑制效应;SOD,CAT活性在鳃中呈诱导效应,而在肝脏中呈现明显的剂量-效应关系,低剂量组中均呈抑制效应,高剂量组中大部分时间呈诱导效应.GSH和MDA含量不仅表现出剂量-效应关系,组织间也存在差异.暴露实验结束后,生理指标均有不同程度恢复.
氟调聚羧酸(FTCAs);全氟烷基羧酸(PFCAs);生物转化;抗氧化酶系;栉孔扇贝
全氟烷基羧酸(PFCAs)是由氟化碳链(F(CF2))和羧酸基团(-COOH)组成的一类全氟或多氟烷基物质(PFAS),具有持久性、难降解性及生物富集性,其中全氟辛酸(PFOA)是环境中分布最广泛的PFCAs,也是环境中多种PFAS的最终转化产物[1-3].氟调聚羧酸(FTCAs)等氟调聚物是PFCAs的主要前驱物,已在水体、土壤以及生物体中检出.如澳大利亚的废水样品中首次检测到FTCAs[4];在美国废弃物渗透液中也检测到FTCAs的存在[5];在胶州湾采集的海水及菲律宾蛤仔样本中均检测到FTCAs,含量分别为0~0.773ng/L,0.534ng/g[6];黄海中游的水相和颗粒相中也有FTCAs的检出[7].研究表明,前驱物FTCAs经生物富集后可在生物体内发生一系列水解、氧化、脱氟、脱氢等反应生成半衰期更长的PFCAs[8-11],且前驱物在代谢过程中的生物转化是生物体内PFCAs尤其PFOA残留的重要来源和途径[9,12].目前,已有多项研究表明8:2 氟调聚醇(8:2FTOH)可在鼠类、鱼类、人类肝细胞中转化成8:2FTCA,随后生成多种PFCAs[13-15].PFCAs毒性主要表现为肝脏毒性、免疫毒性、生殖和发育毒性以及潜在的致癌性[8,16-18].氟调聚物及其代谢产物PFCAs可在食物链中富集和放大[19],并且有远距离传输能力[20],其环境污染状况、迁移转化规律及其引起的健康问题倍受关注.如Mahiba等[21-22]首次在办公和家庭环境的室内空气和灰尘中检出前驱物FTOHs的存在,其中8:2FTOH浓度高达28900pg/m3;夏慧等[23]指出室内灰尘中含有PFCAs,且PFOA的检出率达到100%.而在北极生物食物网[24]中,PFOA的检出浓度为ng/kg级别,且处在食物链上层的动物生物积累趋势更加明显.阿拉斯加、加拿大和格陵兰岛的北极熊体内[20,25]也检测到PFCAs的存在.因此,研究FTCAs暴露下生物体的代谢转化,可弥补挥发性前驱物FTOHs在暴露过程中的操作不便并减少FTOHs参与其他代谢路径的损失,能更直接发现FTCAs在生物体内的代谢路径及代谢产物,评价其对生态环境及人体健康的影响具有重要意义.
8:2FTCA在生物体内富集后,通过组织分布、代谢和消除途径,母体化合物及其代谢产物会对宿主造成危害.如8:2FTCA在紫贻贝体内可代谢转化生成8:2FTUCA,7:3FTCA,PFOA和PFHpA等代谢产物[26].8:2FTCA的中间代谢产物8:2FTUCA能够与GSH中的巯基等亲核基团发生共价反应,生成GS-8:2FTUCA和GS-8:2FTUAL,使部分酶丧失功能[27].代谢终产物PFOA的短期暴露能够引起黑头鱼和虹鳟肝脂肪酰基-CoA氧化酶活性和氧化损伤增加以及改变激素水平[28,29],由PFOA暴露引起的氧化损伤是引发机体肝脏毒性和发育毒性的主要原因之一[30].PFOA暴露能够引起罗非鱼肝脏细胞谷胱甘肽(GSH)含量降低,丙二醛(MDA)含量升高,同时伴随着谷胱甘肽过氧化物酶(GSH-Px)活性下降以及超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性升高[30].与PFCAs相比,FTCAs和氟调聚不饱和酸(FTUCAs)的毒性阈值数量级更小[31],表明PFCAs前驱物的毒性比PFCAs更强,且会干扰细胞生化进程,破坏脂质代谢以及氧化过程[32-33].因此,8:2FTCA及其代谢产物的存在可能会激活或抑制生物体内相关酶的活性,进而影响生物的氧化胁迫响应.
双壳贝类能累积较高浓度的污染物,可作为污染物的指示性生物.目前,双壳贝类对FTCAs的代谢转化与氧化应激响应的研究报道甚少.课题组前期已获得8:2FTCA在虾夷扇贝体内代谢的探索性研究结果,但8:2FTCA在贝类体内的代谢途径仍需不断完善,且缺乏氧化应激方面的相关研究.本研究以栉孔扇贝为受试生物,采用半静态海水暴露方式,研究8:2FTCA及其代谢产物在栉孔扇贝中的代谢转化以及氧化应激标志物的变化,进一步解析8:2FTCA在栉孔扇贝中的代谢动力学规律及栉孔扇贝对8:2FTCA氧化应激响应,以期为贝类体内PFCAs的内源生成机制和环境生态风险评价提供科学依据.
1 材料与方法
1.1 仪器与试剂
仪器:LC-20A超高效液相色谱仪(日本Shimadzu公司),QTRAP 5500三重四极杆复合线性离子阱质谱仪(美国AB Sciex公司),T18basic型均质机(德国IKA公司),CS 55-9真空冷冻干燥机(丹麦Scanlaf公司),XW-80A旋涡混合器(上海医大仪器厂),Elmasonic E300超声清洗机(德国艾尔玛公司),Himac CR 22GⅡ高速离心机(日本Hitachi公司),N-EVAP 112氮吹仪(美国Organomation公司),57250-U固相萃取装置(美国Supelco公司), Milli-Q超纯水仪器(美国Millipore公司),V1800可见分光光度计(尤尼柯(上海)仪器有限公司), iMark168-1130酶标仪(美国Bio-Rad公司),Neofuge 15R台式高速冷冻离心机(上海力康生物医疗科技控股有限公司),HWS-26电热恒温水浴锅(上海圣科仪器设备有限公司).
试剂:PFCAs和FTCAs标准物质及内标物质,纯度均>99%(加拿大Wellington Labortories公司).内标物质包括:[13C4]-全氟辛酸(MPFOA),[13C2]-8:2氟调聚酸(M8:2FTCA) 和[13C2]-8:2氟调聚不饱和酸(M8:2FTUCA).
甲醇,乙腈(LC-MS级,美国Merk公司);乙酸铵(HPLC级,美国Sigma Aldrich公司);水(LC-MS级,美国赛默飞世尔公司);Oasis WAX固相萃取柱(150mg,6mL,美国Waters公司);Supelclean ENVI- Carb固相萃取柱(美国Sigma Aldrich公司);氨水(ACS级,美国Sigma Aldrich公司);丙酮(HPLC级,美国J.T.baker公司);GSH,MDA,GSH-Px,SOD和CAT酶活力测试盒均购自南京建成生物工程研究所;其他未作特殊说明的试剂均为分析纯.
1.2 实验用贝
成体栉孔扇贝购置于青岛胶南养殖场(中国,青岛).选取个体大小均匀、健康无伤的栉孔扇贝作为实验用贝,实验前清洗并暂养3~4d.实验用贝规格为体重(33.5±6.57)g,体长(44.6±6.98)cm,体宽(39.7± 3.36)cm,高(14.0±1.54)cm.实验所用海水采集于远离工业和生活区的近海海域,属I类海水.
1.3 8:2FTCA暴露实验
栉孔扇贝随机分为空白对照组、低剂量组(1μg/L)和高剂量组(5μg/L)三个实验组,每个实验组随机放置180只扇贝.海水温度控制在(16±1)℃,保证盐度相对稳定,连续充氧,每日更换一次海水并正常投放螺旋藻().
每个实验组分别在1,3,6,12,24,36,48,52,60,72, 96,144,216,336h随机选取6只栉孔扇贝,并迅速解剖得到闭壳肌、外套膜、鳃、肝脏和性腺5种组织,冷冻干燥后用于8:2FTCA及其代谢产物的测定.同时,每个实验组分别在6,12,24,36,48,72,144,336h随机选取9只栉孔扇贝,并对鳃和肝脏组织采样,冻存于-80℃用于MDA,GSH,GSH-Px,SOD和CAT 5个氧化指标的测定.
1.4 样品分析与质量控制
1.4.1 样品前处理 贝样前处理参考国佼等[34]方法:准确称取0.5g冻干样品于聚丙烯(PP)离心管中,加入100mL 10mL/L的内标(MPFOA,M8:2FTCA和M8:2FTUCA);肝脏样品加入400mL内标,室温静置10min,加入5mL 90%乙腈水溶液,涡旋混匀后超声提取15min,6000r/min离心5min,重复提取,提取液于40℃下氮吹至约1mL.用6mL水稀释提取液后,过Oasis WAX固相萃取柱(使用前依次用5mL甲醇和5mL水活化),用1mL 2%甲酸水溶液和1mL 5%甲醇溶液淋洗,再将Envi-carb小柱(使用前用5mL水活化)串联至Oasis WAX 固相萃取柱下方,用4mL 2.5%的氨水丙酮溶液洗脱,洗脱液于40℃下氮吹至干,后用50%甲醇水溶液定容至0.25mL(肝脏样品1mL), 12000r/min高速离心5min,将上清液过0.22µm滤膜,待测.
粗酶液提取:将冻存于-80℃的鳃和肝脏组织用生理盐水冲洗并拭干.按照试剂盒说明书(南京建成生物工程研究所)进行操作,测定栉孔扇贝肝脏和鳃组织中GSH和MDA含量以及GSH-Px,SOD,CAT酶活性大小.
1.4.2 仪器分析 液相色谱条件:分析色谱柱Kinetex XB-C18(2.1mm×100mm,2.6µm);延迟色谱柱: C18(2.1mm×50mm,5 µm);柱温:40℃;流速:0.3mL/min;进样量:5µL;流动相A:5%的甲醇水溶液(含5mmol/L乙酸铵),流动相B:95%的甲醇水溶液(含5mmol/L乙酸铵);洗脱梯度:0~1.5min,10% B;1.6~2.0min, 10%~ 40% B;2.1~5.0min,40%~60% B;5.1~14min,60%~ 98% B;14.1~16.0min,98% B;16.1~18.0min,10% B.
质谱条件:电喷雾离子源(ESI),多反应监测(MRM),负离子模式;喷雾电压:-4.5kV;气帘气压力: 0.24MPa;碰撞气压力:0.02MPa;温度500℃;碰撞室入口电压:-10V;碰撞室出口电压:12V;驻留时间:20ms;离子源Gas1:0.34MPa,Gas2:0.34MPa.其他参数见参考文献[24].
1.4.3 质量控制与保证 为避免外源性污染,全程避免使用聚四氟乙烯材质的色谱管路和器皿,且实验器皿均采用PP材质,使用前用甲醇充分清洗.定量分析采用标准曲线校正,同位素内标法定量.本研究在整个实验过程中检测出6种化合物,检出限分别为:PFHpA,PFOA,PFNA和8:2FTCA为0.01ng/g; 8:2FTUCA,7:3FTCA为0.02ng/g.目标化合物回收率范围为75.2~117% ,相对标准偏差(RSD)为5.0%~ 11.7%.采用至少5个浓度点进行标准曲线的绘制,且线性相关系数达0.995以上.
1.5 数据分析
本研究中PFAS含量均以干重(dw)计,氧化指标以湿重(ww)计.实验结果均以平均值±标准差(mean±SD)表示,其中氧化指标数据通过SPSS 22.0统计软件,并采用Students t-test法检验剂量组与空白对照组之间的差异,各剂量组与空白对照组显著差异(值<0.05),在图中表现为*.数据图表、动力学参数如半衰期(tau)、代谢速率(e)、浓度-时间曲线面积(AUC)采用Origin Pro 2016进行分析.
实验中采用具有时间常数参数的三阶段指数衰减函数[13]来拟合代谢产物在组织中的吸收、分布和代谢过程随时间变化的动态规律,拟合时的迭代算法为正交距离回归法,函数的一般表达式为:

式中:C为不同采样点栉孔扇贝组织中目标物的含量,ng/g;C=0是实验初始时目标物的含量,ng/g;C1,C2, C3分别为吸收、分布和代谢时目标物的含量,ng/g,1,2,3分别为吸收、分布和代谢时间,d;e1,e2,e3分别为吸收、分布和代谢阶段的消除速率常数,h-1.
半衰期计算公式为:

2 结果与讨论
2.1 8:2FTCA及其代谢产物在栉孔扇贝内的组织分布
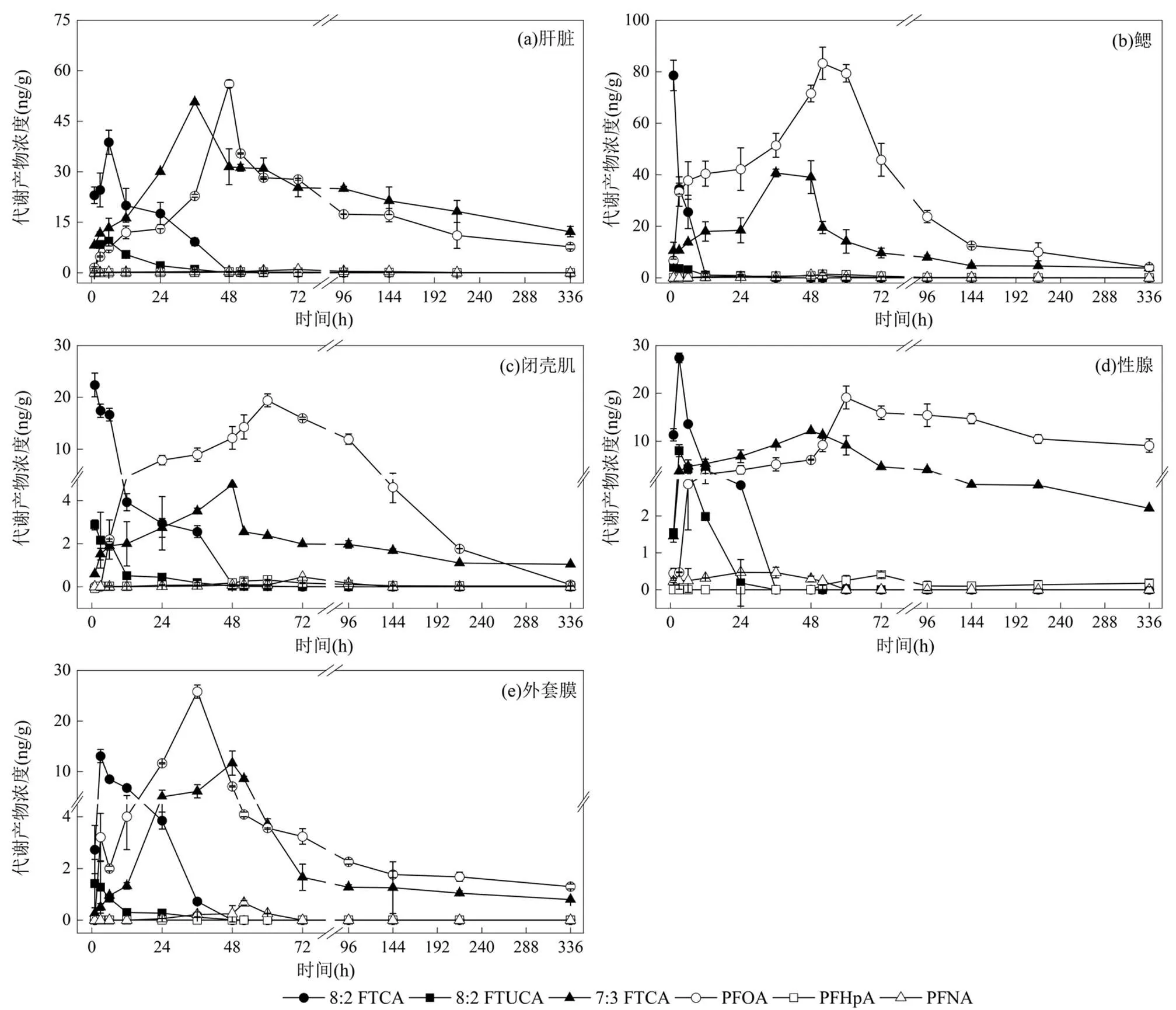
图1 5μg/L 8:2FTCA 暴露下栉孔扇贝各组织中代谢产物的浓度
8:2FTCA在栉孔扇贝体内的代谢过程中,除检测到母体化合物8:2FTCA外,还检测到8:2FTUCA, 7:3FTCA,PFOA,PFNA和PFHpA 5种代谢产物.研究表明,8:2FTCA可通过氧化反应生成8:2FTUCA,随后被还原成7:3FTCA,最后转化生成PFOA、PFNA、PFHpA和PFHxA等最终代谢产物[35-37].由图1可知,暴露初期,8:2FTCA在栉孔扇贝的5种组织(肝脏,鳃,闭壳肌,性腺和外套膜)中迅速蓄积并均于6h内达到峰值,高、低剂量组呈现相似的变化趋势.以高剂量组为例,8:2FTCA在各组织中的峰值浓度排序为:鳃>肝脏>性腺>闭壳肌>外套膜.栉孔扇贝鳃中8:2FTCA浓度于1h内达到峰值,浓度为(78.6±5.9) ng/g;肝脏的峰值浓度为(38.8±3.6) ng/g,到达峰值时间为6h;性腺、闭壳肌和外套膜则分别在3,1,3h达到峰值,峰值浓度分别为(27.4±2.9),(22.4±2.3)和(13.1±1.3)ng/g.
在8:2FTCA达到峰值后,中间代谢产物8:2FTUCA和7:3FTCA也达到峰值.高剂量组中, 8:2FTUCA在各组织中的峰值浓度排序为:肝脏>性腺>鳃>闭壳肌>外套膜.将各组织中不同代谢产物在同一时间点的含量进行对比,肝脏中8:2FTUCA在6h达到峰值,浓度为(9.4±0.9)ng/g,为母体化合物8:2FTCA的24.2%;性腺则在3h达到峰值,浓度为(8.0±0.3) ng/g,为8:2FTCA的29.2%;鳃,闭壳肌和外套膜均在1h达到峰值,浓度分别为(4.1±1.1),(2.9±0.2)和(1.4±0.9)ng/g,为8:2FTCA的5.2%,12.8%和10.8%. 5种组织中,7:3FTCA浓度均高于8:2FTUCA,为浓度最大的中间代谢产物.7:3FTCA在各组织的峰值浓度排序分别为:肝脏>鳃>性腺>外套膜>闭壳肌,浓度分别为(50.7±0.1),(40.7±1.5),(12.2±0.1),(11.7±2.4), (4.1±0.04)ng/g,分别是8:2FTUCA的5.4,10.0,1.5,8.2和1.7倍.

图2 8:2FTCA 及其代谢产物在栉孔扇贝肝脏组织中的浓度
作为主要最终代谢产物的PFOA,在肝脏中达到峰值时间为48h,浓度为(56.1±1.1) ng/g,为8:2FTCA峰值浓度的1.4倍;但8:2FTCA和8:2FTUCA浓度已下降至<1ng/g(高剂量组).而另一代谢产物PFNA的浓度很低,最高浓度仅为(0.9±0.009)ng/g,为8:2FTCA峰值浓度的2.4%,且于72h后检测不到.鳃中的PFOA在52h达到峰值浓度(83.3±6.3)ng/g,为8:2FTCA峰值浓度的1.1倍,高于肝脏中的浓度.PFNA在鳃中的峰值浓度为(1.1±0.3)ng/g,与肝脏峰值浓度相当,但是整体浓度很低.在其他3种组织中,都有PFOA的生成,浓度顺序依次为性腺>闭壳肌>外套膜.8:2FTCA在栉孔扇贝组织暴露实验中同样检测到PFHpA[38],并对其进行了定量.结果显示,鳃中PFHpA浓度最高,52h时达到峰值,浓度为(1.4±0.6)ng/g,为8:2FTCA峰值浓度的1.7%.其他3种组织中PFHpA的峰值浓度顺序为:性腺>闭壳肌>肝脏,外套膜中未检测到PFHpA.

表1 5μg/L 8:2FTCA暴露下栉孔扇贝肝脏、鳃和性腺组织中代谢产物的动力学参数

在栉孔扇贝5种组织中,肝脏和鳃是8:2FTCA的主要代谢靶器官.以肝脏为例,低剂量组和高剂量组中母体化合物及其代谢产物浓度变化见图2.8:2FTCA在肝脏中迅速累积,高剂量组和低剂量组分别在6,12h达到峰值,随后被迅速转化(图2(a)).生物转化发生在8:2FTCA蓄积过程中,中间代谢产物8:2FTUCA(图2(b))和7:3FTCA(图2(c))出现类似8:2FTCA蓄积的变化规律.暴露初期,8:2FTUCA迅速累积并达到峰值,于52h之后已检测不到.另一中间代谢产物7:3FTCA在代谢产物中浓度最高,在低剂量组和高剂量组肝脏中达到峰值的时间均为36h,但因7:3FTCA很难进行下一步转化[39],实验结束时仍保持较高的浓度.随着8:2FTCA和中间代谢产物浓度的降低,最终代谢产物浓度开始升高.PFOA的浓度在48~72h达到最高值,峰值浓度分别是8:2FTCA峰值浓度的2.9(低剂量组)和1.4倍(高剂量组).类似地,PFNA和PFHpA在肝脏中的峰值浓度均小于1ng/g,仅仅是母体化合物8:2FTCA峰值浓度的2.5%和0.8%(高剂量组).
2.2 8:2FTCA及其代谢产物的动力学分析
在8:2FTCA暴露实验中,浓度-时间曲线面积(AUC)代表母体化合物及其代谢物的整体浓度状态.以代谢产物浓度较高的组织(肝脏、鳃和性腺)为例,高剂量组中8:2FTCA的半衰期分别为11.5h(肝脏),1.9h(鳃)和1.7~9.9h(性腺).根据半衰期和消除速率常数可判断出同一扇贝不同组织中8:2FTCA的降解速率有所不同,且代谢产物7:3FTCA和PFOA也呈现相似的规律.母体化合物8:2FTCA在60h后已经检测不到,AUCobs(1~336h)与AUC∞大小相同.高剂量组中代谢中间产物8:2FTUCA的半衰期分别为1.2~8.7h(肝脏),7.9h(鳃),0.1~5.1h(性腺).肝脏和性腺中8:2FTUCA代谢速率随时间增加而减缓,但半衰期增加.鳃中8:2FTUCA的代谢速率几乎不随时间变化.在3种组织中7:3FTCA的AUCobs大小顺序分别为AUCobs(肝脏)>AUCobs(鳃)>AUCobs(性腺),且7:3FTCA在代谢产物中的AUCobs均为最高,说明在肝脏和鳃组织中7:3FTCA是8:2FTCA的主要代谢产物.PFOA的AUCobs大小分别为AUCobs(鳃)> AUCobs(肝脏)>AUCobs(性腺),鳃中PFOA的AUC∞是AUCobs的1.3倍,肝脏和性腺两种组织分别是1.1和1.4倍,由此表明,三种组织中的PFOA在实验结束时仍停留在较高水平,原因是PFOA作为最终代谢产物很难进一步转化[15].8:2FTCA暴露剂量由1 μg/L提高到5 μg/L,肝脏中PFOA的AUCobs从1762 (ng·h)/mL增加到5212 (ng·h)/mL.PFNA的AUCobs与PFHpA在同一数量级,半衰期也相似.其他组织中代谢物的动力学参数见表1.
从母体化合物8:2FTCA含量来看,其AUC∞大小顺序为肝脏>鳃>性腺,说明肝脏是8:2FTCA进行蓄积的主要场所.从代谢产物总含量来看,各组织中代谢产物总AUC∞大小顺序为肝脏>鳃>性腺,说明肝脏也是生成代谢产物的主要场所.但肝脏和鳃中代谢产物的总含量相差不大,且最终代谢产物PFOA在鳃中的AUC∞是肝脏中的1.6倍,说明肝脏和鳃是8:2FTCA在栉孔扇贝体内的主要代谢靶器官[10,38].
2.3 栉孔扇贝与虾夷扇贝对8:2FTCA代谢转化行为的对比
将本研究获得的栉孔扇贝对8:2FTCA的代谢转化行为与本课题组前期虾夷扇贝[38]的相关研究结果进行对比,虽未在栉孔扇贝体内找到8:2FTCA的其他代谢途径,但8:2FTCA在两种扇贝体内的代谢转化能力及组织分布有所差异.同一浓度8:2FTCA暴露下,栉孔扇贝和虾夷扇贝均检测到5种代谢产物,虾夷扇贝到达峰值浓度的时间较快、峰值浓度较高,且母体化合物及其代谢产物在各组织间的分布也有所差别,这说明同一物种间也可导致8:2FTCA的代谢产物含量发生变化.以主要代谢靶器官为例(下同),栉孔扇贝肝脏组织中各代谢物峰值浓度依次为7:3FTCA>PFOA>8:2FTCA>8:2 FTUCA>PFNA,这一点与虾夷扇贝相同;而在栉孔扇贝4种组织(肝脏、鳃、闭壳肌和性腺)中发现有少量PFHpA生成,虾夷扇贝仅在性腺组织中检测到PFHpA.虾夷扇贝靶器官中PFOA的AUC∞比7:3FTCA高3.9倍;栉孔扇贝中则是7:3FTCA比PFOA高1.1倍,说明栉孔扇贝代谢产物中7:3FTCA所占比例更高,虾夷扇贝中则是PFOA占比更高;但两种扇贝中含量最丰富的2种代谢产物均为PFOA和7:3FTCA.栉孔扇贝肝脏中PFOA的半衰期(1.9~59h)小于虾夷扇贝肝脏中PFOA的半衰期(5.6~92.4h),但两种扇贝的鳃组织中PFOA半衰期均较长(6.6~448h),需较长时间才能清除.两种扇贝中PFOA整体浓度状态均表现为AUC∞ (鳃)>AUC∞ (肝脏)>AUC∞ (性腺),说明鳃仍然是栉孔扇贝中PFOA生成和蓄积的重要组织.
已有的生物体内氟调聚物类前驱物的相关代谢实验表明,8:2FTCA在虹鳟[15,40]体内的代谢终产物为PFOA,7:3FTCA的代谢终产物为PFHpA.微生物[41-42]、大鼠[43-44]、虾夷扇贝[38]的相关实验以及本实验均证实该路径.7:3FTCA在虹鳟的暴露实验中,PFHpA产量仅约为母体化合物的0.1~0.2%[15],与本实验结果相似.Nabb等[14]研究14C-8:2FTOH在大鼠、小鼠、虹鳟和人类肝细胞的体外代谢实验,发现不同物种间8:2FTOH的代谢速率不同,速率由快到慢依次是大鼠>小鼠>人类≥虹鳟.Fasano等[43]在对不同性别小鼠的口服暴露实验中发现,雌鼠中的8:2FTOH及中间代谢产物(8:2FTCA,8:2FTUCA, 7:3FTCA和7:3FTUCA)浓度更高,而雄鼠中最终代谢产物(PFNA,PFOA和PFHpA)的浓度更高.因此,不同物种间及同一物种的不同性别等因素都有可能导致前驱物代谢产物的变化,这些变化可能由个体间的生物转化能力(如酶)的差异所导致.2.4 栉孔扇贝对8:2FTCA的氧化应激响应为探究8:2FTCA暴露下栉孔扇贝主要代谢靶器官的响应,对肝脏和鳃组织中GSH和MDA含量以及GSH-Px,SOD和CAT酶活性进行分析.由图3(a)和(b)可知,暴露初期(6h),肝脏中GSH含量上升.随着暴露时间的延长,高剂量组呈“降低-升高”趋势,且GSH含量在114h显著增加;低剂量组出现类似规律,且于实验结束(336h)时显著增加.低剂量组鳃组织中GSH含量在低剂量组整体呈现“降低-升高”趋势,高剂量组大部分时间GSH含量在降低,且于12h时显著降低.由图3(c)和(d)可知,低剂量组肝脏中MDA含量整体呈“先升高后降低”趋势,高剂量组MDA含量则大部分时间处于升高趋势.鳃组织中,低剂量组中MDA整体处于升高趋势,但在24h时显著降低;高剂量组大部分时间也处于升高趋势,且于12,244h时显著增加.
栉孔扇贝中GSH-Px,SOD和CAT活性的变化情况:肝脏中活性最高的酶是GSH-Px,其酶活是(125±2.7) U/mg 蛋白质,分别可达到SOD和CAT酶活的2和1.6倍左右.鳃中活性最高的酶是SOD,其酶活是(147±7.2) U/mg 蛋白质,分别可达到GSH-Px和CAT酶活的4和24倍左右.由图3可知,暴露组中3种酶均表现出一定程度的应激响应,且鳃中SOD和CAT均呈诱导效应,GSH-Px则呈抑制效应;低剂量组肝脏中SOD,GSH-Px和CAT均呈抑制效应,高剂量组中则分别呈诱导-抑制-诱导,抑制,抑制-诱导效应.其中,SOD和GSH-Px对8:2FTCA胁迫敏感,呈现显著性诱导或抑制效应.
由图3(e)可知,6h时高剂量组肝脏中SOD活性被快速激活,且大部分时间呈诱导状态;低剂量组则处于抑制效应.由图3(f)可知,两剂量组鳃中SOD大部分时间呈诱导效应.由图3(g)和(h)可知, GSH- Px在肝脏和鳃组织中整体上呈抑制效应.鳃中GSH-Px在8:2FTCA的作用下,响应特征较为敏感,低剂量组仅在6h时被诱导其余时间段均处于抑制状态,高剂量组则一直呈抑制效应.由图3(i)和(j)可知,低剂量组肝脏中CAT活性基本处于抑制效应,高剂量组呈先抑制后诱导效应;而低剂量组和高剂量组鳃中CAT活性整体处于被诱导状态.虽然8:2FTCA暴露实验中对肝脏、鳃中的CAT活性总体呈增加的趋势,但是由于机体自身抗氧化防御系统的能够抵制这种刺激作用,这种酶活性增加并不显著,这可能与8:2FTCA暴露浓度较低以及机体自身抑制有关.但是CAT活性在肝脏与鳃中呈显著性差异,呈现组织差异性.
受到异源物质胁迫时,生物体为维持机体动态平衡,SOD,CAT和GSH-Px等清除氧自由基或活性氧簇(ROS)的抗氧化酶会被诱导;过氧化脂质(LPO)作为氧化应激的主要特征和最终表现,在氧化应激引起的细胞功能损伤方面发挥着重要作用;MDA作为LPO的产物也可作为机体氧化应激的指标[45-47].罗非鱼[30]的PFOA暴露实验表明,当暴露浓度从1mg/L增加到30mg/L时,PFOA可引起MDA的含量显著性升高.本实验中,在栉孔扇贝受到8:2FTCA暴露6~72h后,肝脏内的MDA含量与对照组形成显著性差异,但在鳃中MDA含量与对照组无显著性差异,推测与PFOA的产量较低有关.暴露336h时肝脏组织中MDA含量显著降低,说明肝脏内部抗氧化系统对MDA进行了有效的清除[48];而鳃中仅低剂量组处于下降趋势,高剂量组中MDA含量仍未升高状态,说明高剂量组鳃受到较重的氧化损伤.
PFOA可引起细胞内ROS的增加,但在30mg/L的PFOA暴露条件下,并没有引起罗非鱼体内SOD活力增加,是因为生成的过量的过氧化物自由基转化成H2O2后,使得酶中的半胱氨酸发生氧化,使SOD活性下降[30].当8:2FTCA暴露48h时,鳃和肝脏中SOD活力与对照组相比显著下降,推测与PFOA的生成及其他PFCAs的增加有关:在低浓度刺激时,抗氧化酶活性会迅速提升,随着暴露时间延长,代谢产物浓度升高,抗氧化酶活性会逐渐降低并受到抑制.

图3 8:2FTCA对栉孔扇贝组织中氧化指标的影响
(a),(b)分别为GSH在肝脏和鳃中的含量变化;(c),(d)分别为MDA在肝脏和鳃中的含量变化;(e),(f)分别为SOD在肝脏和鳃中的活性变化,(g),(h)分别为GSH-Px在肝脏和鳃中的活性变化;(i),(j)分别为CAT在肝脏和鳃中的活性变化;* 表示剂量组与对照组相比具有显著性差异(<0.05)
机体受到低水平刺激时,GSH作为非酶体系中的抗氧化分子可直接与自由基反应,含量会有所上升;当氧化应激反应加剧后,GSH-Px发生作用,使ROS被还原,GSH-Px催化过氧化氢的过程被认为是机体应对LPO十分有效的酶保护机制[49].实验初期,肝脏中GSH-Px迅速被激活,参与氧化应激响应,但随着代谢产物的生成,GSH-Px呈抑制效应,推测是PFOA等代谢产物累积到一定水平时,不断产生的LPO可能超出抗氧化酶的补偿性增加,破坏抗氧化酶活性.在PFOA和Cu的混合暴露研究中发现,暴露24h后的鲫鱼肝脏中GSH-Px出现显著下降[50],同样表明PFOA的存在可能会抑制GSH-Px的活性.CAT通常与GSH-Px发生协同作用,将H2O2还原为H2O,同时保护细胞膜中不饱和脂肪酸不被氧化[49],本研究结果显示栉孔扇贝中CAT在一定程度上被激活诱导,随着时间延长,活性增大且呈诱导效应,表明实验结束时CAT活性升高不足以清除增加的自由基,机体仍需要时间对活性氧进行清除.
氧化应激响应结果表明,当PFOA等PFCAs代谢产物含量开始下降时,各抗氧化应激指标均有不同程度恢复,这表明当栉孔扇贝内代谢产物水平降低时,机体的应激响应开始解除,不同的酶由于性质不同所需要的恢复时间不同.
3 结论
3.1 8:2FTCA在栉孔扇贝的生物转化过程中检测并定量了5种代谢产物(8:2FTUCA,7:3FTCA, PFOA, PFNA,PFHpA.),且代谢产物总含量在各组织中的大小顺序为肝脏>鳃>性腺>闭壳肌和外套膜,其中鳃和肝脏组织是8:2FTCA主要代谢靶器官.
3.2 8:2FTCA在栉孔扇贝与虾夷扇贝体内生物转化的相同之处在于生成的代谢产物种类,主要代谢靶器官以及鳃是PFOA的生成和蓄积的主要场所;不同之处主要体现在栉孔扇贝中代谢产物以7: 3FTCA占比较高,虾夷扇贝中则是PFOA占比较高.
3.3 整个暴露实验中,5种抗氧化应激标志物均呈现出不同程度的氧化应激响应,且表现出剂量-效应关系.当代谢产物含量降低后,机体中各氧化应激标志物均有不同程度恢复.
[1] Krafft M P, Riess J G.Per- and polyfluorinated substances (PFASs): Environmental challenges [J]. Current Opinion in Colloid & Interface Science, 2015,20(3):192-212.
[2] Buck R C, Franklin J, Berge U, et al. Perfluoroalkyl and polyfluoroalkyl substances in the environment: Terminology, classification, and origins [J]. Integrated Environmental Assessment and Management, 2011,7(4):513-541.
[3] Prevedouros K, Cousins I T, Buck R C, et al. Sources, Fate and transport of perfluorocarboxylates [J]. ChemInform, 2006,40(1): 32-44.
[4] Coggan T L, Anumol T, Pyke J, et al. A single analytical method for the determination of 53legacy and emerging per- and polyfluoroalkyl substances (PFAS) in aqueous matrices [J]. Analytical and Bioanalytical Chemistry, 2019,411(16):3507-20.
[5] Lang J R, Allred B M, Fieid J A, et al. National estimate of per- and polyfluoroalkyl substance (PFAS) release to U.S.municipal landfill leachate [J]. Environmental Science Technology, 2017,51(4):2197- 205.
[6] 崔文杰,彭吉星,谭志军,等.全氟烷基物质在胶州湾海水、沉积物及生物中污染特征 [J]. 环境科学, 2019,40(9):3990-3999.
Cui W J, Peng J X, Tan Z J, et al. Pollution characteristics of perfluorinated alkyl substances (PFASs) in seawater, sediments, and biological samples from Jiaozhou Bay, China [J]. Environment Science, 2019,40(9):3990-3999.
[7] 李琦路,程相会,赵 祯,等.黄河中游(渭南-郑州段)全/多氟烷基化合物的分布及通量 [J]. 环境科学, 2019,40(1)228-38.
Li Q L, Cheng X H, Zhao Z, et al. Distribution and fluxes of perfluoroalkyl and polyfluoroalkyl substances in the middle reaches of the Yellow River (Weinan-Zhengzhou Section) [J]. Environment Science, 2019,40(1)228-38.
[8] Andersen M E, Butenhoff J L, Chang S C, et al. Perfluoroalkyl acids and related chemistries--toxicokinetics and modes of action [J]. Toxicological Sciences, 2008,102(1):3-14.
[9] Butt C M, Muir D C G, Mabury S A. Biotransformation pathways of fluorotelomer-based polyfluoroalkyl substances:A review [J]. Environmental Toxicology and Chemistry, 2014,33(2):243-267.
[10] Zabaleta I, Bizkarguenaga E, Izagirre U, et al. Biotransformation of 8:2 polyfluoroalkyl phosphate diester in gilthead bream () [J]. Science of the Total Environment, 2017,609:1085-92.
[11] Chen M, Wang Q, Zhu Y, et al. Species dependent accumulation and transformation of 8:2 polyfluoroalkyl phosphate esters in sediment by three benthic organisms [J]. Environment International, 2019,133(Pt A):105171.
[12] Gebbink W A, Glynn A, Darnerud P O, et al. Perfluoroalkyl acids and their precursors in Swedish food: The relative importance of direct and indirect dietary exposure [J]. Environmental Pollution, 2015,198: 108-115.
[13] Fasano W J, Carpenter S C, Gannon S A, et al. Absorption, distribution, metabolism, and elimination of 8-2 fluorotelomer alcohol in the rat [J]. Toxicological Sciences, 2006,91(2):341-355.
[14] Nabb D L, Szostek B, Himmelstein M W, et al. In vitro metabolism of 8-2 fluorotelomer alcohol: interspecies comparisons and metabolic pathway refinement [J]. Narnia, 2007,100(2):333-344.
[15] Butt C M, Muir D C G, Mabury S A. Elucidating the pathways of poly- and perfluorinated acid formation in rainbow trout [J]. Environmental Science & Technology, 2010,44(13):4973-4980.
[16] Aand A, Pooney R J, Butt C M, et al. Cellular toxicity associated with exposure to perfluorinated carboxylates (PFCAs) and their metabolic precursors [J]. Chemical Research in Toxicology, 2014,27(1):42-50.
[17] 王 玉.全氟辛烷磺酸(PFOS)和全氟辛酸(PFOA)对BALB/c小鼠免疫系统毒性效应研究 [D]. 武汉:华中农业大学, 2011.
Wang Y. Immunotoxic effect of perfluorooctane sulfonate and perfluorooctanoic acid in BALB/c mice [D]. Wuhan: Huazhong Agricultural University, 2011.
[18] Biegel L B, Hurtt M E, Frame S R, et al. Mechanisms of extrahepatic tumor induction by peroxisome proliferators in male CD rats [J]. Toxicological Sciences, 2001,60(1):44-55.
[19] Magali H, Amila D S, Derek C G M, et al. Monitoring of perfluorinated cCompounds in aquatic biota:An updated review [J]. Environmental Science & Technology, 2011,45(19):7962-7973.
[20] Smithwick M, J N R, A M S, et al. Temporal trends of perfluoroalkyl contaminants in polar bears (Ursus maritimus) from two locations in the North American Arctic, 1972-2002 [J]. Environmental Science & Technology, 2006,40(4):1139-1143.
[21] Mahiba S, Tom H, Chi L S, et al. Sorbent-impregnated polyurethane foam disk for passive air sampling of volatile fluorinated chemicals [J]. Analytical Chemistry, 2008,80(3):675-682.
[22] Mahiba S, TOM H, Chi L S et al. Indoor sources of poly- and perfluorinated compounds (PFCS) in Vancouver, Canada:implications for human exposure [J]. Environmental Science & Technology, 2011, 45(19):675-682.
[23] 夏 慧,敖俊杰,袁 涛.室内灰尘中全氟化合物的污染状况与人体暴露水平评估 [J]. 生态毒理学报, 2016,11(2):223-230.
Xia H, Ao J J, Yuan T. Occurrences, characteristics and human exposure assessment of perfluorinated compounds in indoor dust [J]. Asian Journal of Ecotoxicology, 2016,11(2):223-230.
[24] Fraser A J, Webster T F, Watkins D J, et al. Polyfluorinated compounds in dust from homes, offices, and vehicles as predictors of concentrations in office workers' serum [J]. Environment International, 2013,60:128-136.
[25] Smithwick M, Muir D C G, Mabury S A, et al. Perflouroalkyl contaminants in liver tissue from East Greenland polar bears (Ursus maritimus) [J]. Environmental Toxicology and Chemistry, 2005,24(4): 981-986.
[26] Cui W J, Tan Z J, Chen J Q, et al. Uptake, tissue distribution, and elimination of 8:2 polyfluoroalkyl phosphate diesters in Mytilus galloprovincialis [J]. Environmental Toxicol Chemistry, 2021,40(7): 1992-2004.
[27] Martin J W, Mabury S A, O’brien P J. Metabolic products and pathways of fluorotelomer alcohols in isolated rat hepatocytes [J]. Chemico-Biological Interactions, 2005,155(3):165-180.
[28] Ankley G T, Kuehi D W, Kahl M D, et al. Reproductive and developmental toxicity and bioconcentration of perfluorooctanesul fonate in a partial life-cycle test with the fathead minnow (Pimephales promelas) [J]. Environmental Toxicology and Chemistry, 2005,24(9): 2316-2324.
[29] Oakes K D, Sibley P K, Martin J W, et al. Short-term exposures of fish to perfluorooctane sulfonate: Acute effects on fatty acyl-CoA oxidase activity, oxidative stress, and circulating sex steroids [J]. Environmental Toxicology and Chemistry, 2005,24(5):1172-1181.
[30] Liu C, Yu K, Shi X, et al. Induction of oxidative stress and apoptosis by PFOS and PFOA in primary cultured hepatocytes of freshwater tilapia (Oreochromis niloticus) [J]. Aquatic Toxicology, 2007,82(2): 135-143.
[31] Phillips M M M, Dinglasan-Panlilio M J A, Mabury S A, et al. Fluorotelomer acids are more toxic than perfluorinated acids [J]. Environmental Science & Technology, 2007,41(20):7159-7163.
[32] Liu W, Chen S, Quan X, et al. Toxic effect of serial perfluorosulfonic and perfluorocarboxylic acids on the membrane system of a freshwater alga measured by flow cytometry [J]. Environmental Toxicology and Chemistry, 2008,27(7):1597-1604.
[33] Li M H. Toxicity of perfluorooctane sulfonate and perfluorooctanoic acid to plants and aquatic invertebrates [J]. Environmental Toxicology, 2009,24(1):95-101.
[34] 国 佼,郭萌萌,吴海燕,等.双固相萃取柱净化-超快速液相色谱-串联质谱法同时测定贝类组织中全氟羧酸及其前体物质 [J]. 食品科学, 2017,38(20):248-255.
Guo J, Guo M M, Wu H Y, et al. Simultaneous determination of perfluorinated acids and their precursors in bivalve shellfish by double SPE columns purification and ultra fast liquid chromatography- tandem mass spectrometry [J]. Food Science, 2017,38(20):248-255.
[35] Rand A A, Mabury S A. Protein binding associated with exposure to fluorotelomer alcohols (FTOHs) and polyfluoroalkyl phosphate esters (PAPs) in rats [J]. Environmental Science & Technology, 2014, 48(4):2421-2429.
[36] Beškoski V P, Yamamoto A, Nakano T, et al. Defluorination of perfluoroalkyl acids is followed by production of monofluorinated fatty acids [J]. Science of the Total Environment, 2018,636:355-359.
[37] 郭萌萌,谭志军,吴海燕,等.全氟羧酸及其前体物质的环境分布、毒性和生物转化研究进展 [J]. 中国渔业质量与标准, 2018,8(4): 25-37.
Guo M M, Tan Z J, Wu H Y, et al. Perfluorocarboxylic acids and their precursors:environmental distribution, toxicity and biotransformation [J]. Chinese Fishery Quality and Standards, 2018,(4):25-37.
[38] 郭萌萌,国 佼,李风铃,等.8:2氟调聚羧酸在虾夷扇贝体内的蓄积、分布与转化 [J]. 中国环境科学, 2020,40(10):4607-16.
Guo M M, Guo J, Li F L, et al. Uptake, distribution and biotransformation of 8:2 fluorotelomer carboxylic acid (8:2 FTCA) in scallops (Patinopecten yessoensis) [J]. China Environmental Science, 2020,40(10):4607-16.
[39] Eriksson U, Roos A, Lind Y, et al. Comparison of PFASs contamination in the freshwater and terrestrial environments by analysis of eggs from osprey (), tawny owl (), and common kestrel () [J]. Environmental Research, 2016,149:40-47.
[40] Butt C M, Muir D C G, Mabury S A. Biotransformation of the 8:2fluorotelomer acrylate in rainbow trout.1.In vivo dietary exposure [J]. Environmental Toxicology and Chemistry, 2010,29(12):2726- 2735.
[41] Liu J X, Lee L S, Nies L F, et al. Biotransformation of 8:2fluorotelomer alcohol in soil and by soil bacteria isolates [J]. Environmental Science & Technology, 2007,41(23):8024-8030.
[42] Myers A L, Mabury S A. Fate of fluorotelomer acids in a soil–water microcosm [J]. Environmental Toxicology and Chemistry, 2010,29(8): 1689-1695.
[43] Fasano W J, Sweeney L M, Mawn M P, et al. Kinetics of 8-2fluorotelomer alcohol and its metabolites, and liver glutathione status following daily oral dosing for 45days in male and female rats [J]. Chemico-Biological Interactions, 2009,180(2):281-295.
[44] Himmelstein M W, Serex T L, Buck R C, et al. 8:2 fluorotelomer alcohol:A one-day nose-only inhalation toxicokinetic study in the Sprague-Dawley rat with application to risk assessment [J]. Toxicology, 2012,291(1-3):122.132.
[45] 秦鹏飞.两类含氟污染物转运过程中毒性作用机理的研究 [D]. 济南:山东大学, 2013.
Qin P F. Research on the toxicity mechanism of two types of fluorine containing pollutants during their transport process [D]. Ji'nan: Shandong University, 2013.
[46] Kim W K, Lee S K, Jung J. Integrated assessment of biomarker responses in common carp (Cyprinus carpio) exposed to perfluorinated organic compounds [J]. Journal of Hazardous Materials, 2010,180(1): 395-400.
[47] Lushchak V I. Environmentally induced oxidative stress in aquatic animals [J]. Aquatic Toxicology, 2011,101(1):13-30.
[48] 王贺威,马胜伟,张 喆,等.全氟辛烷磺酸对真鲷鳃抗氧化酶和组织损伤的影响[J]. 生态与农村环境学报, 2013,29(1):98-105.
Wang H W, Ma S W, Zhang Z. Effects of perfluorooctanesulfonate (PFOS) on antioxidant enzyme in the gill of Pagrosomus major and damage to its tissues [J]. Journal of Ecology and Rural Environment, 2013,29(1):98-105.
[49] Livngstone D R. Contaminant-stimulated reactive oxygen species production and oxidative damage in aquatic organisms [J]. Marine Pollution Bulletin, 2001,42(8):656-666.
[50] Feng M, He Q, Meng L, et al. Evaluation of single and joint toxicity of perfluorooctane sulfonate, perfluorooctanoic acid, and copper to Carassius auratus using oxidative stress biomarkers [J]. Aquatic Toxicology, 2015,161:108-116.
Metabolic transformation and physiological response ofto 8:2 fluorotelomer carboxylic acid (8:2FTCA).
LIU Xiao-yu1,2, GUO Jiao3, WANG Zhi4, TAN Zhi-jun2, ZHAI Yu-xiu2, GUO Meng-meng2*
(1.College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;2.Key Laboratory of Testing and Evaluation for Aquatic Product Safety and Quality, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;3.Burning Rock Biotech, Guangzhou 510300, China;4.Qingdao Institute of Product Quality Inspection and Technical Research, Qingdao Product Quality Supervision and Testing Resarch Institute, Qingdao 266101, China)., 2021,41(10):4904~4915
The metabolic transformation characteristics and oxidative stress response ofto 8:2 fluorotelomeric acid (8:2 FTCA) were studied. Five metabolites of 8:2 FTCA were identified in, inclubng 8:2 fluorotelomer unsaturated carboxylic acid (8:2 FTUCA), 7:3 fluorotelomer carboxylic acid (7:3 FTCA), perfluorooctanoic acid (PFOA), perfluorononanoic acid (PFNA) and perfluoroheptanoic acid (PFHpA). Gill and liver were the main metabolic target organs which the total concentration of metabolites were the highest. The biotransformation characteristics of 8:2 FTCA inwas similar with that in, such as the detected metabolites, the metabolic target organs, and the main tissue for the accumulation and metabolism of PFOA (gill). The difference was the main metabolite ofis 7:3 FTCA whileis PFOA. The key antioxidant enzymes in gill and liver were activated significantly. Oxidative stress indicators such as malondialdehyde (MDA) and glutathione (GSH), antioxidant enzymes such as glutathione peroxidase (GSH-Px),superoxide dismutase (SOD) and catalase (CAT) changed in different degrees: GSH-Px was inhibited continuously during the entire experiment, SOD and CAT activities were induced in gill, and showed obvious dose-effect relationships in the liver: inhibited in the low-dose treated groups, and induced in high-dose treated groups. The content of GSH and MDA showed a dose-response relationship as well as tissue variability. In addition, physiological indicators recovered in various degrees at the end of the exposure experiment.
fluorotelomer carboxylic acids (FTCAs);perfluocarboxylic acids (PFCAs);biotransformation;antioxidant enzymes;
X171.5
A
1000-6923(2021)10-4904-12
刘晓玉(1996-),女,山东潍坊人,上海海洋大学硕士研究生,主要研究方向为有机污染物危害形成机制研究.
2021-03-17
国家自然科学基金资助项目(41906130);国家市场监督管理总局技术保障项目(2020YJ027);中国水产科学研究院基本科研业务费项目(2020TD71)
* 责任作者, 高级工程师, guomm@ysfri.ac.cn

