三叶青总黄酮对大鼠H9C2细胞缺氧/复氧损伤的保护作用
郭永梅,张传林,王 芳
(1.江西医学高等专科学校 药学系,江西 上饶 334000,2.江西医学高等专科学校第一附属医院,江西 上饶 334000)
心肌缺氧复氧 (Hypoxia/reoxygenation,H/R)损伤是缺血性心肌病及心脏手术后出现心衰的一种常见损伤,是世界性难题[1]。21世纪以来,越来越多研究表明,黄酮类化合物有很好的心血管保护作用,可以适当减少心肌H/R损伤及一些炎症因子反应[2]。三叶青是我国特有的药用植物,为葡萄科崖爬藤属植物三叶崖爬藤(TetrastigmahemsleyanumDiels et Gilg),具有清热解毒祛肿等功效[3]。在课题组前期的研究中发现黄酮类化合物存在于三叶青中,其对心血管疾病可能有一定治疗作用。迄今为止,关于三叶青总黄酮对心肌H/R损伤的保护作用少有报道。本研究拟通过建立H/R模型,进而探讨三叶青总黄酮对细胞H/R损伤的保护作用。
1 材料与仪器
1.1 细胞株
大鼠H9C2细胞(采购于中国科学院上海细胞库)。
1.2 药物与试剂
三叶青由上饶市红日农业开发有限公司提供(采自上饶怀玉山);高糖 DMEM培养基(碧云天生物公司);胎牛血清(四季青)。
1.3 主要仪器
SW-CJ-1F超净工作台(购于苏州安泰技术有限公司);二氧化碳细胞培养箱(购于美国赛默飞公司);荧光定量PCR仪(购于美国Applied Biosystems);IX71 倒置荧光显微镜(购于日本奥林巴斯);INSYTE5流式细胞仪(购于美国 MilliporeGAVUA);Mk3酶标仪(购于美国Wellscan)。
2 方法
2.1 三叶青总黄酮的制备
三叶青总黄酮的提取工艺参考文献方法[3]:三叶青干粉首先用60%的乙醇提取2次,提取时间为80 min和60 min各一次,用D101大孔树脂吸附提取液,洗脱的次序为20% 乙醇洗脱后收集40% 乙醇,洗脱的部分即是三叶青总黄酮,质量分数>80%。
2.2 细胞的培养
细胞用含 10% 胎牛血清的高糖 DMEM 培养液中于37 ℃,5% CO2下培养,当细胞融合度达80~90%时进行传代,每3天传代1次,取对数生长期细胞接种,以便进行后续实验。
2.3 三叶青总黄酮对大鼠H9C2 细胞的增殖抑制实验
将高糖DMEM(含10%胎牛血清)培养大鼠H9C2细胞,制成 5×104/mL的细胞悬液,按100μL/孔接种在 96 孔板,于 37 ℃培养箱(含 5% CO2)中孵育24 h,吸弃原培养液,分别用3、6、9、18、36、72μg·mL-1等浓度的三叶青总黄酮处理24 h。结束前4 h加1.9 mg /mL的MTT液20μL,再培养4 h,用酶标仪于490 nm波长检测光密度D(λ)值。实验须重复3次并取3个重复孔为均值,计算三叶青总黄酮作用24 h 后细胞的成活率,实验重复3次。细胞成活率=[1-D(λ)加药D(λ)对照]×100%
2.4 大鼠H9C2 细胞H/R模型的建立
将含10%胎牛血清的高糖DMEM培养H9C2心肌细胞,制成5×104/mL-1的细胞悬液,后按100μL/孔接种96孔板,并于37 ℃培养箱(含5% CO2)中孵育24h,等细胞融合度达到80%~90%时对细胞进行以下缺氧处理:用DMEM培养液配制氯化钴溶液,浓度在600~1 600μmol·L-1之间,分别于6 h、12 h、18 h、24 h确定氯化钴浓度及缺氧时间。估约最佳复氧时间,缺氧时间完成后,摒弃缺氧液,用高糖DMEM培养液(含10%胎牛血清)分别复氧1 h、2 h、3 h、6 h。
2.5 药物处理
实验为正常组(正常培养),H/R模型组(总浓度为1 200μmol·L-1的氯化钴经缺氧18 h后弃缺氧液,用高糖 DMEM培养液(含10%胎牛血清)继续培养2 h和三叶青总黄酮低(3μg/mL-1)、中(6μg/mL-1)、高(9μg/mL-1)浓度预处理组(药物预处理细胞24 h,其他步骤同H/R模型组)。
2.6 指标检测
2.6.1 检测生化指标 按各自检测试剂盒中的说明书,提取培养液上清及细胞内蛋白,分别检测SOD活性,MDA含量、LDH释放量。
2.6.2 检测细胞成活率 实验结束时加入1.9 mg/mL-1的 MTT液 20μL,后续过程同“2.3”项。
2.6.3 检测细胞凋亡率 细胞用不含EDTA的胰酶先消化收集,再用PBS洗涤2次(2 000 r/min离心5 min),并收集2×105个细胞,之后加入500μL Binding Buffer 悬浮细胞,再加入Annexin V-FITC(5μL)混匀后,最后加入Propidium Io-dide(5μL),混匀,于室温中避光反应10 min,用流式细胞仪检测早期凋亡和晚期凋亡细胞百分率。
2.6.4 检测 HIF-1α蛋白表达 提取细胞的总蛋白,并检测蛋白的含量。先各组取40μg的蛋白,经SDS-PAGE电泳后,转移到PVDF膜上,再用脱脂奶粉(50 g/L-1)封闭2 h,加入兔抗大鼠HIF-1α(一抗)4 ℃过夜,然后用TBST洗3遍,再加入辣根过氧化物酶标记的山羊抗兔(二抗),常温孵育2 h,再用TBST洗3遍。最后用ECL 试剂盒曝光显色,扫描并保存图像。
2.7 统计学处理
3 结果
3.1 不同浓度下三叶青总黄酮对大鼠H9C2细胞增殖的影响
结果如图1所示,当药物的浓度达9μg/mL-1时,大鼠H9C2细胞的成活率显著高于空白对照组,但是随着药物浓度的提高,大鼠细胞的成活率则逐渐降低,故而以三叶青总黄酮9μg/mL-1为最高浓度,依次设定低、中、高浓度分别为3、6、9μg/mL-1。
3.2 大鼠H9C2 细胞H/R模型的建立
结果如图2、图3所示,氯化钴的浓度越高,作用时间越长,细胞成活率则逐渐降低;而当复氧时间高于2 h后,细胞的活力则开始恢复,成活率开始升高。因此可以得出当氯化钴浓度为1 200μmol/L-1,缺氧时间为18 h,复氧时间为2 h是本实验细胞H/R损伤模型的最佳条件。
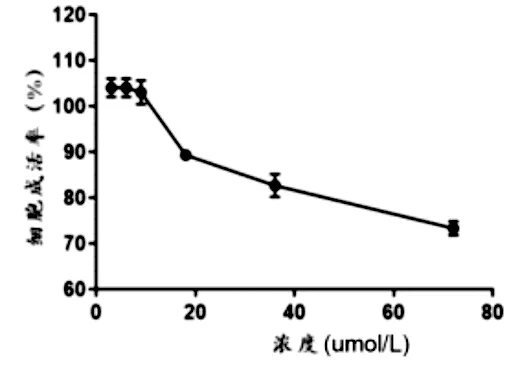
图1 不同浓度三叶青总叶黄酮对大鼠H9C2细胞增殖的影响

图2 氯化钴浓度及缺氧作用时间对大鼠H9C2 细胞成活率的影响
3.3 三叶青总黄酮对H/R损伤大鼠H9C2 心肌细胞成活率的影响
结果如图4所显示,与模型组相对比,三叶青总黄酮6、9μg/mL-1组细胞成活率显著升高(P<0.05)。

图3 不同复氧时间对大鼠H9C2细胞成活率的影响

注:与正常对照组比较,*P<0.05,与模型组比较,#P<0.05。
3.4 三叶青总黄酮对H/R损伤大鼠H9C2细胞上清液中LDH 及细胞内MDA、SOD水平的影响
结果如表1所显示,比较正常对照组,模型组的上清液中的LDH 及细胞内 MDA 水平明显提高,细胞内SOD活性明显下降(P<0.05)。相比于模型组,三叶青总黄酮中剂量组、高剂量组上清液中LDH活性明显下降,三叶青总黄酮各剂量组细胞内 MDA水平明显下降,SOD活性明显提高(P<0.05)。
3.5 三叶青总黄酮对H/R损伤大鼠H9C2细胞凋亡的影响
结果如图 5 所示,比较正常对照组,模型组的凋亡细胞明显增加,经过三叶青总黄酮预处理后,凋亡的细胞有所减少。
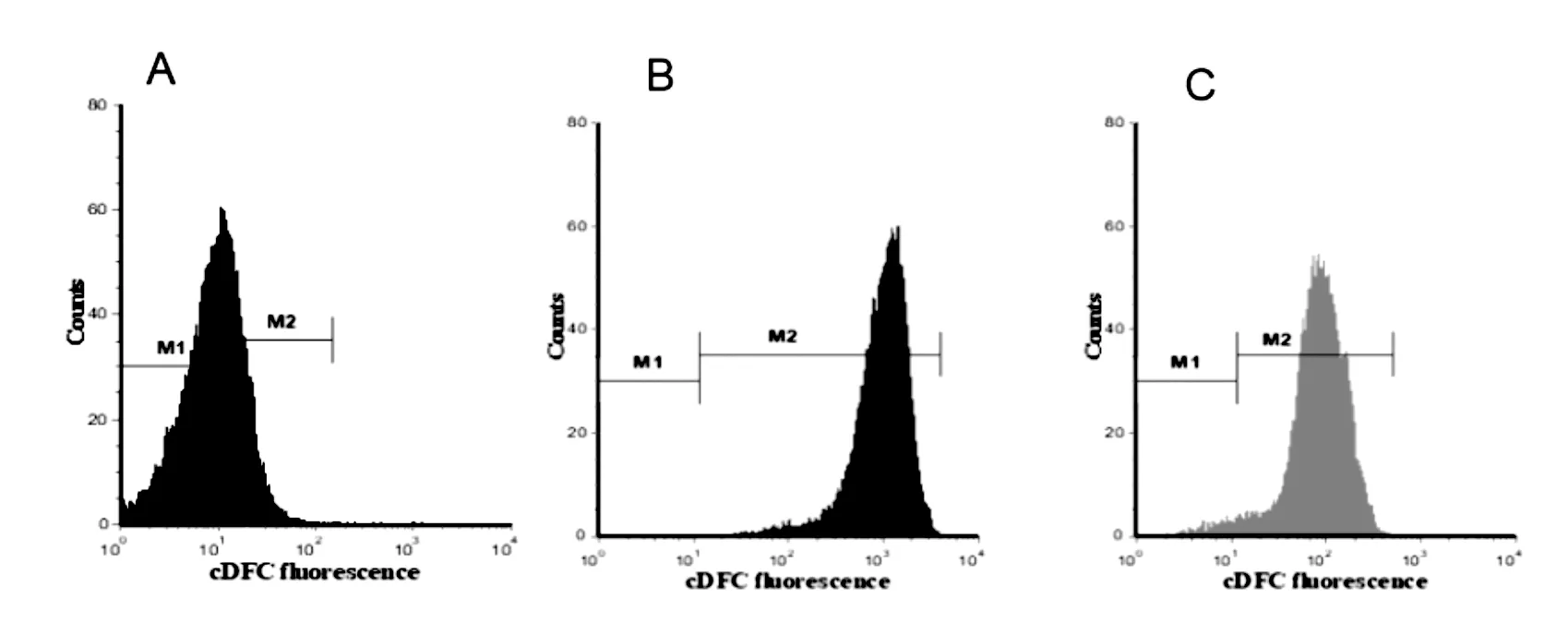
3.6 三叶青总黄酮对H/R损伤大鼠H9C2 心肌细胞HIF-1α 蛋白表达的影响
结果如图6所示,比较正常对照组,模型组的 HIF-1α 蛋白表达明显升高(P<0.01)。比较模型组,三叶青总黄酮中剂量组、高剂量组 HIF-1α 蛋白表达明显下降(P<0.05或P<0.01)。
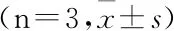
表1 三叶青总黄酮对H/R损伤H9C2细胞中 LDH 及细胞内 MDA、SOD 水平的影响
注:A.正常对照组 B.模型组 C.三叶青总黄酮 9μg/mL组。
注:与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
4 讨论
LDH是一种胞内酶,根据漏出的多少可直接反应细胞受损的情况。据本次的研究可以看出,与对照组相比,模型组细胞培养液中LDH含量升高明显,但经过三叶青总黄酮的预处理后,细胞培养液中的 LDH 含量明显下降。缺氧后的心肌细胞,能量代谢紊乱,细胞膜会收到受损。而复氧后,随着大量的氧气涌入,会产生了大量的自由基,并且会发生脂质过氧化等一系列反应。而氧自由基攻击生物膜不饱和脂肪的终产物是MDA,测定其含量就能间接反应细胞的受损情况如何。
SOD是一种抗氧化酶,能清除氧自由基[4]。本次实验结果显示,经三叶青总黄酮处理后,细胞内MDA含量下降,而SOD活性增加,由此可以看出,三叶青总黄酮能降低细胞H/R的损伤。细胞H/R损伤后的一个重要指标是凋亡。本实验流式细胞术检测结果显示三叶青总黄酮能有效抑制细胞凋亡。经相关研究表明心肌缺血的发生机制跟 HIF-1α有关[5]。一般在常氧环境下,HIF-1α被脯氨酸羟基化酶(PHD)羟基化后在细胞内降解。而在缺氧时,可抑制PHD的活性,HIF-1α被活化[6]。从本实验结果中可以看出,三叶青总黄酮可通过调节HIF-1α的表达来保护细胞H/R损伤。综上所述,三叶青总黄酮具有保护细胞H/R损伤作用,它的机制有可能与抗氧化及抗细胞凋亡有一定关联。

