调节TGF-β1/Smad信号通路对内质网应激状态下肝癌HepG2细胞凋亡的影响*
黄亚纬, 熊 莉, 窦德宇, 吕梦娟, 马玉红△
(1. 皖南医学院临床医学实验实训中心; 2. 皖南医学院中心实验室, 安徽 芜湖 241000)
肝细胞癌(hepatocellular carcinoma,HCC)是全球最常见的癌症类型之一,居全世界癌症相关死因的第三位[1]。全身性化疗是HCC的重要治疗手段,然而现有的化疗方案在很大程度上都存在化疗抵抗现象[2]。研究发现,引起肝癌化疗抵抗的主要原因之一是肝癌细胞发生了内质网应激(endoplasmic reticulum stress,ERS),它是细胞内外多种压力因素,包括缺氧、饥饿、氧化应激等导致的一种亚细胞器的病理状态[3]。通常情况下,ERS是一种细胞自我保护的机制,可以维持恢复细胞的稳态,然而程度过强或时间过长的ERS可以激活下游凋亡信号通路并最终引起细胞凋亡[4,5]。肝细胞癌常由病毒性或酒精性肝炎发展而来,肝癌细胞长期处于病毒感染、炎症等各种不良刺激下,加上肝癌组织快速增殖引起的缺血缺氧微环境,导致细胞较易处于内质网应激状态[6]。它对肝癌细胞具有保护作用,能够降低化疗药物的敏感性,进而抑制细胞凋亡。本课题组在前期工作中对肝癌内质网应激耐受现象及其机制进行了初步研究,证实当使用ERS诱导剂衣霉素(TM)作用于肝癌细胞后,细胞通过ATF6-COX2信号通路产生凋亡抵抗[7]。
转化生长因子β1(transforming growth factor-β1,TGF-β1)是转化生长因子β家族的一员,在肝脏含量最高,参与调节细胞的增殖、分化以及凋亡等过程。Elliott 和Blobe的[8]研究发现,TGF-β1在乳腺癌、胃癌、卵巢癌和前列腺癌这些肿瘤中发挥着强有力的生长抑制作用,并且它对凋亡的调节作用依赖于细胞和肿瘤的类型。相关文献报道,TGF-β1与内质网应激之间存在一定的关系,TGF-β1参与了多种细胞的内质网应激过程,如骨骼肌细胞、内皮细胞、心肌细胞、肝星状细胞以及HeLa细胞。本课题组前期研究也发现TGF-β1与肝癌细胞内质网应激之间的关系,肝癌细胞发生ERS后miR-663过表达,当抑制miR-663的表达能明显促进ERS后肝癌细胞凋亡,并证实TGF-β1是miR-663的靶基因,TGF-β1很有可能是肝癌细胞发生ERS诱导的凋亡抵抗的关键靶点[9],但具体机制尚有待阐明。近年来TGF-β1/Smad信号通路仍是肿瘤方面的研究热点,但其与肝癌细胞内质网应激之间的关系鲜有报道。因此,本研究对肝癌细胞ERS与TGF-β1/Smad信号通路展开了深入探索,通过调控该通路,明确其对ERS后肝癌细胞凋亡的影响,从而进一步揭示ERS状态下肝癌细胞发生凋亡抵抗的分子机制,以期为提高肝癌的化疗敏感性提供高效的作用靶点。
1 材料与方法
1.1 材料
衣霉素(Sigma,美国),脂质体 Lipofectamine 3000、Trizol(Invitrogen,美国),TGF-β1 siRNA、TGF-β1 pEX-3及相应对照(上海吉玛生物科技有限公司),抗TGF-β1多克隆抗体(Abcam,美国),抗p-Smad2多克隆抗体(CST,美国),抗GRP78 多克隆抗体购自(Bioworld,美国),抗β-actin多克隆抗体、山羊抗兔二抗、山羊抗小鼠二抗(北京中杉金桥生物技术有限公司),CCK-8试剂盒、PCR引物、All-in-One First-Strand cDNA Synthesis SuperMix、Top Green qPCR SuperMix Kit(北京全式金生物技术有限公司),ECL发光试剂盒(Thermo Fisher,美国),Annexin V-FITC/PI细胞凋亡试剂盒(BD,美国)。
1.2 细胞培养
人肝癌HepG2细胞株购自中国科学院上海生物化学与细胞生物学研究所。将从-80℃超低温冰箱中取出所需的肝癌HepG2细胞株复苏后,在含10%胎牛血清的DMEM培养基中常规培养,并置于37℃,5% CO2的培养箱内培养,隔天换液,待细胞融合度大于80%后进行传代,取对数生长期细胞用于实验。
1.3 实验设计
取处于对数生长期的HepG2细胞接种于6孔板中,培养24 h,待细胞贴壁后,经不同浓度、不同作用时间的TM刺激后,检测GRP78蛋白含量变化,以寻找建立内质网应激模型的最佳TM浓度和作用时间。实验分为6组,每组3个复孔,实验重复3次,Untreated组(未处理组)、TM组(3 μmol/L TM处理组)、TM+NC组(3 μmol/L TM+si-TGF-β1阴性对照组)、TM+si-TGF-β1组(3 μmol/L TM+si-TGF-β1组)、TM+pEX-3组(3 μmol/L TM+质粒对照组)及TM+TGF-β1 pEX-3组(3 μmol/L TM+TGF-β1过表达质粒组)。HepG2细胞内质网应激模型建立后,以lipofectamine3000为载体,按照说明书取75 pmol TGF-β1 小干扰RNA、2.5 μg TGF-β1过表达质粒及相应对照分别转染入HepG2细胞,24 h 后转染成功,收集细胞。采用RT-qPCR检测HepG2细胞中TGF-β1及p-Smad2 mRNA表达水平,Western blot检测TGF-β1及p-Smad2蛋白表达水平,CCK8检测HepG2细胞增殖抑制率,流式细胞术检测HepG2细胞凋亡情况。
1.4 内质网应激的诱导
分别使用不同浓度的 TM 作用肝癌HepG2细胞24 h和同一浓度TM作用肝癌细胞不同时间,采用 Western blot 方法检测内质网应激标志蛋白 GRP78 的变化。取生长状态较佳并处于对数生长期的 HepG2细胞接种于6孔板中培养,待细胞贴壁后,分别加入不同浓度TM(0 μmol/L、0.375 μmol/L、0.75 μmol/L、1.5 μmol/L、3 μmol/L和6 μmol/L)与HepG2细胞共培养24 h,同时,使用3 μmol/L浓度的TM与HepG2细胞共同培养0 h、6 h、12 h、24 h、36 h和48 h。作用结束后收集细胞,提取蛋白后,经Western blot检测内质网应激标志蛋白GRP78的表达。
1.5 细胞转染
利用脂质体Lipofectamine 3000为载体,将小干扰RNA(si-RNA)、过表达质粒及其相应对照转染入HepG2细胞内,整个过程需保证无RNA酶污染。TGF-β1 siRNA NC由羟基荧光素(FAM)基团标记,可于荧光显微镜下看到绿色荧光。转染后24 h,于荧光显微镜下观察和拍照,并估算转染效率。转染效率(%)= 荧光场带绿色荧光细胞数/明场细胞总数 × 100% 。
1.6 RT-qPCR法检测
收集转染24 h后的HepG2细胞,根据Trizol说明书上的步骤提取总RNA,取A260/A280值在1.8~2.0应用于实验。以β-actin为内参,TGF-β1及β-actin引物序列见表1。将RNA逆转录为cDNA,逆转录反应为20 μl体系,反应条件为37℃ 15 min,85℃ 5 s。扩增采用20 μl体系,反应条件为95℃ 5 min,95℃ 10 s,60℃ 30 s共40循环。然后进行实时荧光定量 PCR仪检测,获得Ct值,ΔCt = CtTGF-β1- Ctβ-actin,ΔΔCt= ( CtTGF-β1- Ctβ-actin) 转染组 - ( CtTGF-β1- Ctβ-actin)空白对照组,组间TGF-β1 的相对表达水平用 2-ΔΔCt计算。
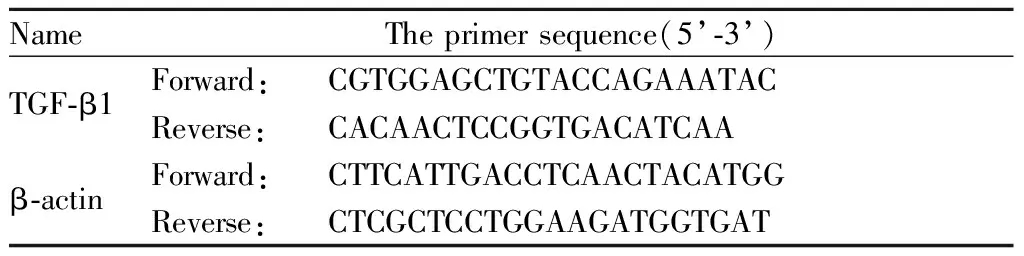
Tab. 1 The primer sequences for RT-qPCR
1.7 Western blot法检测
收集转染24 h后的HepG2细胞,用细胞裂解液提取总蛋白。 经SDS/PAGE凝胶电泳分离蛋白、转膜、封闭、洗膜等操作后,一抗4℃孵育过夜,次日洗膜后,加入二抗,室温孵育 2 h,洗膜后加入ECL显影液曝光,采用 Image J 软件分析图像灰度值,测定蛋白的相对表达量。
1.8 CCK-8实验
取处于对数生长期的HepG2细胞(5×103~6×103cells/well)接种于96孔细胞培养板中,每孔加入100 μl细胞悬液,待细胞贴壁后以3 μmol/L的TM处理细胞,24 h后进行转染。每组均设3个复孔。孵育24 h后每孔加入10 μl的CCK-8溶液,继续孵育2 h,随后酶标仪于450 nm处检测各组的吸光度(optical density,OD)值,取每组平均值,比较组间差异,实验重复3次。细胞增殖抑制率(cellular proliferation inhibition rate,CPIR),CPIR=[1-(实验组OD-空白孔OD)/(对照组OD-空白孔OD)]×100%。
1.9 流式细胞术
将转染24 h后的HepG2细胞用不含EDTA的胰酶消化后,制备成单细胞悬液,于室温2 000 r/min离心5 min后弃上清,PBS洗涤后弃去漂洗液,加入300 μl的1×Binding Buffer重悬细胞,向管中加入5 μl Annexin V-FITC混匀后于4℃避光孵育15 min,随后加入10 μl的PI染色避光孵育5 min,上机前补加200 μl的1×Binding Buffer,FlowJo 7.6软件进行分析。被分析的细胞可分为四组,其中: Q1代表Annexin V﹣PI﹢(坏死细胞),Q2代表 Annexin V﹢PI﹢(凋亡后继发坏死细胞,即晚期凋亡细胞),Q3代表Annexin V﹢PI﹣(早期凋亡细胞),Q4代表Annexin V﹣PI﹣(存活细胞)。细胞凋亡率(%)= Q2 + Q3。
1.10 统计学处理
2 结果
2.1 ERS模型的建立
不同浓度的TM与人肝癌HepG2细胞共培养24 h,Western blot法检测内质网应激标志蛋白GRP78的表达水平变化,结果显示,随着药物浓度的增加GRP78蛋白的表达水平有所上升,如图1A所示,TM的浓度为3 μmol/L时GRP78表达达到峰值,因此本实验采用3 μmol/L浓度的TM诱导ERS。同时,为了解TM诱导ERS的强度是否与时间有关,我们将3 μmol/L的TM与HepG2细胞共培养不同时间,Western blot法检测内质网应激标志蛋白GRP78的表达水平变化,如图1B所示,GRP78蛋白表达水平随着TM作用时间的延长而增加,TM作用24 h GRP78升高达到峰值。这提示3 μmol/L TM作用24 h 可以成功诱导HepG2细胞发生ERS。
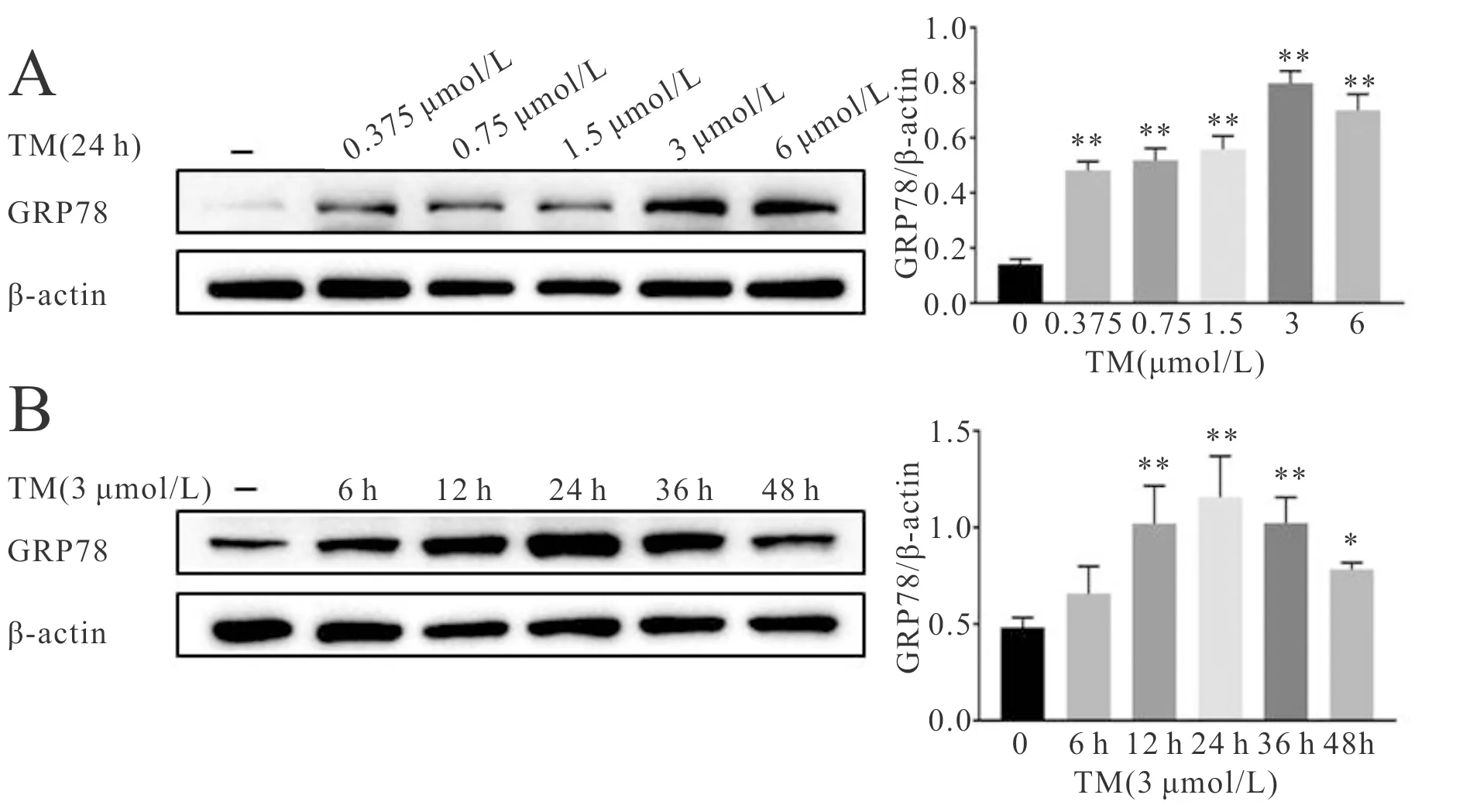
Fig. 1 The GRP78 expression in HepG2 cells under different concentration and time of TM n = 3)
2.2 转染效率检测
转染si-TGF-β1 6 h 后,先在荧光倒置显微镜的明场下观察细胞,后在同一视野下转为荧光场,可观察到带绿色荧光的 HepG2细胞大于总细胞数的 90%,表明转染效率超过90% (图 2A)。为了验证HepG2细胞在转染 si-TGF-β1 后细胞内的 TGF-β1蛋白表达情况,进一步采用了Western blot法检测转染24 h 后HepG2细胞中TGF-β1蛋白的表达水平。结果发现:转染24 h 后,与空白对照组及阴性对照组相比,si-TGF-β1的三条同源序列均可显著抑制TGF-β1的表达,其中以si-TGF-β1-2的抑制作用最明显(P<0.01,图2B),后续实验选用si-TGF-β1-2。
2.3 调控TGF-β1对TGF-β1/Smad信号通路分子TGF-β1、p-Smad2表达的影响
为明确HepG2细胞株发生ERS前后TGF-β1 mRNA表达的变化及调控TGF-β1表达对TGF-β1/Smad信号通路的影响,先使用3 μmol/L的TM作用24 h,诱导细胞发生ERS,然后转染si-TGF-β1、TGF-β1 pEX-3及相应对照,24 h后提取总RNA,利用RT-qPCR法定量检测TGF-β1 mRNA的含量变化。以空白对照组(Untreated)的表达量为基准,2-ΔΔCt计算相对表达水平,结果发现:如表2所示,TM组的TGF-β1 mRNA表达比空白组明显降低(P<0.05),应用si-TGF-β1干扰后,TGF-β1 mRNA的表达较TM组显著减少(P<0.05),而转染过表达质粒TGF-β1 pEX-3后,TGF-β1 mRNA的表达较TM组显著增加(P<0.01)。

Fig. 2 The cell transfection efficiency detection
细胞经过相同的处理后提取总蛋白,利用Western blot法检测TGF-β1和p-Smad2蛋白含量变化。结果发现,如表2与图3所示,TM组的TGF-β1和p-Smad2蛋白表达量比空白组明显降低(P< 0.05),应用si-TGF-β1干扰后,TGF-β1和p-Smad2蛋白的表达较TM组显著减少(P<0.05),而转染过表达质粒TGF-β1 pEX-3后,TGF-β1和p-Smad2蛋白的表达较TM组显著增加(P<0.01),与RT-qPCR结果一致。该结果提示HepG2 细胞发生ERS后TGF-β1和p-Smad2的表达降低,即TGF-β1/Smad信号通路受到抑制;转染si-TGF-β1可进一步抑制TGF-β1/Smad信号通路,而转染TGF-β1 pEX-3可有效激活TGF-β1/Smad信号通路。

Fig. 3 Equal protein amounts of cell lysates were subjected to western blot assay using anti-TGF-β1 and anti-p-Smad2, β-actin in the same HepG2 cells extract was used as an internal reference
2.4 调控TGF-β1/Smad2通路对ERS状态下HepG2细胞增殖抑制率的影响
为了检测调控TGF-β1/Smad2通路对ERS后HepG2细胞增殖抑制率的影响,转染24 h后进行CCK-8检测,CPIR公式来计算细胞增殖抑制率。结果如表3所示,下调TGF-β1的表达后,ERS状态下HepG2细胞增殖抑制率显著下降(P<0.01),上调TGF-β1的表达可显著促进ERS状态下HepG2细胞的增殖抑制率显著(P<0.01)。

Tab. 2 The relative TGF-β1 mRNA expression level, the TGF-β1 and p-Smad2 protein expression levels of HepG2 cells under ERS in each group after transfection n=3)
2.5 调控TGF-β1/Smad2通路对ERS状态下HepG2细胞凋亡的影响
TGF-β1/Smad2通路在肝癌HepG2细胞发生ERS后受到抑制,为了进一步研究TGF-β1/Smad2通路在ERS诱导的凋亡抵抗中的发挥的作用,我们利用Annexin V-FITC/PI双染凋亡试验研究调控TGF-β1的表达对ERS状态下HepG2细胞凋亡率的影响。将细胞分组培养,使用3 μmol/L的TM作用24 h,转染si-TGF-β1和过表达质粒及其对照组,24 h后流式细胞仪检测,结果如图4与表3所示:下调TGF-β1的表达,ERS状态下HepG2细胞凋亡率显著降低(P<0.01),当上调TGF-β1的表达后凋亡率出现显著升高(P<0.01)。这提示激活TGF-β1/Smad2信号通路可促进ERS状态下HepG2细胞的凋亡。
3 讨论
在许多人类实体肿瘤中,由于细胞内外各种刺激因素的长期作用,很容易造成内质网功能紊乱,诱导ERS的产生,肿瘤细胞为了适应这种恶虐的生长环境也常常发生适应性改变,使其免于凋亡,因此ERS逐渐演变成了一种保护机制,结果却使肿瘤细胞对ERS产生了适应,那些经过适应性选择而耐受ERS的肿瘤细胞继续增长,往往会导致肿瘤的进展。这也就是常被提到的ERS介导的凋亡抵抗现象[2,10]。虽然由ERS引起肿瘤细胞凋亡抵抗已有不少报道,但TGF-β信号通路是否在这个过程中发挥作用尚未被深入研究,因对TGF-β信号通路与ERS在肝癌中的关系有着浓厚的兴趣,本课题组在前期工作的基础上开展了这方面的研究。

Fig. 4 HepG2 cells were transfected with si-TGF-β1 and TGF-β1 pEX-3 for 24 h after pretreated by tunicamycin(TM)for 24 h, apoptosis cell were determined by FACS

Tab. 3 Effect of regulating TGF-β1/Smad2 pathway on cell proliferation inhibition rate and apoptosis rate of HepG2 cells under ERS n=3)
转化生长因子β家族包括TGF-β1-6共6种异构体,它们具有相似的生物活性,但基因的表达具有明显的组织及发育特异性,其中肝脏含量最高且具有生物活性的TGF-β1,它在参与的许多肿瘤细胞生物学功能中发挥着重要作用,包括细胞增殖、分化、凋亡和转移等[11]。TGF-β1主要通过与其受体TβR1-3形成复合物后调控下游Smad蛋白,形成TGF-β1/Smad信号转导通路发挥生物学作用[12,13]。
近年来已有一系列研究报道了TGF-β与内质网应激之间关系。Huang等[14]研究揭示TGF-β通路可能参与了人脐静脉内皮细胞的内质网应激过程。Wang等[15]研究发现TGF-β可以通过降低心肌细胞的内质网应激作用,防止缺氧-复氧诱导的心肌细胞凋亡。此外,还有研究显示,在HeLa细胞中,ERS标志性蛋白GRP78会阻断TGF-β/Smad及其下游信号通路[16],这与本研究中证实的HepG2细胞ERS后TGF-β1表达受到抑制这一结果也是一致的。这些研究结果都表明TGF-β与内质网应激之间存在密切的联系,也为本研究提供了充分的理论依据。
目前国内外关于TGF-β1与肝癌的关系也有大量研究, Giannelli 等[17]研究证实TGF-β1在体外能够促进肝癌细胞的上皮-间质转化。TGF-β1活性会影响其下游的MAPK信号通路、TGF-β1/Smad信号通路的活性,这些通路是肝癌细胞中的重要通路。卢燕辉等[18]研究显示肝癌组织中TGF-β1/Smad信号通路下游的转录因子RUNX3基因在肝癌组织的mRNA表达水平显著低于癌旁组织,该转录因子的减少会影响TGF-β抑制肿瘤信号通路的转导,从而诱导肿瘤的发生。更有研究发现,TGF-β1/Smad信号通路几乎参与了肝脏疾病的所有阶段,从最初的炎症和纤维化直到最终的肝硬化以至肝癌,而且TGF-β1/Smad信号通路在肝癌的不同阶段发挥的作用也不同,在肿瘤形成时,TGF-β1/Smad信号通路抑制肿瘤细胞生长;而当肿瘤处于进展期时,TGF-β1/Smad信号通路发挥促进肿瘤细胞生长的作用[19]。在本研究中,我们也证实了TGF-β1/Smad信号通路与肝癌之间的密切关系,并且深入探究了TGF-β1/Smads信号通路对ERS状态下肝癌HepG2细胞凋亡的影响。
研究中我们发现,与未经衣霉素(TM)处理的肝癌HepG2细胞相比,在衣霉素(TM)处理的HepG2细胞中TGF-β1及其下游因子p-Smad2的表达水平明显下降。有证据显示TGF-β1的低表达与肝癌细胞的增殖和凋亡等进程关系密切[20]。为了进一步明确TGF-β1/Smad通路在体外参与ERS状态下肝癌细胞凋亡的分子机制,后续实验中我们利用脂质体转染技术对TGF-β1基因进行敲除或者过表达处理后,RT-qPCR和Western blot证实TGF-β1/Smad信号通路得到了有效的抑制或激活,随后采用CCK8法及流式细胞术检测细胞的增殖抑制和凋亡情况。结果发现,TM单独作用诱导肝癌细胞ERS后会引起HepG2细胞轻度凋亡,这与我们课题组前期研究结果也是一致的[7,9],当TM与si-TGF-β1联合作用HepG2细胞凋亡率及增殖抑制率出现了明显减少,然而,当TM与TGF-β1过表达质粒联合作用HepG2细胞凋亡率及增殖抑制率显著增加。这一结果提示,激活TGF-β1/Smad信号通路能够增强ERS状态下HepG2细胞的凋亡现象。
综上所述,我们的研究证实,当抑制TGF-β1/Smad通路后,ERS状态下的肝癌HepG2细胞增殖抑制率和凋亡率显著下降;反之,激活TGF-β1/Smad通路后,ERS状态下的肝癌HepG2细胞增殖抑制率和凋亡率显著升高。这不仅与我们前期调控miR-663的表达对ERS状态下肝癌细胞的增殖与凋亡的结果充分吻合,也进一步证实了HepG2细胞内质网应激诱导的凋亡抵抗的具体分子机制,TGF-β1/Smad信号通路在肝癌HepG2细胞发生内质网应激后受到抑制,当我们重新激活该通路后,ERS状态下的肝癌HepG2细胞凋亡率明显升高。由此,我们得出结论:ERS状态下的肝癌HepG2细胞可能通过抑制TGF-β1/Smad信号通路发挥凋亡抵抗作用,当激活该通路后,ERS状态下的肝癌HepG2细胞的凋亡率出现明显升高。这不仅为进一步明确肝癌细胞发生内质网应激诱导的凋亡抵抗机制提供了一种新的理论基础,同时也为肝癌的治疗提供了新思路与新靶点。

