奥马珠单抗治疗儿童中重度过敏性哮喘的有效性和安全性系统评价Δ
姜红玉,李 娟,胡文凤,顾锦华,张 琳,张海波
(1.南通大学附属妇幼保健院急诊科,江苏 南通226018;2.南通大学附属妇幼保健院药剂科,江苏 南通 226018)
支气管哮喘(以下简称“哮喘”)是一种异质性疾病,通常以慢性气道炎症为特征,是儿童时期最常见的慢性气道疾病[1]。儿童时期严重哮喘控制不足,会严重影响患儿的身心健康和生活质量,并造成较大的经济和社会负担[2]。我国儿童哮喘患者中,哮喘未控制的患儿比例高达19.9%[3];即使经过系统评估以优化哮喘治疗,包括对哮喘诱因的控制、合并症和障碍的评估,但仍有约5%~15%的哮喘患儿的病情并未缓解,这与发病率和死亡率的升高有关[4]。过敏性哮喘是哮喘中的主要类型,其患者数占支气管哮喘患者数的60%~80%,涉及Th2细胞因子的释放和免疫球蛋白E(IgE)抗体的产生。《中国过敏性哮喘诊治指南(第一版,2019年)》[5]推荐抗IgE单克隆抗体用于第4级治疗不能控制的中重度过敏性哮喘。其中,奥马珠单抗于2003年获得美国食品药品监督管理局批准用于治疗6岁以上严重过敏性哮喘患者,是抗IgE单克隆抗体中全球首个批准上市的靶向治疗药物。在我国,奥马珠单抗于2017年正式获得国家药品监督管理部门批准(上市),用于治疗12岁以上经吸入性糖皮质激素合并长效β2肾上腺素受体激动剂治疗控制不佳的中重度过敏性哮喘患者。已有循证医学证据表明,奥马珠单抗可以降低严重过敏性哮喘患者的恶化风险,减少吸入性糖皮质激素使用剂量,且能改善患者生活质量[6]。但儿童患者的临床研究和数据较少,本研究系统检索目前发表的临床随机对照试验(randomized controlled trail,RCT),系统评价奥马珠单抗治疗儿童中重度过敏性哮喘的有效性和安全性,为临床合理用药决策提供客观依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型:RCT,无论是否采用盲法。
1.1.2 研究对象:符合全球哮喘防治倡议(global initiative for asthma,GINA)中重度过敏性哮喘诊断标准;年龄≤18岁;性别不限。
1.1.3 干预措施:研究组患儿使用奥马珠单抗治疗;对照组患儿使用其他治疗过敏性哮喘的药物(包括安慰剂)。
1.1.4 结局指标:(1)哮喘恶化率;(2)哮喘全球疗效评估(global evaluation of treatment effectiveness,GETE)优良率;(3)儿童控制哮喘测试(childhood asthma control test,C-ACT)评分;(4)第1秒用力呼气容积占预计值百分比(FEV1%);(5)第1秒用力呼气容积占用力肺活量百分比(FEV1/FVC);(6)缺课时间(d);(7)严重不良事件(serious adverse event,SAE)发生率;(8)儿科哮喘生命质量调查问卷(pediatric asthma quality of life questionnaire,PAQLQ)评分。对于同一课题组的研究报告或同一临床研究不同随访时间的结果报告,若报告指标相同,则纳入最新报告的研究结果。
1.1.5 排除标准:(1)重复发表的文献;(2)数据不完整或无相关结局指标的会议摘要;(3)目前正在进行且无结果报告的RCT。
1.2 文献检索策略
检索中国知网(CNKI)、万方数据库(Wanfang Data)、PubMed、Cochrane Controlled Register of Trials(CENTRAL)及Embase数据库,检索时间均为自建库至2021年3月;采用主题词与自由词相结合的方式,英文检索词及检索式为:(“omalizumab”or “Xolair”or “rhuMAb-E25”)and “asthma”and(“pediatric”or “children”);中文检索词及检索式为:“儿童”和“奥马珠单抗”和“哮喘”。
1.3 文献筛选、资料提取与质量评价
由2名评价员根据纳入与排除标准独立检索数据库,并对初步符合纳入标准的文献进行全文查找,如遇分歧,则通过讨论或请第三方评价员参与讨论来决定;应用统一的表格提取文献数据,提取的信息包括纳入文献的一般特征(作者、发表时间和研究类型等)、纳入研究对象的基本特征(研究人群、年龄和样本量等)、干预措施和结局指标。按照Cochrane系统评价员手册5.1.0版的偏倚风险评估工具,对纳入研究的方法学质量进行评价[7]。
1.4 统计学方法
采用RevMan 5.3软件进行统计学分析,计数资料采用相对危险度(RR)为效应指标,计量资料采用均数差(MD)为效应指标,区间估计采用95%置信区间(CI)。首先采用χ2检验对纳入研究进行异质性检验,检验水准为α=0.10,并采用I2对异质性进行定量分析,P≤0.10说明存在统计学异质性,I2≥50%说明存在高度异质性,则采用随机效应模型进行荟萃分析(Meta分析);反之,采用固定效应模型进行Meta分析。
2 结果
2.1 文献筛选结果与纳入文献的基本特征
初检出311篇文献,依据纳入与排除标准,剔除重复文献44篇,阅读题目和摘要后排除243篇,进一步阅读全文后排除16篇,最终纳入8篇文献,见图1。纳入的8篇文献[8-15]均为来自国外的研究,共涉及1 991例患儿(研究组患儿1 286例,对照组患儿705例),所有文献至少报告了1项结局指标。纳入文献的基本特征见表1。
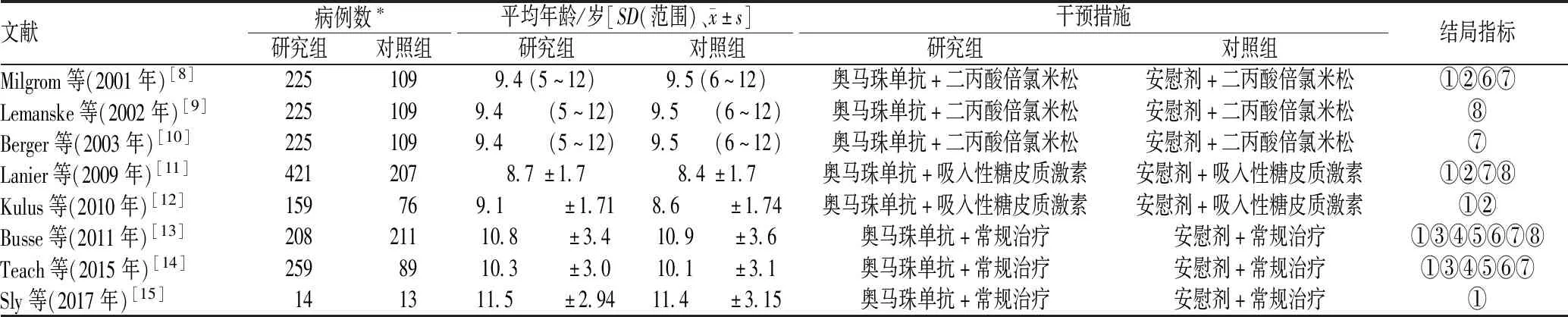
表1 纳入文献的基本特征Tab 1 General characteristics of included literature

图1 文献筛选流程与结果Fig 1 Literature screening process and results
2.2 纳入文献的质量评价
纳入的8项研究[8-15]中,3项研究描述了随机方法[11-12,14],其余5项研究未提及,仅描述为“随机”;所有研究均未描述分配隐藏;所有研究均实施双盲;所有研究数据均报告完整;所有研究均未选择性报告结果;2项研究[13-14]无其他偏倚。纳入研究的偏倚风险结果见图2。
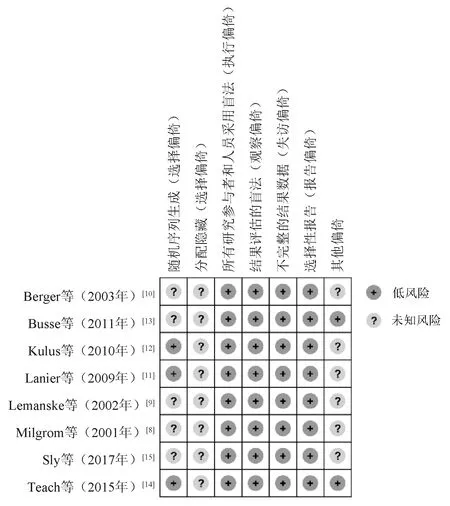
图2 纳入研究的偏倚风险图Fig 2 Risk of bias chart for included literature
2.3 Meta分析结果
2.3.1 哮喘恶化率:6项研究[8,11-15]报告了哮喘恶化率。其中,2项研究[11-12]以在治疗期间内恶化风险人日数表示(恶化次数/人/日)哮喘恶化率,报告中的有效指标为效应值RR及95%CI,根据异质性检验结果(I2=0%,P=0.87),采用固定效应模型对其进行效应值的Meta分析。结果显示,研究组患儿的哮喘恶化率显著低于对照组,差异具有统计学意义(RR=0.68,95%CI=0.55~0.85,P=0.000 7),见图3(A)。4项研究[8,13-15]以发生恶化患儿所占百分比表示哮喘恶化率,根据异质性检验结果(I2=16%,P=0.31),采用固定效应模型对其进行二分类数据的Meta分析。结果显示,研究组、对照组患儿的哮喘恶化率分别为19.23%(134/697)、41.06%(170/414),研究组患儿的哮喘恶化率显著低于对照组,差异具有统计学意义(RR=0.54,95%CI=0.45~0.66,P<0.000 01),见图3(B)。

A.恶化风险人日数;B.发生恶化患儿所占百分比A.exacerbation incidence expressed as number of person-days at risk of exacerbation;B.exacerbation incidence expressed as percentage of children with exacerbation图3 两组患儿哮喘恶化率比较的Meta分析森林图Fig 3 Meta-analysis of comparison of exacerbation rate of asthma between two groups
2.3.2 GETE优良率:2项研究[8,11]报告了GETE优良率,根据异质性检验结果(I2=0%,P=0.85),采用固定效应模型进行Meta分析。结果显示,研究组、对照组患儿的GETE优良率分别为66.34%(404/609)、47.84%(144/301),研究组患儿的GETE优良率显著高于对照组,差异具有统计学意义(RR=1.39,95%CI=1.23~1.58,P<0.000 01),见图4。

图4 两组患儿GETE优良率比较的Meta分析森林图Fig 4 Meta-analysis of comparison of GETE excellent rate between two groups
2.3.3 C-ACT评分:2项研究[13-14]报告了C-ACT评分,根据异质性检验结果(I2=0%,P=0.53),采用固定效应模型进行Meta分析。结果显示,研究组患儿的C-ACT评分显著高于对照组,差异具有统计学意义(MD=0.76,95%CI=0.31~1.21,P=0.001),见图5。
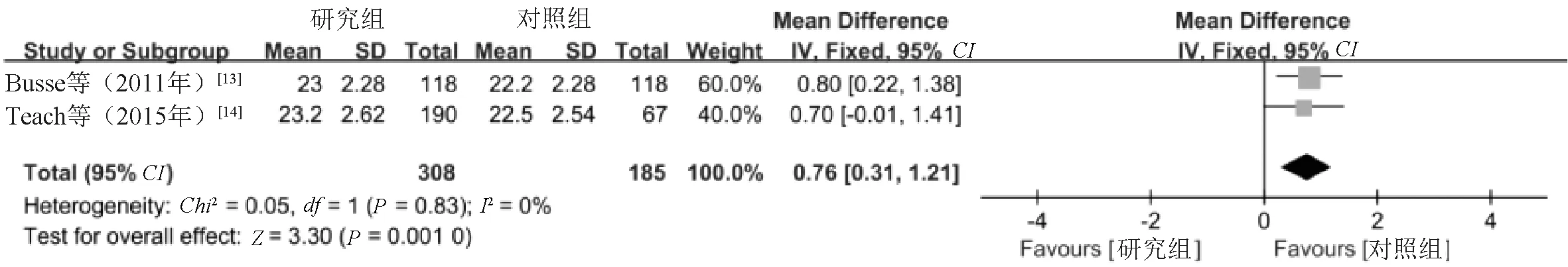
图5 两组患儿C-ACT评分比较的Meta分析森林图Fig 5 Meta-analysis of comparison of C-ACT score between two groups
2.3.4 FEV1%:2项研究[13-14]报告了FEV1%,根据异质性检验结果(I2=0%,P=0.51),采用固定效应模型进行Meta分析。结果显示,两组患儿FEV1%水平比较,差异无统计学意义(MD=0.62,95%CI=-0.89~2.13,P=0.42),见图6。
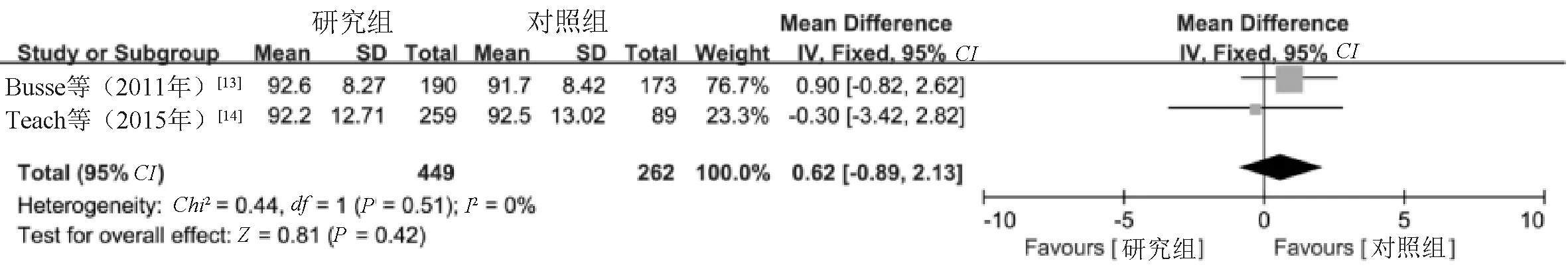
图6 两组患儿FEV1%水平比较的Meta分析森林图Fig 6 Meta-analysis of comparison of FEV1% between two groups
2.3.5 FEV1/FVC:2项研究[13-14]报告了FEV1/FVC,根据异质性检验结果(I2=0%,P=0.70),采用固定效应模型进行Meta分析。结果显示,两组患儿FEV1/FVC水平比较,差异无统计学意义(MD=-0.10,95%CI=-0.98~0.79,P=0.83),见图7。
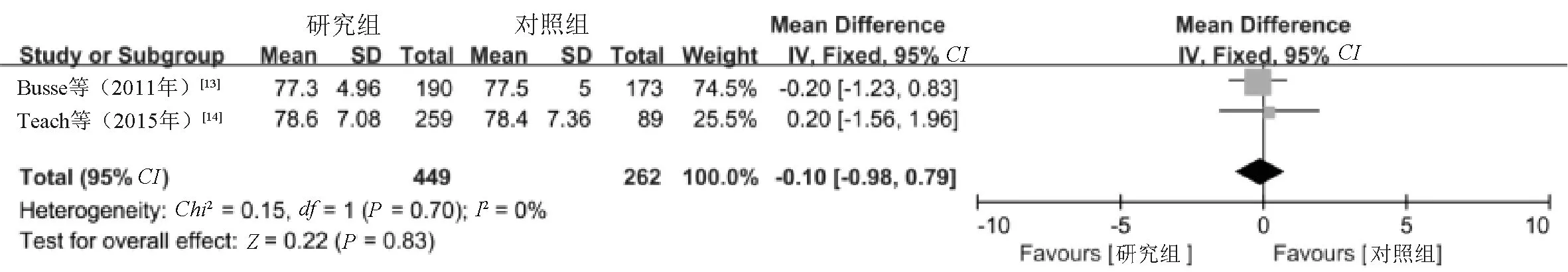
图7 两组患儿FEV1/FVC水平比较的Meta分析森林图Fig 7 Meta-analysis of comparison of FEV1/FVC between two groups
2.3.6 缺课时间:3项研究[8,13-14]报告了患儿缺课时间,根据异质性检验结果(I2=91%,P<0.000 01),采用随机效应模型进行Meta分析。结果显示,研究组患儿的缺课时间明显少于对照组,差异具有统计学意义(MD=-0.30,95%CI=-0.57~-0.02,P=0.04),见图8。

图8 两组患儿缺课时间比较的Meta分析森林图Fig 8 Meta-analysis of comparison of time of absence from school between two groups
2.3.7 PAQLQ评分:3项研究[9,11,13]报告了PAQLQ评分,但每项研究的评价标准不统一,故未进行Meta分析,仅对相关研究进行定性分析。3项研究结果均表明,与对照组相比,虽然研究组患儿的PAQLQ评分更高,但差异均无统计学意义(P分别为0.676、0.34和0.226)。
2.3.8 SAE发生率:4项研究[8,11,13-14]报告了SAE发生率,根据异质性检验结果(I2=41%,P=0.16),采用固定效应模型进行Meta分析。结果显示,研究组、对照组患儿的SAE发生率分别为4.58%(51/1 113)、10.71%(66/616),研究组患儿的SAE发生率显著低于对照组,差异具有统计学意义(RR=0.54,95%CI=0.39~0.76,P=0.000 4),见图9。

图9 两组患儿SAE发生率比较的Meta分析森林图Fig 9 Meta-analysis of comparison of SAE incidence between two groups
2.3.9 敏感性与发表偏倚分析:缺课时间指标中各研究间存在较大异质性,对其进敏感性分析,改变统计效应模型后的结果仍显示,研究组患儿具有较少的缺课时间,说明稳定性良好。由于各项指标纳入合成的研究数均<5篇,故未绘制漏斗图进行发表偏倚分析。
3 讨论
过敏性哮喘是哮喘一个重要的表型,在儿童哮喘患者中,过敏性哮喘患儿所占比例达80%及以上[16]。哮喘未得到有效控制,会严重影响患儿的生活质量,并造成显著的社会经济负担。奥马珠单抗是一种结合IgE的人源化IgG1κ单抗,其可阻断IgE介导的过敏级联反应,减少炎症因子释放,从而有效控制哮喘的症状和发作,是哮喘领域首个靶向治疗药物,同时可以抑制效应细胞(如肥大细胞、嗜碱性粒细胞)表面FcεRI受体与IgE结合,阻止炎症细胞的激活和炎症介质的释放[17]。
本次Meta分析结果显示,在有效性方面,与对照组比较,研究组治疗方案可以显著降低患儿的哮喘恶化率,并具有更高的GETE优良率和C-ACT评分,但对肺功能指标FEV1%、FEV1/FVC的影响方面,两组方案的效果相当;在安全性方面,与对照组比较,研究组治疗方案可以显著降低患儿的SAE发生率,可以显著改善患儿的生活质量,患儿的缺课时间更少。在降低哮喘恶化率、改善患儿生活质量、减少耽误的工作/学习时间以及降低SAE发生率方面,儿童使用奥马珠单抗的有效性和安全性结果与一些成人和青少年的系统评价研究结论一致[18-19];但在改善肺功能方面,儿童使用奥马珠单抗的效果与成人不一致[19]。
本系统评价的局限性:首先,所有纳入研究均为英文研究,可能会导致以其他语种形式发表的RCT未纳入的语种偏倚风险;其次,每项评价指标所纳入的研究较少,均<5篇,无法进行可靠的发表偏倚分析,有可能主观夸大两组间指标比较的差异;第三,由于所纳入研究中的PAQLQ评分标准不统一,故未进行Meta分析,仅进行定性分析;最后,所纳入研究的随访时间较短,最长持续52周,缺少长时间随访数据,上述因素均有可能影响本次Meta分析的结果。
综上所述,奥马珠单抗可有效改善儿童中重度过敏性哮喘患儿的临床指标,改善患儿的生活质量,且能显著降低SAE发生率,是可推荐的有效且安全的药物。受样本量和随访时间的限制,上述结论尚需高质量、大样本的长期随访临床研究验证。

