茜素络合物在青鱼幼鱼耳石上的标记效果评价
朱亚华,姜 涛,陈修报,刘洪波,杨 健,
(1. 南京农业大学无锡渔业学院,江苏 无锡 214081; 2. 中国水产科学研究院淡水渔业研究中心/院长江中下游渔业生态环境评价与资源养护重点实验室,江苏 无锡 214081)
鱼类标记在经济鱼类的洄游、扩散等生态学研究[1],增殖放流成效评价[2],渔业资源状况评估[3-4]以及渔业管理措施的制定[5]等诸多方面具有重要的意义。与遗传学标记方法[6]相比,基于鱼体化学物质浸泡而使其耳石产生标记的方法具有成本低、易应用等优势[6-9]。在鱼类的全生活史过程中,作为主要起平衡和听觉功能的钙化组织,耳石的结构和组成均非常稳定,不受代谢影响[10],故不仅被用于资源群识别[11]、生境履历重建和破译鱼龄及生活史过程[12-13],也常被用作对鱼类进行特定化学标记的载体[7-9]。比如荧光化学物质会通过鱼体结合于耳石中,相应结合区在特定激发光下发出荧光[9],从而起到标记鱼的效果;且标记时间较长,鱼的死亡率较低[14-15]。茜素络合物 (ALC) 就是其中广受关注的一类[16-18]。
增殖放流一直是增殖渔业中的重要措施之一。开展增殖放流活动业已成为恢复野生鱼类自然资源和促进渔民增收的重要手段[19-20]。为此,研发可支撑经济鱼类增殖放流效果评价的标记方法意义重大。青鱼 (Mylopharyngodon piceus) 是我国著名的“四大家鱼”之一,广布于我国的长江流域、附属支流及各地湖泊[16],为淡水渔业资源主要增殖放流的经济物种 (广布种)。迄今,除王丰等[21]通过微卫星标记方法对人工饲养的青鱼和野生青鱼进行过初步鉴别外,尚未见其耳石标记方面的报道。本研究首次用茜素络合物对青鱼幼鱼进行了浸泡标记,并对标记条件和效果进行了评价,以期为青鱼探索一种合理有效的耳石化学标记方法,并为今后淡水鱼类相关的增殖放流效果评估提供理论依据和技术支撑。
1 材料与方法
1.1 实验材料
本研究在中国水产科学研究院淡水渔业研究中心南泉基地开展。实验中所需青鱼幼鱼 [全长 (44.09±6.89) mm,体质量 (0.59±0.32) g)] 于 2019年 6月 27日购自常州专业育苗场。实验鱼先放入装有已提前曝气 2 d 自来水的玻璃缸 (长 100 cm×宽 45 cm×高50 cm) 中暂养。在暂养过程中每日投喂粉状普通配合饲料2次。每日清理残饵、粪便并换水1次,换水量占养殖水体的1/3,同时在整个过程中保持水体持续充气增氧。实验水温为28~32 ℃,自然光照,不控光周期。荧光染料茜素络合物为上海生工生物工程股份有限公司生产,包装规格为1 g·瓶−1,粉末状。参考邱晨等[22]使用茜素络合物对鲤 (Cyprinus carpio) 仔鱼的浸泡浓度,实验设置对照组 (0 mg·L−1) 和标记组 (100 mg·L−1)。浸泡标记实验时对照组和实验组青鱼均置于实验专用缸 (长30 cm×宽 20 cm×高 30 cm) 中。
1.2 实验条件
本实验分2个阶段进行。第一阶段为浸泡标记阶段。2019年7月12日,从暂养缸中随机挑选100尾鱼 (已提前饥饿48 h),将其分别放至含有0和 100 mg·L−1茜素络合物实验用水的上述标记专用缸中。实验组和对照组各用1个缸,每个缸中均匀放入50尾。为了确保荧光物质能被清晰地标记上,浸泡时长设为48 h。在浸泡标记过程中鱼体生长良好,未出现死亡或其他异常情况。第二阶段为恢复续养阶段。当浸泡完成后,将鱼苗移至装有曝气水体的缸中,使其在里面自由游动3 min,然后换水重复操作3次。用此方法对鱼体表面进行冲洗,去除染液,随后移至恢复续养玻璃缸 (长100 cm×宽 45 cm×高 50 cm) 中养殖。在浸泡标记阶段不喂食,当移至恢复续养玻璃缸后,开始正常投喂粉状普通配合饲料,每日投喂2次,每日清理鱼体排泄物并换水1次,在浸泡标记和恢复续养的整个阶段中均正常充气增氧,水温保持在28~32 ℃,不控光周期。从移至恢复续养缸的当天计为第0天开始取样,每次取样5尾,每5 d取样1次,取样至第20天结束。
1.3 耳石的采样及标记效果检测
将样本鱼放至载玻片上,置于解剖镜下,用剪刀将鱼体头部与身体分离,同时从头部中间剪开,然后用解剖针从左右头部听囊取出3类耳石;先用去离子水清洗掉耳石上附带的杂质及黏膜,再用无水乙醇进行脱水、干燥。使用体式显微镜对3类耳石形态进行拍照 (图 1)。

图1 青鱼幼鱼的3类耳石a. 矢耳石;b. 微耳石;c. 星耳石。Figure 1 Three types of otoliths from juvenile black carpa. Sagitta; b. Lapillus; c. Asteriscus.
参考邱晨等[22]对鲤仔鱼荧光标记的处理措施,使用无色透明指甲油将耳石包埋固定在载玻片上 (无须打磨),等指甲油完全凝固后,避光保存。通过日本OLYMPUS BX51型显微镜的可见光 (BS)、蓝色激发光 (WBS)、绿色激发光 (WGS) 和紫色激发光 (WUS) 对其进行观察[23],比较最适光源,并利用显微镜自带的Stream start软件进行图谱拍照和图像处理。耳石标记效果参照欧阳斌和常剑波[24]的方法按无 (−)、微弱 (+)、较明显 (++)、明显 (+++)、非常明显 (++++) 5个等级来记录。为了方便对标记效果进行判别统计,本研究将上述5个等级的效果按 0 (无)、1 (微弱)、2 (较明显)、3 (明显)、4 (非常明显) 来记录。
1.4 耳石荧光标记环时间差的检测
在进行耳石荧光标记的时滞观察时,由于青鱼已约2月龄,鱼体较大,本研究将经无色透明指甲油包埋的耳石先用4 000目砂纸打磨,直至核心整个面完全暴露,进行抛光确保其表面无划痕。后用二甲苯溶液对包埋耳石的无色透明指甲油进行溶解,在解剖镜下用解剖针将耳石另外一面朝上,再在其表面用无色透明指甲油二次固定。对重新固定的耳石继续用4 000目砂纸打磨,直至此面耳石核心也完全暴露,之后对其进行约10 s酸蚀,利用上述BX51型显微镜进行图谱拍照得到日轮读数,进而推算时滞。
1.5 数据处理
本研究中不同恢复养殖时间下标记组与对照组的全长、体质量数据采用 Excel 2016软件进行处理分析并作图,通过SPSS 26.0软件进行单因素方差分析 (One-way ANOVA),P<0.05为差异显著。
2 结果
2.1 经茜素络合物浸泡后青鱼生存与生长状况
在浸泡标记和恢复续养过程中,标记组和对照组的摄食和游泳能力均表现正常。在浸泡标记期间,标记组和对照组均未出现死亡,成活率为100%。在恢复续养20 d过程中,标记组死亡2尾,对照组死亡0尾。因标记组鱼的死亡发生于非采样日,故死亡数对实验鱼的采样和相应的测定无影响。对标记组和对照组所采鱼样本间的全长和体质量进行单因素方差分析,结果显示在恢复养殖过程中除第10 天对照组与标记组全长存在显著性差异(P<0.05) 外,其他各标记组和对照组全长与体质量差异均不显著 (P>0.05, 图 2)。

图2 不同取样天数标记组和对照组青鱼幼鱼的体质量和全长变化 (N=5)*. 两组间差异显著 (P<0.05)。Figure 2 Change of body mass and total length of black carp of marking group and control group on different sampling day (N=5)*. Significant difference between two groups (P<0.05).
2.2 3类耳石的荧光标记效果
通过调节可见光和不同种类的激发光,对本实验中荧光标记的25尾鱼共150个耳石 (微耳石、矢耳石、星耳石各50个) 进行观察 (表1)。以浸泡标记后恢复续养第10天的青鱼幼鱼耳石为例 (图3),在矢耳石、微耳石和星耳石的边缘均呈现不同颜色的标记环,且标记环信号强度不同。在可见光和绿色激发光下,耳石上的荧光标记环呈深红色,但在可见光下观察到的颜色偏暗,在绿色激发光下观察到的偏亮,更易观察;在蓝色激发光和紫色激发光下,荧光标记环呈橘红色;不同的是,在蓝色激发光下,耳石未被标记的部分呈绿色,在紫色激发光下,则呈蓝色。恢复续养20 d后 (表1),在蓝色激发光下观测到总的标记强度>3,在绿色激发光和可见光下观测到的标记强度<3,其中绿色激发光略优于可见光,在紫色激发光下观测到的标记强度<2。对比在可见光和不同激发光下3种不同类型耳石的荧光标记环效果,显示由于耳石的形状、生长特性和取样难易程度不同,其标记效果也存在差异。在4种不同的光源下,微耳石上可观测到的荧光信号强度>3,矢耳石上可观测到的荧光信号强度>2,而星耳石的荧光信号强度则<2;但在可见光下,星耳石的荧光检测效果强度则要优于另两种耳石,最接近3。因此,对于青鱼耳石荧光标记效果的检测光源,蓝色激发光最适宜,其后依次为绿色激发光、可见光和紫色激发光。在最适激发光即蓝色激发光下,微耳石为最佳检测耳石类型,但在可见光下用于标记最佳检测的类型则是星耳石。
2.3 不同恢复续养天数下3类耳石在可见光和不同激发光下的荧光信号强度
随着恢复续养天数的增加,经过茜素络合物浸泡的青鱼幼鱼不同耳石荧光标记环强度在可见光和不同激发光下有不同变化 (表1)。从浸泡标记结束当日,即第0天开始取样时经过48 h浸泡的青鱼幼鱼矢耳石、微耳石、星耳石均已能检测到标记环,尤其是在微耳石上观察到的荧光信号更为强烈。当把浸泡标记过的鱼移到正常水体恢复续养后,在此过程中耳石的日轮继续正常生长,荧光信号标记轮完全形成,此时荧光标记环不止与浸泡标记前的日轮颜色形成对比,还和浸泡标记后新形成的日轮颜色形成对比,荧光信号强度极易辨认及区分。随着恢复续养天数的增加,矢耳石和星耳石的荧光标记环强度均有略微下降的趋势,但在蓝色激发光和绿色激发光下直到第20天时依然能够在上面观察到明显的橘红色和深红色的标记环。微耳石则不管是在可见光还是在不同激发光下均保持较好的标记效果,特别是在蓝色激发光下,从开始形成荧光标记环到第20天取样结束的过程中,荧光标记环的强度逐步增加并保持不变 (图4)。总体上在最佳检测光源即蓝色激发光下,微耳石上的荧光标记信号在20 d的恢复过程中表现出较好的标记效果,且能稳定保持。

图4 青鱼幼鱼经茜素络合物浸泡标记后恢复续养第0、第5、第10、第15和第20天时微耳石在蓝色激发光的标记效果Figure 4 Marking effect of lapillus of juvenile black carp under blue light source on 0th, 5th, 10th, 15th,20th day of recovery culture after ALC immersion

表1 青鱼幼鱼3类耳石在不同光源下的检测效果Table 1 Detection effect of three types of otoliths from juvenile black carp under four different light sources
2.4 茜素络合物在青鱼幼鱼耳石上沉积的时间差
以浸泡标记后恢复续养第5天的青鱼幼鱼微耳石为例 (图5),经打磨、酸蚀后耳石日轮颜色加深,能明显观察到紫红色的荧光标记环。由于鱼体日龄较大,因此以观察到的耳石荧光标记环外部日轮数倒推茜素络合物在青鱼耳石上沉积的时间差。鱼体在第一日轮形成之后,1日龄即对应1日轮,因此在恢复续养第5天进行取样时,鱼体应比浸泡标记完成当日多生长出5日轮,但在实际的日轮观察中,于自然光下可以看到共有2个紫红色标记环的日轮,在紫红色的标记环外,耳石新生长出4个日轮且无标记颜色,即鱼体在在浸泡标记的第2天茜素络合物开始在鱼体的耳石上沉积,进入恢复续养的第1天荧光标记染料仍在其上沉积,因此将鱼体放入茜素络合物溶液中与其在耳石上的沉积及将鱼体移出茜素络合物溶液与其在耳石上标记颜色的消失均存在约 1日轮 (即 1 d) 的时滞。

图5 青鱼幼鱼经茜素络合物浸泡标记后恢复续养第5天时微耳石标记效果2个白色箭头分别指向微耳石的2条紫红色标记环;黑色短线表示微耳石新形成的日轮所在位置,即为一明带和一暗带组合;4个黑色箭头则分别指向微耳石外部新形成的4个日轮。Figure 5 Marking effect of lapillus of juvenile black carp under four light sources on 5th day of recovery culture after ALC immersionTwo white arrows point to two purple red marker rings in lapillus; the black dash shows the position of the newly formed daily growth increments in lapillus, which is a combination of a bright band and a dark band; the four black arrows point outward to the four newly formed daily growth increments in lapillus.
3 讨论
3.1 3类耳石荧光标记的差异性
本研究中用可见光和3种不同激发光对耳石进行观察,发现3类耳石的荧光标记效果差异主要取决于青鱼耳石自身的特性及在取样过程中的难易程度。由于普通光源对3类耳石的穿透能力不同[17],而激发光具有超强的穿透力,星耳石被标记的部分荧光标记环依稀可见,但因其较薄,在可见光下可看到一个深红色的标记环;矢耳石的形状为箭矢型,在生长过程中其核心周围部分变厚、两端向前延伸变薄,耳石两端尖细的部分在前处理过程中易受外力破坏,造成标记环丢失,因此荧光标记环仅能在局部观察到,标记效果较差 (图3-a1);对于微耳石,整个耳石为椭圆形,不仅有一个规则的外形,且具有一个明显且规则的核心,耳石较厚,在取样过程中不易受外力影响,耳石日轮较有规律地围绕核心排列生长,在不同激发光下均能在耳石边缘观察到一个完整的荧光标记环,因此微耳石的荧光检测效果最佳。但由于耳石较厚,在可见光下的标记环较难观察到,考虑到对日轮进行观察时需要计数,要求轮纹的排列整齐有序,此时矢耳石和星耳石就变得不可选择,可对微耳石打磨后观察标记效果。因此,进行标记效果检测且需同时观察日轮时,可优先考虑用微耳石。而邱晨等[25]观察鲫(Carassius auratus) 幼鱼的荧光标记发现,在激发光下对星耳石荧光标记观测效果优于微耳石和星耳石,而在可见光下微耳石的标记效果则优于另两种,这可能是由于不同种类的鱼体耳石存在形成差异所致。
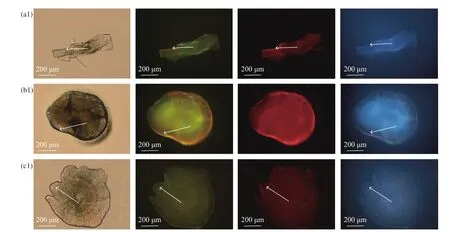
图3 经茜素络合物标记后恢复续养第10天时青鱼幼鱼矢耳石、微耳石、星耳石分别在可见光、蓝色激发光、绿色激发光和紫色激发光下的标记效果a1. 矢耳石分别在可见光、蓝色激发光、绿色激发光和紫色激发光下的标记效果;b1. 微耳石分别在可见光、蓝色激发光、绿色激发光和紫色激发光下的标记效果;c1. 星耳石分别在可见光、蓝色激发光、绿色激发光和紫色激发光下的标记效果;图中白色箭头表示由矢耳石、微耳石、星耳石核心指向荧光标记轮。Figure 3 Marking effect of three types of otoliths of juvenile black carp under different light sources on 10th day of recovery culture after ALC immersiona1. Marking effect of sagitta under visible light, blue excitation light, green excitation light and purple excitation light; b1. Marking effect of lapillus under visible light, blue excitation light, green excitation light and purple excitation light; c1. Marking effect of asteriscus under visible light,blue excitation light, green excitation light and purple excitation light. The white arrows show that the core of sagitta,lapillus and asteriscus point to the fluorescent marker ring.
3.2 影响青鱼耳石荧光标记效果的因素
荧光标记效果受到浸泡标记浓度和时间的制约。一般标记浓度越高,浸泡时间越长,荧光标记产生的效果越好[24]。但在实践中应考虑经济成本且高浓度溶液长时间浸泡可能会对鱼体的生理活动产生一定影响,因此需选择适当的浸泡浓度和浸泡时间。赵亚鹏等[26]用不同浓度的茜素络合物溶液标记滇池金线鲃 (Sinocyclocheilus grahami),结果显示溶液质量浓度达到150 mg·L−1时仔鱼已经开始死亡,大于 200 mg·L−1时 90日龄稚鱼全部死亡。刘清等[27]在进行鳙 (Aristichthys nobilis) 耳石茜素络合物标记时也发现,相较于24 h的标记时间,48 h的鲜艳程度和标记效果更好,因此对于仔幼鱼来说质量浓度应尽量小于 150 mg·L−1,且以48 h的浸泡时长较适宜。此外,在相同的浸泡时间下,随着茜素络合物浓度增加,耳石上标记信号强度增大,实验鱼死亡率也升高;同时在相同的浸泡浓度下,随着时间的增加,耳石上标记信号强度增大,实验鱼死亡率也升高[18]。值得注意的是,相较于淡水鱼类,海洋鱼类可能会有所不同,Becker等[7]对日本白姑鱼 (Argyrosomus japonicus) 用不同的浸泡时间 (6、12和 24 h) 和不同浸泡质量浓度(0、100、150和 200 mg·L−1) 结合来标记,在最长浸泡时间 (24 h) 与最大质量浓度 (200 mg·L−1) 组合下标记效果最好,且未出现死亡。因此,在浸泡标记鱼体过程中,对于不同鱼类,要想在不影响鱼体正常生命活动的前提下达到理想的标记效果,对浸泡浓度和浸泡时间的研究则非常必要。
荧光标记效果除了与标记条件 (如浓度、时间等) 密切相关外,还与标记鱼的生活史及发育阶段关系密切。Unfer和Pinter[9]用茜素红标记褐鳟(Salmo trutta) 的胚胎耳石,不仅死亡率低、标记成功率高,而且也降低了成本。靳建波等[28]对秦岭细鳞鲑 (Brachymystax lenok tsinlingensis) 的发眼卵和仔稚鱼进行茜素络合物标记,也发现发眼卵需要的标记浓度更低,但标记效果却更好。考虑到不同规格的鱼种对茜素络合物耐受限度不同,王正鲲等[17]用不同规格唐鱼 (Tanichthys albonubes) 进行茜素络合物浸泡,发现最适浓度不尽相同,其仔稚鱼、幼鱼和成鱼的最适质量浓度分别为80、100和 150 mg·L−1。徐永江等[18]用茜素络合物对半滑舌鳎 (Cynoglossus semilaevis) 进行标记,发现 70 d鱼苗的标记效果要优于170 d的鱼苗。Cottingham等[16]用茜素络合物对布氏棘鲷 (Acanthopagrus butcheri) 幼鱼进行标记,其耳石上的标记效果能保持16年之久。因此荧光标记一般对早期生活史阶段的个体效果更好。本实验中,由于鱼体已达幼鱼阶段,直接以较为保守的 100 mg·L−1进行 48 h 浸泡探索,在鱼体的3类耳石上均能够检测到标记,获得了不错的标记效果。
3.3 茜素络合物在青鱼幼鱼耳石上沉积时间差的影响因素
激发光的光源具有衍射性,故对鱼体耳石进行日轮观察时应在可见光下进行。经茜素络合物浸泡标记后的耳石日轮在可见光下呈紫红色,但随着鱼体的生长,耳石日轮逐渐密集,即使在可见光下对日轮数目的观察也需经过一些特殊处理,以便于对耳石日轮数目进行计算。迄今,就鱼体标记的时滞问题报道较少,朱亚华等[29]研究了经茜素络合物浸泡的草鱼 (Ctenopharyngoclon idellus) 耳石时滞,发现鱼体开始浸泡和转移出标记溶液与标记环的出现和消失存在约12 h时滞;邱晨等[22]对经茜素络合物标记的鲤仔鱼标记环进行观察,发现耳石上荧光信号出现和消失的时间与鱼体浸泡开始和结束的时间存在1 d时滞,但用锶 (Sr) 溶液对鲤仔鱼进行标记时发现,在浸泡后第3天耳石上才开始出现Sr标记,在浸泡结束后第6天Sr标记区才完全消失[30];本实验的结果与之相似。由此可见,元素在鱼体耳石上沉积的时间差不仅与被标记的种类有关,更与标记的物质相关。这可能与鱼类对不同化学物质的代谢速率有关[31]。
4 结论
本研究表明,使用茜素络合物对青鱼幼鱼进行浸泡,其3类耳石在可见光和不同激发光下均可见明显的标记环,标记率达100%。最佳观察光源为蓝色激发光,其次是绿色激发光。标记观察的最适耳石类型为微耳石。在长达20 d的恢复续养过程中,荧光标记环信号强度保持稳定。从用茜素络合物溶液开始浸泡鱼体至其在耳石上产生沉积和将鱼移出溶液至标记在耳石上消失均存在约1 d的时滞。用茜素络合物化学标记青鱼幼鱼的方法有效且适用,这对于区分人工放流和野生种群,把握增殖放流青鱼对自然资源量恢复的贡献作用等研究有一定的参考价值。

