水温、光周期和光照强度对塔里木裂腹鱼幼鱼存活、摄食和生长的影响及其盐碱耐受能力研究
赵年桦,赵 贺,强 壮,聂竹兰,魏 杰, ,沈建忠
(1. 塔里木大学动物科学学院,新疆维吾尔自治区 阿拉尔 843300; 2. 新疆生产建设兵团塔里木畜牧科技重点实验室,新疆维吾尔自治区 阿拉尔 843300; 3. 塔里木珍稀鱼类研究中心,新疆维吾尔自治区 阿拉尔 843300; 4. 塔里木大学生命科学学院,新疆维吾尔自治区 阿拉尔 843300; 5. 华中农业大学水产学院,湖北 武汉 430070)
我国拥有约0.46亿hm2的低洼盐碱水域资源,广泛分布在东北、华北和西北内陆地区,但这些盐碱水域资源中生物种类单一、生态环境脆弱,因此大部分长期处于荒废状态[1]。自1991年以来,我国开始在河北、山东、江苏等地进行盐碱水养殖[2],但目前尚缺乏针对不同盐碱水域特点的主导养殖技术,存在养殖品种单一的问题[3]。裂腹鱼亚科主要分布在我国的青藏高原及其周边水域[4-5],近几年由于受外界因素干扰,其数量急剧下降,大规模人工繁育成为保护裂腹鱼的首要任务。
人工繁育过程中环境因子对幼鱼的代谢、存活、摄食和生长起着重要作用,其中水温、光周期和光照强度的影响尤为重要[6]。鱼类是变温动物,体温随着水温而变化,水温可以通过影响鱼体体温从而改变其消化酶活性,进而对鱼类的摄食率、食物消化率和生长率产生重大影响[7]。鱼类的摄食率和生长率随水温的升高而增加,但当水温高于临界值时却会随水温的升高而下降[8]。鱼类在整个生命周期中均受光照影响,光周期和光照强度对鱼类摄食和生长有重要影响,光照过强或过弱和不适宜的光周期均会对鱼类的活动、生长和发育产生不利影响[9]。
塔里木裂腹鱼 (Schizothorax biddulphi)属鲤形目、鲤科、裂腹鱼亚科、裂腹鱼属,为国家二级保护鱼种,仅分布于新疆塔里木水系[10]。近年来,塔里木裂腹鱼繁殖生物学和生态学相关研究逐渐被重视[11-14],但环境因子对其存活、摄食和生长的影响及其盐碱耐受能力的研究尚未见报道。本文研究了水温、光周期和光照强度对塔里木裂腹鱼幼鱼存活、摄食和生长的影响,以及塔里木裂腹鱼幼鱼对氯化钠 (NaCl) 盐度、碳酸氢钠 (NaHCO3) 碱度和盐碱交互的耐受性,以期为塔里木裂腹鱼种群保护和养殖生产提供理论依据。
1 材料与方法
1.1 材料
实验用塔里木裂腹鱼幼鱼采自新疆维吾尔自治区卡拉贝利鱼类增殖放流站,初始体长为 (47.26±0.89) mm,体质量为 (1.25±0.31) g。实验容器为透明有盖玻璃水缸 (60 cm×35 cm×45 cm),实验期间统一使用HZ-060型充气增氧机供氧。实验饲料为四川斯特佳饲料有限公司生产的浮性配合饲料838,每天投喂3次 (09:30、13:30、19:30),按体质量3.0%~5.0%饱食投喂。投饵前吸出粪便,投饵30 min后吸出残饵,烘干称质量,调整投喂量。每天换水1次,每次换水1/3,换水前后温差控制在0.5 ℃以内。实验用水为经过循环系统过滤的卡拉贝利地下水,水温 (16.5±0.5) ℃,pH 8.45~8.56,溶解氧质量浓度 3.5~3.7 mg·L−1,盐度 1.7~1.9,氨氮质量浓度<0.1 mg·L−1。
1.2 水温实验设计
1.3 光周期实验设计
实验设 5 个光照周期组 (0 L∶24 D、8 L∶16 D、12 L∶12 D、16 L∶8 D 和 24 L∶0 D),每组 3个平行,每组30尾幼鱼,共15个玻璃水缸,每个实验组分别放在独立密闭遮光的实验桶 (直径为2 m、深度为 1 m) 中进行,每组采用 1个 36 W 日光灯进行照明,玻璃缸遮光材料选用黑色塑料布,实验周期为 45 d。
1.4 光照强度实验设计
实验设 5个光照强度组 (2 000、1 000、500、100、10 lx),每组3个平行,每组30尾幼鱼,共15个玻璃水缸,均匀排成5列,4个36 W日光灯灯光从第一列玻璃缸壁外上方射入,移动各列玻璃缸间距,使光强在玻璃缸中形成10~2 000 lx的光照梯度,光照周期为自然光周期 (12 L∶12 D),实验周期为 45 d。
1.5 多因素调控实验设计
采用三因素 (水温、光周期、光照强度) 四水平 (成活率、摄食率、体长增长率、特定生长率)的Box-Benhnken实验设计,因子水平分别编码为−1、0、1,共17个实验点,每个实验点重复3次,每个实验点30尾幼鱼,实验周期为45 d。
1.6 盐碱耐受实验设计
采用单因子静态急性毒性实验法[15]进行盐碱耐受实验,实验用鱼先参照多因素实验结果筛选出的模型优化因素条件进行饲养,饲养周期为45 d。饲养周期结束后,挑选体质活跃、无伤无病的幼鱼进行盐碱耐受能力研究并进行预实验,获得幼鱼24 h全部死亡盐度、碱度最低浓度和96 h全部成活盐度、碱度最高浓度。设置7个盐度梯度 (2.5、3.0、3.5、4.0、4.5、5.0、5.5)和7个碱度浓度梯度 (65、75、85、95、105、115、125 mmol·L−1),每个浓度梯度设置3个平行组和1个对照组,每组20尾幼鱼。为保证实验过程中溶液浓度的稳定性和水质清澈,所有浓度梯度24 h更换10%水量,不投饵,实验分别使用盐度计和酸度计测定及校准盐度和碱度。实验进行96 h,连续观察记录前12 h鱼在实验中的表现情况并记录24、48、72、96 h的死亡数,及时捞出死亡 (不能游动和鳃盖未能煽动) 个体。
1.7 数据处理
实验开始前和实验结束后停食1 d,分别测量各组实验鱼的体长、体质量,计算成活率 (Survival rate, SR, %)、摄食率 (Feeding ratio, FR, %)、体长增长率 (Length growth rate, LR, %)、特定生长率 (Specific growth rate, SGR, %·d−1) 等指标:
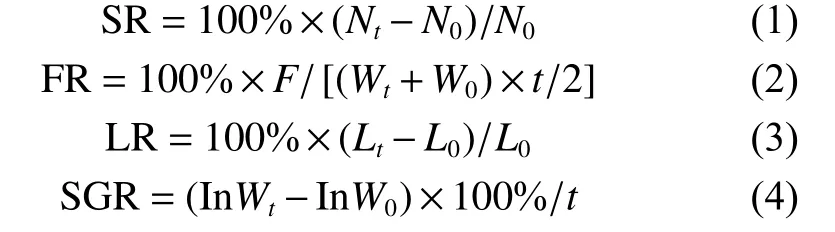
式中:N0为实验开始时鱼的尾数;Nt为实验结束时鱼的尾数;F为饲料摄入量 (g);t为养殖天数 (d);W0为实验开始时鱼体质量 (g);Wt为实验结束时鱼体质量 (g);L0为实验开始时鱼体长 (mm);Lt为实验结束时鱼体长 (mm)。
心理健康课程并不仅仅是把基本的理论知识传递给学生,更是要让学生通过多样化的课程方法做好心理调节。因此,在进行课程安排时,也要按照这两部分来展开。首先,在理论知识普及部分,教师要利用多样化的授课方式让学生融入心理课程中。其次,通过理论知识学习后,教师要让学生进行有效的运用。例如,某校为了充分让学生掌握心理健康课程,发挥心理健康的作用,开展了“我是心理医生”的角色扮演活动,通过让学生对有心理问题的案例进行分析与“治疗”,利于增强学生的学习自信心,并培养其良好的心理素养。
盐碱耐受单一因素实验结果采用改良寇氏法[16],分析计算半致死浓度 (LC50) 及95%置信区间:
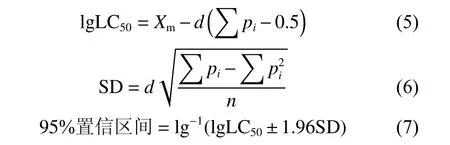
式中:Xm为最高浓度对数;d为浓度对数差;pi为死亡率;n为实验动物数;SD为标准差。
安全浓度 (Safe concentration, SC, %) 采用鱼类急性毒性实验经验公式[17]估算:

实验数据采用 Excel 2020和 SPSS 26.0软件进行处理和分析,通过Origin 2019软件绘图,多因素调控实验采用 Design Expert 12进行设计。
2 结果
2.1 水温、光周期和光照强度对塔里木裂腹鱼幼鱼存活、摄食和生长的影响
在为期 45 d 的生长实验中 (表 1),0 L∶24 D实验组幼鱼在实验开始后10 d内全部死亡,故未统计其最终体长与体质量。结果 (图1-a) 显示,塔里木裂腹鱼幼鱼适应水温范围较大,水温为5~25 ℃时幼鱼成活率均在85%以上,但水温超过25 ℃时其成活率显著下降,30 ℃时成活率为46.7%;幼鱼在水温5~20 ℃中摄食率随着水温上升而提高,水温20 ℃时达到最高 (1.96%),在水温25~30 ℃中摄食率随水温上升而下降 (最低为0.53%);体长和特定生长率与幼鱼摄食率变化趋势相同,20 ℃ 时达到最高 (22.34% 和 1.58%∙d−1),30 ℃ 时较低 (5.56% 和 0.23%∙d−1)。
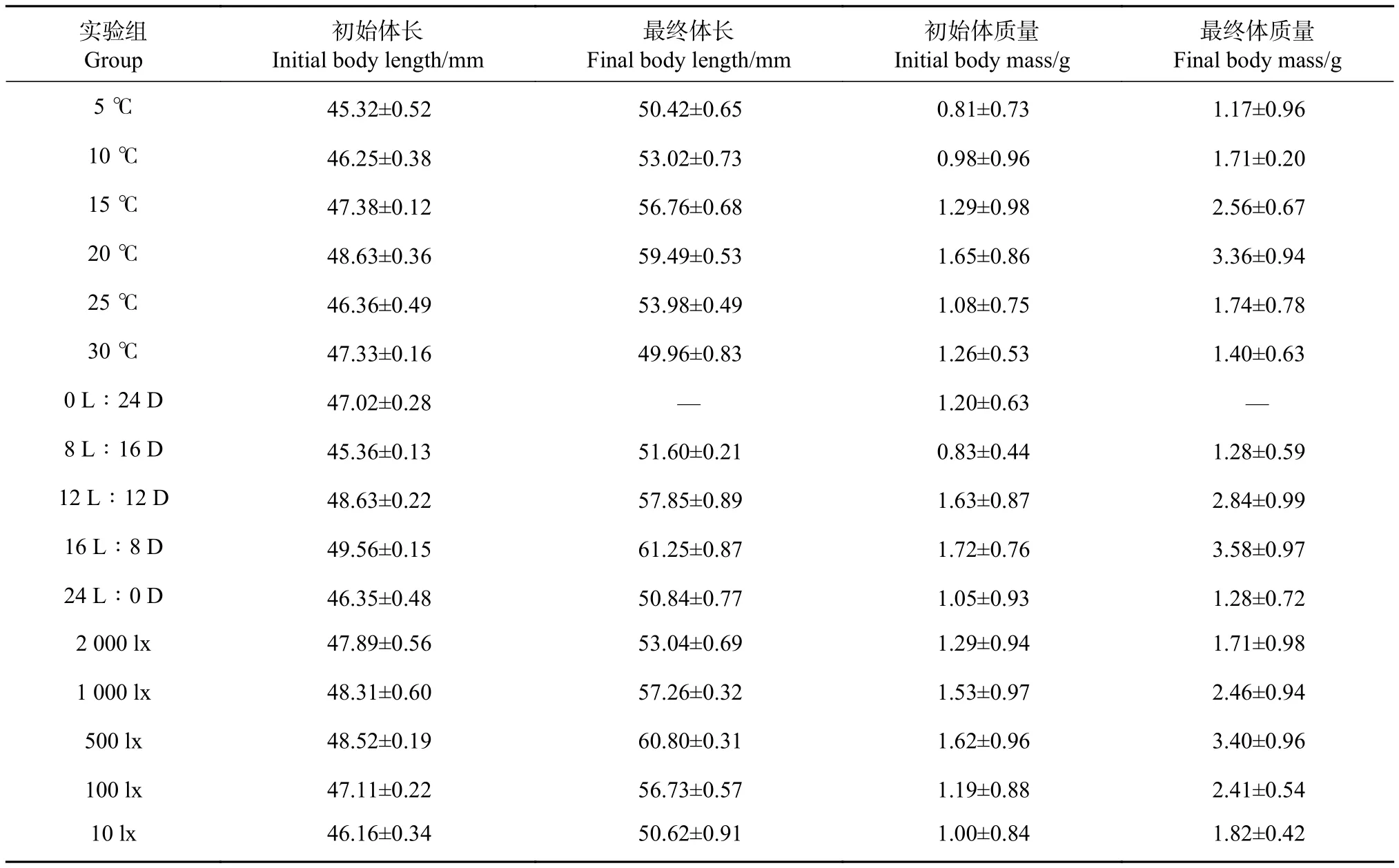
表1 各实验组塔里木裂腹鱼幼鱼的初始和最终体长及体质量Table 1 Initial and final body length and body mass of S. biddulphi juveniles in different groupsN=1 440
全黑 (0 L∶24 D) 实验组的幼鱼在 10 d 内全部死亡。幼鱼成活率、摄食率、体长增长率和特定生长率随着光照时间的延长而增加,每天光照时间为16 h时各水平达到最高,但每天光照时间为24 h时,成活率、摄食率、体长增长率和特定生长率均下降 (图 1-b)。
本实验结果显示,塔里木裂腹鱼幼鱼适应光照强度范围较大 (图 1-c)。光照强度为 10~2 000 lx 时幼鱼成活率均在80%以上。光照强度较大时幼鱼进食活动减少,光照强度为500 lx时幼鱼摄食率达到最高 (1.89%);光照强度小于500 lx时摄食率随着光照强度降低而减少,其体长增长率和特定生长率与摄食率变化趋势一致,均在500 lx时达到最高(25.31% 和 1.65%∙d−1)。
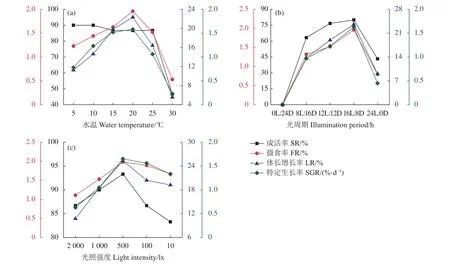
图1 水温、光周期和光照强度对塔里木裂腹鱼幼鱼成活率、摄食率、体长增长率和特定生长率影响Figure 1 Effects of water temperature, photoperiod and light intensity on survival rate, feeding rate,length growth rate, specific growth rate of S. biddulphi juveniles
2.2 多因素调控实验
选择水温 (Water temperature, WT)、光照时间(Illumination time, IT, h) 和光照强度 (Light intensity,LI) 为复合调控因素进行响应面实验分析 (表2)。根据实验结果建立塔里木裂腹鱼幼鱼SR、FR、LR 和 SGR 与水温 (A)、光照时间 (B) 和光照强度(C) 因素之间的多元线性回归方程:
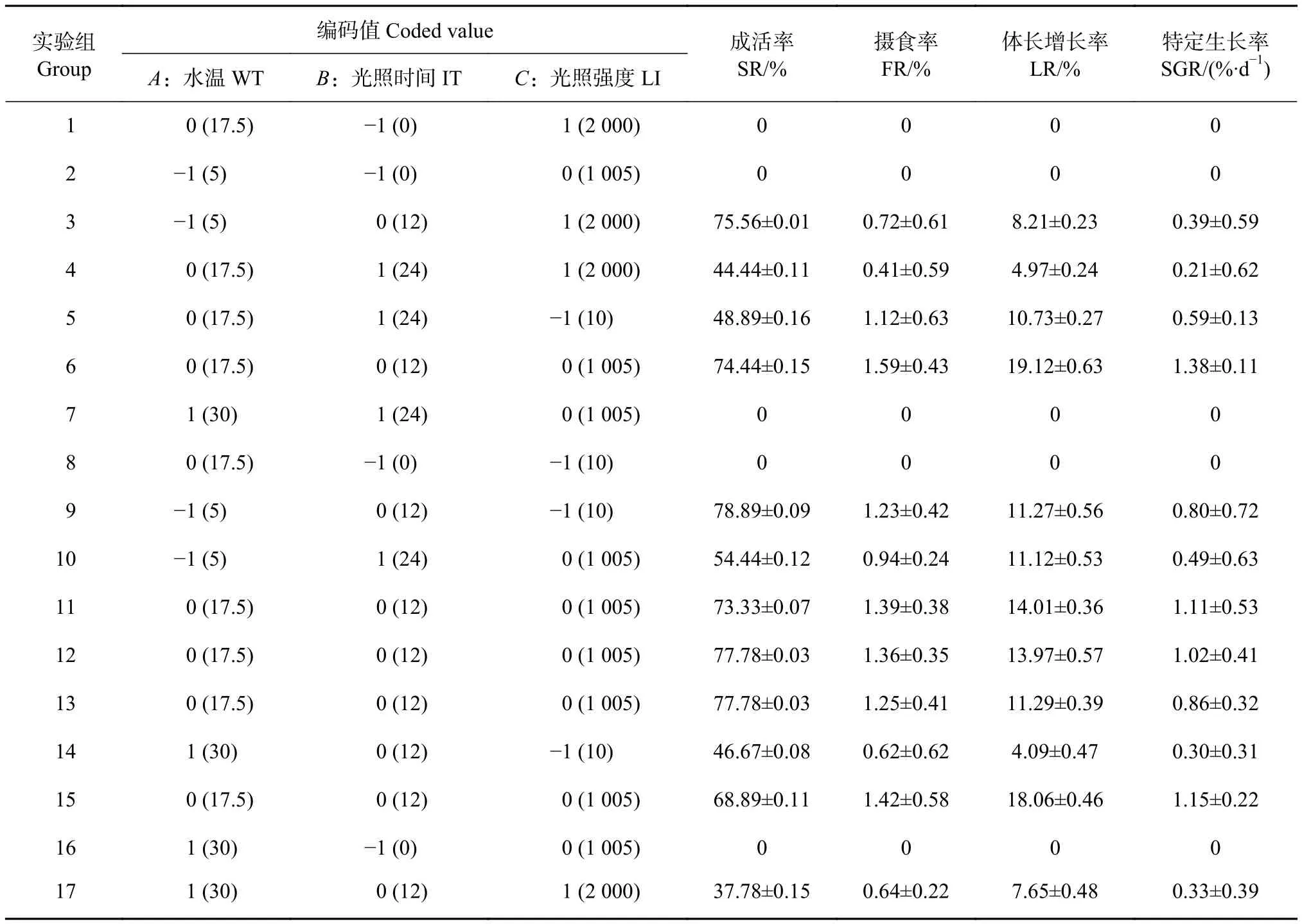
表2 响应面实验方案及结果Table 2 Response surface design and results

4组回归模型的决定系数R2均大于0.90,表明实验误差较小;四组模拟失效项P分别为0.07、0.40、0.83、0.95,均大于0.05,说明模型有效,可以很好地分析和预测3种环境因子对塔里木裂腹鱼存活、摄食和生长的影响[18]。
由表 3可见,一次项水温 (A)、光照时间 (B) 对SR、FR、LR、SGR影响均显著 (P<0.05),一次项(C) 仅对FR影响显著;交互项AB对SR、FR影响显著 (P<0.05),AC、BC对 FR 影响显著 (P<0.05);二次项A2、B2对SR、FR、LR、SGR影响均极显著(P<0.01),C2对 FR、LR、SGR 影响显著 (P<0.05)。
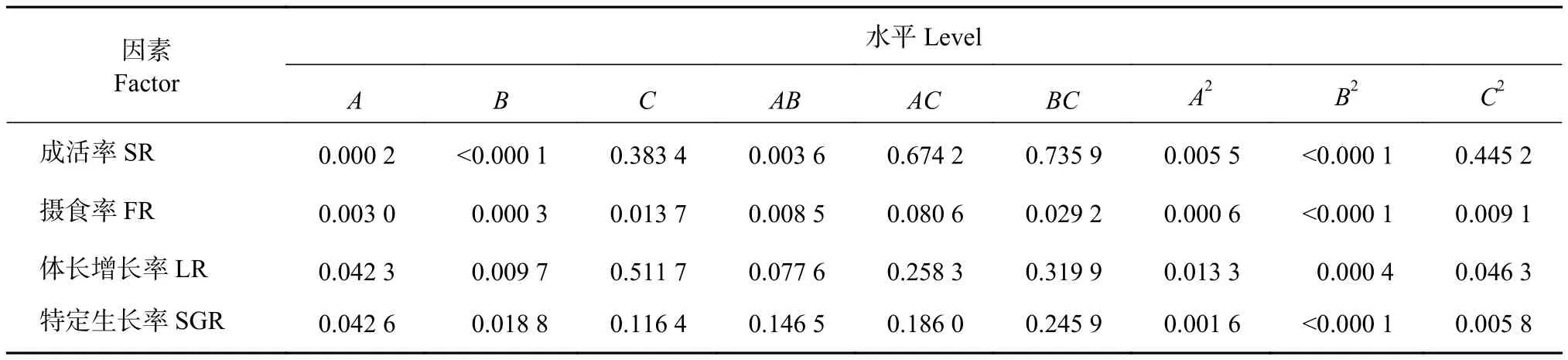
表3 各因素及其交互作用对塔里木裂腹鱼幼鱼成活率、摄食率、体长增长率和特定生长率的显著性检验Table 3 Significance test of factors and their interactions on survival rate, feeding rate, length growth rate and specific growth rate of S. biddulphi juveniles
水温、光照时间和光照强度对SR、FR、LR、SGR调控的响应面分析结果 (图2) 显示,水温和光照时间、水温和光照强度、光照时间和光照强度对响应值的交互作用均呈现开口向下的山丘状,于底面投影等高线呈椭圆形,因此各环境因子之间的交互作用均对塔里木裂腹鱼存活、摄食、生长影响显著。本实验响应模型优化结果显示,水温12.98 ℃、每天光照时间15.07 h、光照强度670.27 lx时可获得塔里木裂腹鱼的最佳存活、摄食和生长条件,此时理论成活率为81.61%,理论摄食率为1.53%,理论体长增长率为16.34%,理论特定生长率为1.13%∙d−1。经验证,最佳环境条件下塔里木裂腹鱼成活率为82.22%,摄食率为1.49%,体长增长率为16.21%,特定生长率为1.07%∙d−1,该结果与理论值基本相符,说明响应模型可有效预测塔里木裂腹鱼的存活、摄食和生长状况。

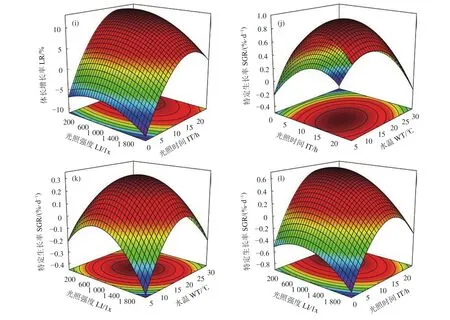
图2 水温、光照时间和光照强度对塔里木裂腹鱼幼鱼成活率、摄食率、体长增长率和特定生长率的响应面a. 水温和光照时间对成活率的影响;b. 水温和光照强度对成活率的影响;c. 光照时间和光照强度对成活率的影响;d. 水温和光照时间对摄食率的影响;e. 水温和光照强度对摄食率的影响;f. 光照时间和光照强度对摄食率的影响;g. 水温和光照时间对体长增长率的影响;h. 水温和光照强度对体长增长率的影响;i. 光照时间和光照强度对体长增长率的影响;j. 水温和光照时间对特定生长率的影响;k. 水温和光照强度对特定生长率的影响;l. 光照时间和光照强度对特定生长率的影响。Figure 2 Response surface and contour plot of effects of water temperature, illumination time and light intensity on survival rate,feeding rate, length growth rate, specific growth rate of S.biddulphi juvenilesa. Influence of WT and IT on SR; b. Influence of WT and LI on SR; c. Influence of IT and LI on SR; d. Influence of WT and IT on FR; e. Influence of WT and LI on FR; f. Influence of IT and LI on FR; g. Influence of WT and IT on LR; h. Influence of WT and LI on LR; i. Influence of IT and LI on LR; j. Influence of WT and IT on SGR; k. Influence of WT and LI on SGR; l. Influence of IT and LI on SGR.
2.3 盐碱耐受能力
塔里木裂腹鱼幼鱼在不同盐度下的累计死亡率见表4。实验过程中,对照组中幼鱼的行为始终正常,无死亡个体,水质清澈无杂质。在不同盐度耐受性实验组中,幼鱼反应强烈,鳃盖活动频率加快。幼鱼开始死亡的时间为第10小时 (盐度为4.0),死亡时幼鱼停止游动,体表无光泽 (图3-a)。

表4 不同盐度条件下塔里木裂腹鱼幼鱼的死亡率Table 4 Lathal rate of S. biddulphi juveniles at different salinitiesN=560
塔里木裂腹鱼幼鱼的死亡率随着时间延长、碱度增加而增大 (表5)。实验过程中,对照组中幼鱼未出现死亡,水质始终保持清澈。幼鱼在12 h碱度 85 mmol·L−1时未出现死亡,碱度为 105 mmol·L−1时死亡率达46.67%,第72小时全部死亡。死亡个体眼睛充血,腹部充满腹水 (图3-b)。

图3 塔里木裂腹鱼幼鱼盐中毒 (a) 和碱中毒 (b)Figure 3 Salt poisoning (a) and alkali poisoning (b) of S. biddulphi juveniles
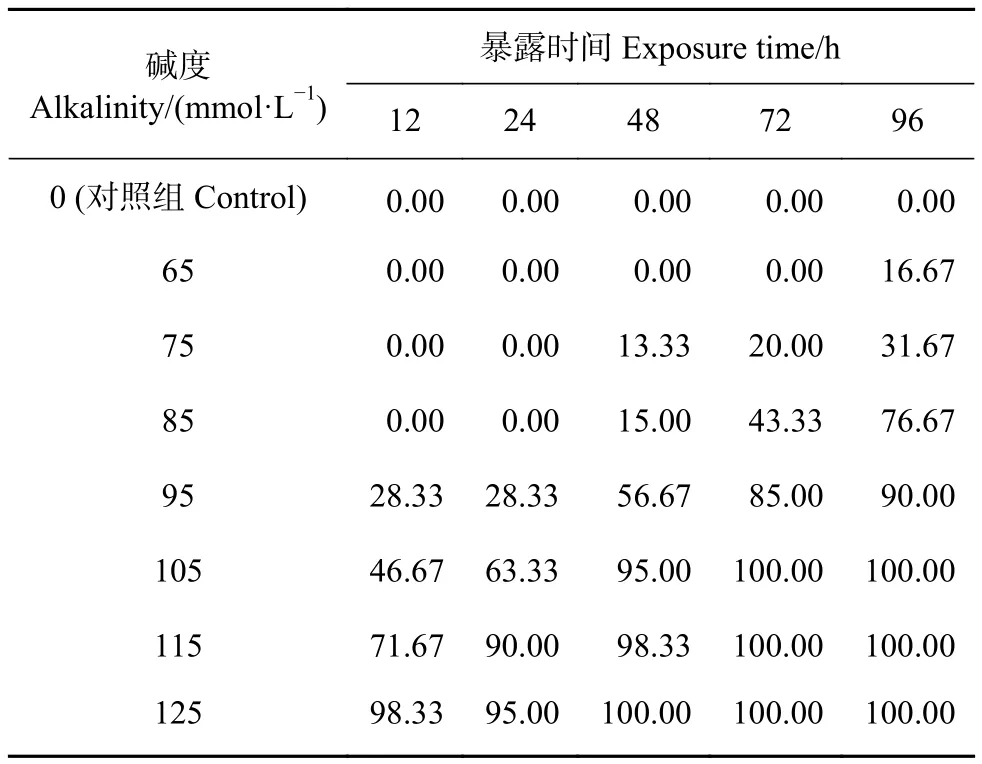
表5 不同碱度条件下塔里木裂腹鱼幼鱼的死亡率Table 5 Lathal rate of S. biddulphi juveniles at different alkalinitiesN=560
塔里木裂腹鱼幼鱼24、48、72和96 h盐度LC50分别为 4.01、3.62、3.29和 2.92 g·L−1,SC为 0.89 g·L−1;24、48、72和 96 h 碱度 LC50为 97.14、86.75、80.26和 74.52 mmol·L−1,SC为20.75 mmol·L−1(表 6)。

表6 塔里木裂腹鱼幼鱼的急性盐度和碱度半致死浓度Table 6 Acute LC50 of S. biddulphi juveniles at different salinities and alkalinities
3 讨论
在养殖过程中,幼鱼对环境因子的变化非常敏感[19]。其中水温是一个重要的环境因子,它可以通过改变幼鱼体内酶的活性,调节代谢过程中的能量收支,直接影响幼鱼的发育和存活[20]。本实验中,水温低于25 ℃时各组成活率差异不显著 (P>0.05);水温高于25 ℃时各组成活率急剧下降。这与曾本和等[21]异齿裂腹鱼 (S. oconnori) 的研究结果相似,可能是因为塔里木裂腹鱼和异齿裂腹鱼长期生活在高海拔地区,水温较低,鱼体为适应环境产生了耐低温的能力。
鱼类摄食率是决定其生长的重要因素之一[22]。本实验中,随着水温的升高,塔里木裂腹鱼幼鱼的摄食率呈现先升高后降低的变化趋势,其体长增长率和特定生长率与幼鱼摄食率变化一致,这与胡发文等[23]对大泷六线鱼 (Hexagrammos otakii),牟振波等[24]对细鳞鱼 (Brachymystax lenok) 的研究结果一致。本实验中,塔里木裂腹鱼幼鱼在水温20 ℃时摄食率达最高,与异齿裂腹鱼[21]、细鳞鱼[24]等冷水鱼相似。
光周期与昼夜更替信号,刺激生物体内节律调节系统和外界环境保持一致[25]。本实验中,光照时间对塔里木裂腹鱼的生长和存活有一定影响。幼鱼是视觉性摄食动物,依靠光照产生视觉反应而进行摄食[26],本研究中全黑实验组因无光照,幼鱼不能进行正常摄食,最终在10 d内全部死亡;幼鱼成活率、摄食率、体长增长率和特定生长率在8 L∶16 D、12 L∶12 D、16 L∶8 D 和 24 L∶0 D 组之间均差异显著 (P<0.05),这与对克氏双锯鱼 (Amphiprion clarkii)[27]、海葵双锯鱼 (A. percula)[28]的研究结果存在差异,可能是因为塔里木裂腹鱼生活在青藏高原上,海拔高、光照时间长,其幼鱼适应了长光照环境。
本研究中,光照强度达到500 lx时塔里木裂腹鱼幼鱼成活率、摄食率、体长增长率和特定生长率均最大,而光照强度低于500 lx时,其成活率、摄食率和生长率开始下降,反映光照强度对其存活、摄食和生长具有重要影响。笔者在克孜勒河进行为期2个月的野外捕捞,发现塔里木裂腹鱼幼鱼喜在太阳初升或黄昏时段于浅水区域进行摄食,没有被惊扰时喜在阳光直射的中下水层聚集,这与本实验结果一致。尖齿胡鲶 (Clarias gariepiinus) 在 0 lx 时获得较快生长速度[29];豹纹鳃刺鲈 (Plectropomus leopardus) 幼鱼在 3 000 lx光照条件下存活和生长也可达到较好水平[30];克氏双锯鱼仔鱼发育则需要较弱光照强度 (100~1 000 lx)[27]。不同鱼类对光照需求不同,光照对鱼类生长的影响机制有待进一步研究。
多因素实验结果显示,塔里木裂腹鱼最佳存活、摄食、生长条件为水温12.98 ℃、每天光照时间15.07 h、光照强度670.27 lx,推断其幼鱼适宜在拥有低温水源、长光照时间的区域进行规模化养殖,中国青藏高原及中国东北地区可满足塔里木裂腹鱼的大规模苗种培育工作。
盐度可以通过影响鱼类体内渗透压来干扰鱼类的正常生理活动[31-32]。大部分鱼类可以通过鱼鳃上三磷酸腺苷酶 (ATP酶)为离子转运提供载体和驱动力,从而平衡渗透压,其中Na+/K-ATPase可将K+向胞内运输的同时向胞外排出Na+,使胞内Na+维持在一定水平[33-35]。本研究中,随着盐度的升高,4种裂腹鱼幼鱼的死亡率也随之升高,96 h后无幼鱼存活。裂腹鱼幼鱼从低渗环境转变到高渗环境中,鱼鳃的结构和生理机能会发生明显改变,鱼鳃上Na+/K-ATPase活性受到抑制,K+/Na+与外界交换受阻,从而造成细胞损伤和鱼类死亡[36-37]。
不同研究中的实验条件和鱼类规格有所差异,但简单地将不同淡水鱼类盐碱耐受能力进行比较后发现,塔里木裂腹鱼幼鱼耐盐碱能力较差,耐碱能力低于大鳞鲃 (Barbus capito)[41]、青海湖裸鲤(Gymnocypris przewalskii)[42],与黑龙江泥鳅 (Misgurnus mohoity)[43]、滩头雅罗鱼 (Tribolodon brandti)[44]耐碱能力相近;耐盐能力低于松浦镜鲤(Cyprinus carpio songpu)[41]、欧鲇 (Silurus glanis)[45]、黄鳝 (Monopterus albus)[46]等。推测可能是由于实验用鱼体型偏小,鱼体内盐碱缓冲体系尚未发育完善,导致其耐盐碱能力较差;另外,本实验用水为新疆南疆地区地下水,水质偏碱性且盐度较高,也可能造成所测幼鱼的盐碱耐受能力偏弱。

