盐沼入侵植物互花米草治理后植食性昆虫食物结构的变化
江佳佳,赵玉杰,赵佳媛,鞠瑞亭
(1. 复旦大学 生物多样性与生态工程教育部重点实验室,上海 200438; 2. 复旦大学长江河口湿地生态系统国家野外科学观测研究站,上海 200438)
鞠瑞亭,男,研究员,并列通信作者,E-mail: jurt@fudan.edu.cn
滨海盐沼是海岸带生态系统最重要的组成部分之一,在碳汇、养分循环、稳定海岸线、提供栖息地和维持生物多样性等方面有着重要作用[1-2].近年来,环境变化和人类活动的加剧导致全球范围内盐沼面积大幅度减少;特别是,由人为引种导致的外来植物入侵严重影响了盐沼的生物多样性和生态系统的结构与功能,导致盐沼生物资源再生和生态系统服务能力显著下降[3-4].治理入侵植物,恢复受损盐沼的生态系统服务功能,已成为海岸带自然资源管理及生态健康维持的重要途径.
清除入侵植物并恢复原生土著植物群落是恢复盐沼生物多样性及生态系统服务的重要手段[5].盐沼入侵植物清除后,本地植物群落会不断发展并营造出新的栖息地环境,作为盐沼中重要的消费者的植食性昆虫群落,其结构和生物生态学特征也会随之变化[6-7].尤其是,在食物资源的依赖性上,植食性昆虫因对植物营养和化学气味高度敏感,许多种类会因植物群落物种组成的变化而改变其食物利用途径[4,8];同时,昆虫群落的发生发展对非生物环境因素的变化也很敏感,不同植物群落营造的栖息地中,昆虫种类和生物学特征可能会有较大差异[6-7].因此,外来植物入侵及其治理后植物群落物种组成的变化,会强烈影响昆虫的群落组成和食物结构特征.以往研究中,有关昆虫物种组成对植物入侵及其治理的响应已有较多报道[9-10],但入侵植物治理前后昆虫食物结构的变化情况则较少受到关注[11].
近年来,稳定同位素技术已成为推断生态系统营养关系的重要工具,在研究生态变化及解决与生态系统保护和管理有关的应用问题方面发挥了重要的价值[12].以往研究表明,13C和12C的比值(即δ13C)在具有不同光合途径的初级生产者(如C3植物和C4植物)中显著不同,且几乎不随着营养级位置的转移而改变,因此可用作推断消费者究竟以哪种生产者作为碳源的依据[13].本研究以上海崇明东滩互花米草(Spartinaalterniflora)治理生态工程为案例,利用碳稳定同位素技术,探讨了盐沼植物入侵及其治理后植食性昆虫食物结构的变化情况.
互花米草原产北美,上世纪70年代被人为引入中国东部沿海进行种植,随后在全国范围内广泛入侵,截止2015年,其在中国的发生面积已超过540 km2[14].互花米草入侵显著改变了滨海湿地的生物多样性和生态系统过程,造成了极其严重的生态后果[3],因而被列入我国《首批16种外来入侵物种名录》和《国家重点管理外来物种名录》.长江口地区是我国互花米草入侵最严重的区域之一,该外来植物于1995年通过种子扩散从邻近的江苏沿海湿地传入崇明岛;2001年,为了推动保滩促淤,互花米草又被通过人工引种方式在崇明东滩湿地进行种植[3].互花米草引入长江口盐沼以来,给土著生态系统带来了多种负面影响,导致芦苇(Phragmitesaustralis)、海三棱藨草(Scirpusmariqueter)等土著植物被迅速替代,生物群落的结构发生显著改变,使长江口盐沼的生态系统服务明显下降[3].为有效控制互花米草在长江口湿地严重扩张的势头,恢复入侵受损湿地的生态系统,2012年以来,上海崇明东滩自然保护区实施了互花米草治理生态工程,通过“刈割、水淹和生态替代”等方式,清除了保护区内的互花米草并恢复了芦苇等土著植物群落.工程总面积达24.2 km2,该工程可能是目前全球范围内最大的盐沼入侵物种治理工程[15].本研究采用空间代替时间的方法,对入侵区、恢复区和原生对照区不同植物群落中的昆虫食物结构进行了比较分析,目的是为了探明盐沼外来植物入侵及其治理后植食性昆虫对生产者营养依赖性的变化情况,从而为互花米草治理生态工程的效益评估提供科学依据.
1 材料与方法
1.1 研究地点与调查样线
研究区位于上海市崇明岛长江口滨海盐沼湿地(31°27′~31°51′N,121°09′~121°54′ E)(图1).崇明岛年均降水量为1 022 mm,年均气温为15.3 ℃.月均最高和最低气温分别为7月的27.5 ℃和1月的2.9 ℃.崇明岛盐沼植物虽然有120余种[16],但主要优势植物包括土著植物芦苇和入侵植物互花米草,两种植物均为多年生草本植物,通过种子或克隆生长进行繁殖,在盐沼中常构成连片的单优植物群落或混生群落.
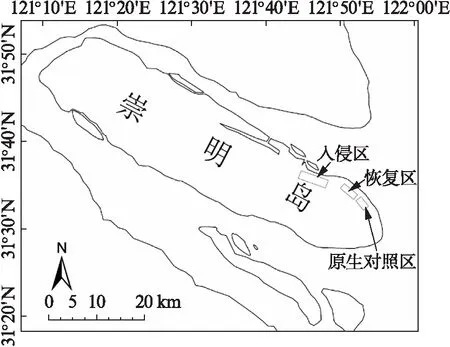
图1 本研究位于上海市崇明岛的采样地点Fig.1 Sampling location of the study site in Chongming Island of Shanghai 箭头指向处为采样地点.
本研究调查地点位于崇明东滩互花米草治理工程区及其毗邻区域(图1).工程区目前已完成互花米草清除并重新种植了土著植物芦苇,后者覆盖率已达80%以上(该区域被定义为“恢复区”).工程区南侧盐沼因有垂直海岸线方向上的堤坝为物理阻隔,因此未曾遭受过互花米草入侵,当前仍保留着长江口滩涂的原生演替状态(该区域被定义为“原生对照区”).工程区西北侧盐沼目前尚未开展互花米草治理,因此仍处于互花米草入侵威胁中,主要分布有芦苇和互花米草的单优植物群落及两者的混生群落(该区域被定义为“入侵区”).
为了完整地探究互花米草治理前后植食性昆虫对食物资源利用的变化动态,我们借助空间代替时间的方法[17-18],在研究区选择了5种植物群落采集昆虫样品: (1) 在恢复区选择互花米草清除后新植的芦苇群落(代表互花米草治理后恢复的土著植物群落);(2) 在入侵区选择芦苇群落(代表尚未被互花米草替代但处于入侵威胁中的土著植物群落)、互花米草群落(代表土著植物已被互花米草完全替代后的入侵植物群落)以及芦苇-互花米草混生群落(代表入侵植物正在替代土著植物的过渡性群落);(3) 在原生对照区选择原生演替的芦苇群落(代表从未受到入侵植物威胁的当地原生植物群落).在每种植物群落中,我们随机选取15条样线(共5×15=75条样线),每条样线长约16 m.为了尽可能减小短距离内昆虫迁移造成采样的误差,每2条相邻样线间,上一条样线尾端和下一条样线出发点相隔至少50 m,各样线出发点和终点均配有插旗作为标志.此外,为了减小调查样线在空间上的异质性,所有样线均位于与潮沟平行方向上的同一高程上.
1.2 样品采集及物种鉴定
我们以植株地上部分的咀嚼型和刺吸型昆虫为主要采集对象,利用机械真空抽吸法采集样品,分别于2018年6、7、8月各采样1次.在采样时,我们利用汽油型昆虫取样器(John W. Hock,美国)进行采集,机器采集端安装了直径为0.2 m的圆形漏斗,开动发动机使漏斗处形成较强的空气吸力,利用漏斗即可采吸样线内的昆虫.采样时,在每条样线中的行走速度为0.25 m/s,每采集8 s后对取样器中的样品进行一次处理,每条样线采集8次,总采集面积约为3 m2.为了避免采样过程中的人为误差,所有采样均由同一人完成.采样时尽可能覆盖样线内前侧方向上的所有植物及其表面覆盖物,且采集区不重复.在每条样线上,每次采集到的样品先用装有乙酸乙酯的毒瓶处理,然后将8次采集的样品混合后作为1条样线上的重复进行处理.为防止样品的腐烂,我们在野外采样时将样品装入塑料密封袋后暂存于装有冰袋的冰盒中,8 h内所有样品被带回实验室置于冰箱中-20 ℃保存.在2018年8月的采样中,我们还在每条样线2 m 的范围内,随机选择了芦苇和互花米草植株各5~10株,收集叶组织带回实验室置于冰箱中-20 ℃保存.昆虫标本根据形态学特征进行鉴定,尽可能将其鉴定到种这一阶元;鉴定的主要参考资料为《中国昆虫生态大图鉴》[19]、《昆虫分类》[20]、《昆虫形态分类学》[21]和《幼虫分类学》[22].
1.3 昆虫食物结构分析
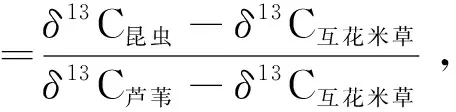
我们根据C3植物芦苇和C4植物互花米草的碳稳定同位素比值的不同,以及取食这些植物的昆虫其碳信号不会发生改变等特性,通过测定咀嚼型昆虫、刺吸型昆虫及植物样品的碳稳定同位素丰度,评估不同植物群落中昆虫食物结构的差异.我们选取了每个昆虫类群中物种个体数最多的4个优势种,以及互花米草和芦苇叶片作为同位素测量样品.由于许多样线上的昆虫物种未能达到同位素比值测量的最少质量要求,在各植物群落中,我们随机将每3条样线上的相同物种(包括植物和昆虫样品)合并后,作为该植物群落中的1个重复进行检测,如此各植物群落中的动植物样品有5个重复.所有动植物样品均置于55 ℃烘箱干燥48 h,而后磨成粉末.参考Wu等[17]的方法,使用同位素比质谱仪(DELTA V Advantage, Thermo)测定样品的13C/12C相对丰度(δ13C),公式为:
(1)
式中,R表示重与轻同位素之间的比值(即13C/12C);标准物质使用咖啡因(IAEA600);δ13C的分析精度为0.2‰.
1.4 数据分析
为了比较不同植物群落中昆虫与植物的δ13C值的差异,我们先利用Shapiro检验判断数据正态性是否成立,利用car包中的Levene检验判断数据方差齐性是否成立.由于数据正态性与方差齐性均不成立,我们利用agricolae包对数据进行Kruskal-Wallis秩和检验和多重比较.我们假设所有植物群落中的昆虫只取食芦苇和/或互花米草,利用二源混合模型(two-source mixing model)进一步确定了不同植物对昆虫营养源的贡献率(η),计算公式如下:
(2)
η(互花米草衍生的碳)=1-η(芦苇衍生的碳),
(3)
式中,δ13C昆虫、δ13C芦苇和δ13C互花米草分别代表昆虫、芦苇和互花米草的δ13C值.当某一食物资源的贡献率超过100%时,按照100%计算.上述所有分析均在版本为3.6.2的R软件中完成.
2 结 果
原生对照区、入侵区和恢复区3种芦苇群落中,咀嚼型和刺吸型昆虫的δ13C值在植物群落间均无显著差异,且都与芦苇的δ13C值(δ13C芦苇=-26.47‰±0.25‰)相似(图2),3种植物群落中芦苇对昆虫的平均营养贡献率均大于90%(表1).在入侵区,互花米草群落中两类食叶型昆虫的δ13C值与互花米草的δ13C值(δ13C互花米草=-13.03‰±0.16‰)无显著差异(图2),互花米草对两类昆虫的营养贡献占主体(平均贡献率为80%)(图2);芦苇-互花米草混生群落中,两类昆虫的δ13C值介于芦苇和互花米草的δ13C值之间(图2),芦苇和互花米草对两类食叶昆虫的营养贡献率平均值较为相似(芦苇为55.5%、互花米草为44.5%)(表1).
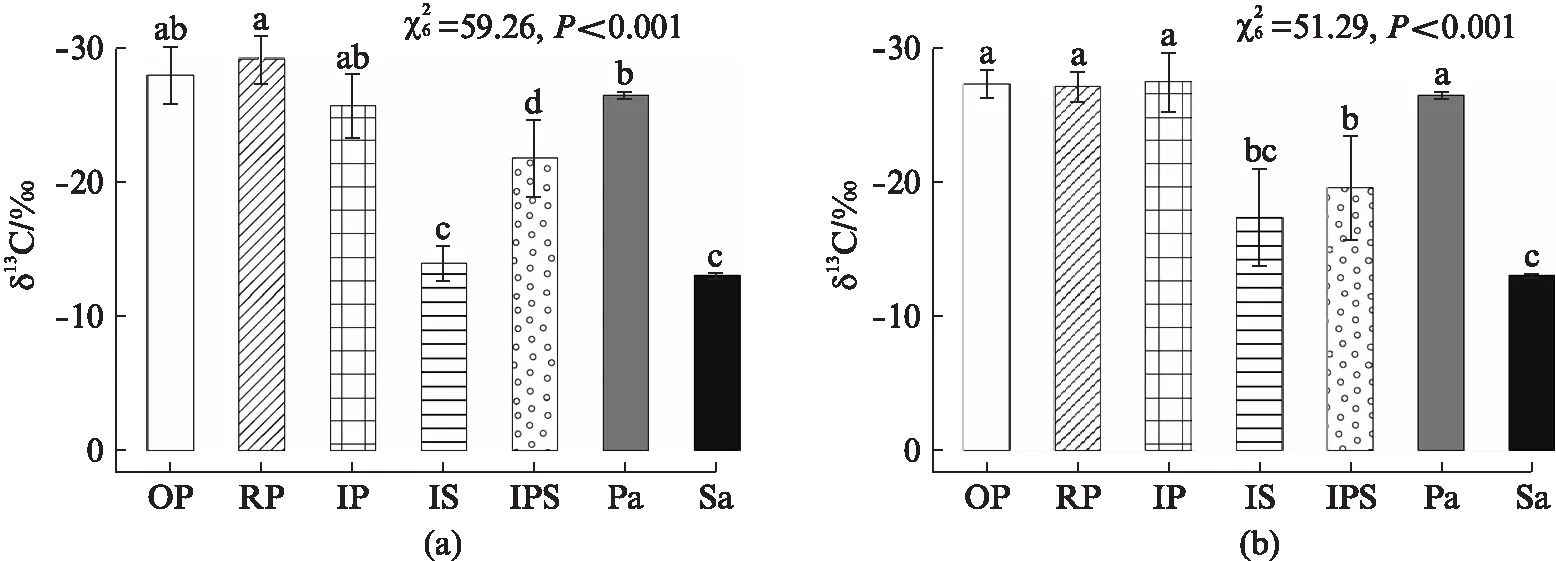
图2 不同植物群落中咀嚼型昆虫(a)、刺吸型昆虫(b)及芦苇与互花米草样品的δ13C值Fig.2 δ13C values of leaf chewers (a) and leaf suckers (b), Phragmites and Spartina in different plant communities注: OP、RP、IP、IS、IPS分别表示原生对照区芦苇群落、恢复区芦苇群落、入侵区芦苇群落、入侵区互花米草群落和入侵区芦苇-互花米草混生群落中的昆虫样品,Pa和Sa分别表示芦苇和互花米草样品.图中误差棒表示平均值±1.96 SE,误差棒上的不同字母表示组间差异在0.05水平上显著(Kruskal-Wallis秩和检验后进行多重比较).
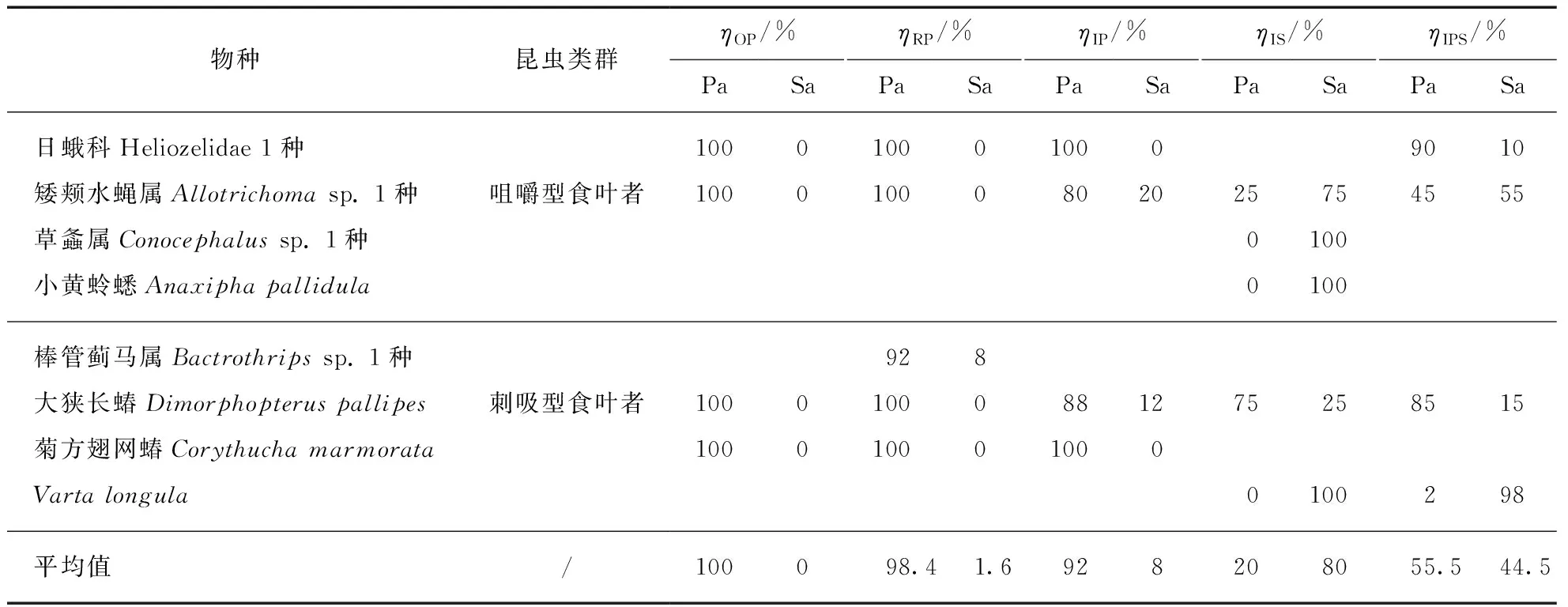
表1 不同植物群落中芦苇(Pa)和互花米草(Sa)对植食性昆虫营养源的相对贡献率
3 讨 论
植食性昆虫直接利用植物,因此对植物入侵造成的植物群落结构变化十分敏感[4,9].植食性昆虫通常偏好于取食营养质量高而防御能力差的植物[7,23].以往的研究表明,相对于芦苇,互花米草的营养价值更低,防御能力更高,这暗示了就草食资源的质量而言,许多昆虫对互花米草的取食能力可能并不及芦苇[8].但是,本研究发现,互花米草群落中的咀嚼型和刺吸型昆虫的δ13C值与互花米草的δ13C值并无显著差异(图2),说明这些昆虫对互花米草具有较强的取食能力.这可能是因为入侵植物群落中所采集到的昆虫样品均为入侵影响下的“幸存者(survivor)”[6-7],即不能利用互花米草的昆虫在植物入侵过程中已被淘汰.譬如,在我们的采样中,在土著植物群落中主要依赖芦苇为食的1种日蛾(Heliozelidae)、1种棒管蓟马(Bactrothripssp.)和菊方翅网蝽(Corythuchamarmorata)等昆虫在互花米草群落中几乎没有被采集到.
在本研究中,入侵区芦苇-互花米草混生群落中咀嚼型和刺吸型昆虫的δ13C值,均介于芦苇和互花米草的δ13C值之间(图2),互花米草和芦苇对这些昆虫的平均营养贡献率较为接近(55.5%和44.5%)(表1).而在互花米草完全替代芦苇形成的入侵单优群落中,互花米草和芦苇对植食性昆虫营养源的平均贡献率则变为80%和20%(表1),该发现与以前的报道是一致的[17].以上结果说明,在互花米草入侵过程中,植食性昆虫对植物资源消费的依赖程度会发生明显变化,随着互花米草入侵强度的增强,植食性昆虫会从同时依赖于芦苇和互花米草,转变为依赖互花米草为主而获取营养资源.造成这些植食性昆虫食物结构变化的原因可能有: (1) 有些昆虫可能对植物资源质量性状的要求并不高,而植物资源数量性状(如地上生物量、分布面积)对其种群发展可能更加重要[7].与芦苇相比,互花米草在盐沼中的分布面积更广、生长期更长、地上生物量也更多,这些条件可为昆虫提供更丰富的食物资源,从而有利于其利用[8,18].(2) 互花米草在盐沼中能比芦苇产生更多的凋落物,植株密度也较高,这可为生活于其中的昆虫提供良好的隐蔽环境[4].此外,有研究发现,互花米草入侵降低了植食类昆虫的天敌的多样性和优势种组成,这为互花米草群落内的植食类昆虫可能营造了“无天敌空间(enemy-free space)”[24-25].互花米草群落中以上的这些微生境特征均有利于植食性昆虫躲避天敌,从而促进其选择互花米草生境作为栖息地[4,24-25],而栖息于此的昆虫随着与外来植物互作时间的延长,可能会逐渐适应互花米草从而选择其作为食物资源[8,17,26].
入侵植物清除后,恢复区芦苇群落中咀嚼型和刺吸型昆虫的δ13C值与芦苇的δ13C值无显著差异(图2),芦苇对这些昆虫的平均营养贡献率已恢复到98%.日蛾、棒管蓟马和菊方翅网蝽等一些因不能取食互花米草而在入侵植物群落中消失的昆虫,在恢复区芦苇群落再植后已重新出现,且芦苇对这些昆虫的营养贡献率达到100%(表1).这些结果表明,入侵植物清除后,本地植食性昆虫依赖土著植物作为营养来源的状况也得到了恢复.同样,正如前面我们所讨论到的原因,恢复区植食性昆虫对土著植物营养源依赖性的恢复,可能也与芦苇这一长江口重要的土著植物的植被以及盐沼生物和非生物环境的恢复密切相关;有关这方面的影响机制值得进一步地系统研究.
综上所述,本研究表明,互花米草入侵改变了盐沼中植食性昆虫的食物结构,而清除互花米草并恢复芦苇群落以后,植食性昆虫对土著植物资源的依赖性也随之得到了恢复.昆虫作为盐沼中许多高等级消费者(如鱼类和鸟类等)的食物资源,其食物结构的变化,势必会对盐沼动物群落结构和食物网关系带来链式影响,从而会使盐沼生态系统整体结构和功能的稳定性产生联动响应.从这一角度出发,本研究结果可对认识盐沼入侵植物的影响及其治理后生态系统营养关系的恢复提供帮助,对盐沼入侵植物治理生态工程的效益评估也具有重要的参考价值.

