刺五加多糖对雏鸡脾脏中CD4+和CD8+T淋巴细胞定位分布的影响
张英楠,徐 晶,张桂山,杨树宝 , 3*
(1. 吉林医药学院, 吉林吉林 132013;2. 长春科技学院,长春 130600;3. 吉林农业大学动物科技学院,长春 130118)
刺五加多糖(ASPS)是从刺五加根茎中分离出的免疫活性多糖,具有调节动物免疫机能、抗氧化、抗肿瘤和抗感染等功效[1-2]。结合刺五加的功效及其安全、绿色和环保的特点,将其应用于养殖过程中具有重要意义。
T淋巴细胞主要介导细胞免疫,机体在抗原刺激下,通过致敏和反应阶段,T淋巴细胞分化为效应性T淋巴细胞并产生各种细胞因子,从而抵抗体内外各种病原菌的感染[3]。T淋巴细胞两个重要的表面标志是CD4和CD8,其中CD4+T淋巴细胞的主要功能是分泌细胞因子,具有诱导和增强免疫应答的作用,CD8+T淋巴细胞主要介导细胞毒杀伤作用。CD4+和CD8+T淋巴细胞是机体免疫调节的枢纽,在正常值范围内当CD4+/CD8+值高时,表明机体处于高的免疫状态,当CD4+/CD8+的比例失调或缺陷时,可导致各种免疫疾病发生[4]。
研究证明,植物多糖能够促进T淋巴细胞的增殖,尤其是对于维持CD4+/CD8+值的正常范围具有重要作用[5-7]。另外,这些研究主要是通过流式细胞术对血液中的淋巴细胞亚群数量变化进行检测,而目前关于ASPS对鸡T淋巴细胞亚群定位分布的影响还未见报道。因此本研究利用免疫组织化学方法检测ASPS对鸡脾脏中CD4+和CD8+T淋巴细胞定位分布的影响,从组织学角度观察ASPS对脾脏的免疫调节作用,为进一步探讨ASPS的免疫功能调节机制奠定基础。
1 材料与方法
1.1 实验动物 200只1日龄海兰褐公雏,购自长春市农业科学研究院种鸡场。
1.2 主要试剂及仪器 刺五加多糖由本实验提取和纯化,多糖纯度为 81%[8];冰冻切片用OCT组织包埋液:美国Sakura公司产品;小鼠抗鸡CD4、CD8单克隆抗体:美国Southern Biotechnology公司产品;Ultra Sensitive SP超敏试剂盒kit 9901:福州迈新公司产品。
Leica CM1850 冰冻切片机:德国Leica公司生产;Olympus CX41 显微镜:日本Olympus公司生产;Pixera pro150ES图像采集器:美国Pixera公司生产。
1.3 动物分组与处理 1日龄海兰褐公雏饲养至7日龄时选取150只,随机分为3组,每组50只。第1组和第2组为ASPS低剂量组和高剂量组,分别用ASPSL和ASPSH表示,两组分别皮下注射100 mg/mL和200 mg/mL的ASPS;第3组为空白对照组,注射等量灭菌生理盐水。所有组每天注射1次,ASPS和生理盐水均为0.2 mL,连续注射3 d。
每一组分别在最后一次注射ASPS后的第7、14、21和28天取材,每组分别随机选取10只雏鸡,快速取其脾脏。将脾脏制成冰冻切片,片厚5 μm,-80 ℃保存备用,以进行免疫组织化学染色。
1. 4 免疫组织化学染色程序 每组每只鸡随机选取5张切片,每张切片依次滴加30 mL/L过氧化氢(室温下孵育10 min)、小鼠抗鸡CD4(1∶200)或CD8(1∶200)单克隆抗体工作液(37 ℃孵育1 h)、聚合物增强剂(室温下孵育20 min)和酶标抗鼠/兔聚合物(室温下孵育30 min);每一种试剂孵育后,均用PBS洗3次,每次3 min;最后DAB显色;苏木精复染;自来水冲洗返蓝;梯度酒精脱水;二甲苯透明;中性树脂封片;照相。
1. 5 图像分析及统计学处理 应用Image-pro plus6.0图像分析软件测定脾脏中单位视野内阳性细胞面积。每张切片测3个视野,取平均值。应用SPSS18.0软件对各组阳性细胞进行单因素方差分析。
2 结果与分析
2.1 CD4+T淋巴细胞定位分布的变化情况
图1- A,B,C,D显示,空白对照组随着日龄增长,脾脏中CD4+T淋巴细胞的数量逐渐增加,除免疫后7 d明显低于其他日龄外,其他各日龄之间差异不明显,各日龄CD4+T淋巴细胞主要分布在动脉周围淋巴鞘中,其他部位以散在形式存在。
免疫后7 d和14 d时ASPSL组和ASPSH组CD4+T淋巴细胞的数量均有所增加,但与空白对照组比较差异并不显著(P>0.05),而免疫后21 d和28 d时显著增加(P<0.05)(图2)。从免疫后14 d开始,主要由CD4+T淋巴细胞构成的动脉周围淋巴鞘面积较空白对照组明显增加,尤其是免疫后21 d和28 d时,单个动脉周围淋巴鞘面积大概是同日龄对照组的3倍左右(图1-G,H),但是此阶段红髓中CD4+T淋巴细胞较同日龄对照组和同组之前日龄明显减少(图1-G,H)。
2.2 CD8+T淋巴细胞定位分布的变化情况
图1- I,J,K,L显示,各组各日龄CD8+T淋巴细胞都主要分布在红髓和白髓中,动脉周围淋巴鞘中较少,没有较大面积的由CD8+T淋巴细胞构成的动脉周围淋巴鞘出现,空白对照组阳性细胞的数量免疫后7 d和14 d变化较小,但是免疫后21 d时明显增加。
与对照组比较,除了免疫后28 d ASPSH组CD8+T淋巴细胞数量显著增加外(P<0.05),其他各日龄ASPSL组和ASPSH组CD8+T淋巴细胞虽有所增加,但是差异均不显著(P>0.05)(图2),而且CD8+T淋巴细胞的定位分布与同日龄对照组比较也无大的变化,阳性细胞都主要分布在红髓和白髓中,而动脉周围淋巴鞘中阳性细胞较少(图1-M,N,O,P)。
2.3 CD4+/CD8+T淋巴细胞比值的变化情况 表1显示,免疫后7 d和14 d时,ASPSL组和ASPSH组CD4+/CD8+T淋巴细胞比值与空白对照组比较差异不显著(P>0.05)。免疫后21 d和28 d时,ASPSL组和ASPSH组CD4+/CD8+T淋巴细胞比值为1.1左右,均显著高于空白对照组(P<0.05),但两个ASPS组之间比较差异并不显著(P>0.05)。
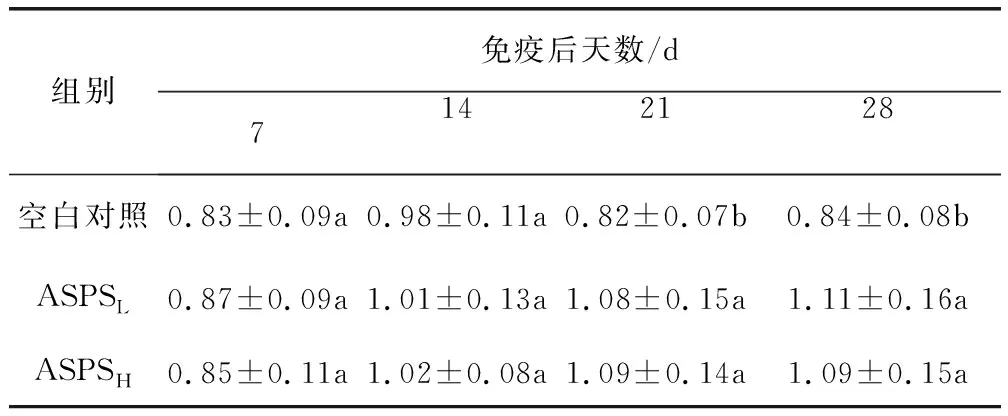
表1 各组鸡CD4+/CD8+T淋巴细胞亚群比值的动态变化Tab 1 The dynamic changes of the rario of CD4+/CD8+T lymphocytes in different groups
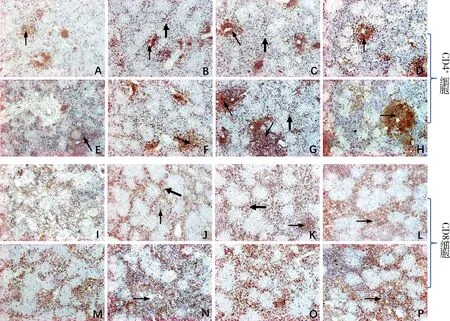
图A-D分别显示免疫后7、14、21和28 d空白对照组CD4+ T淋巴细胞分布;图E-H分别显示免疫后7、14、21和28 dASPSH组CD4+ T淋巴细胞分布;图I-L分别显示免疫后7、14、21和28 d空白对照组CD8+ T淋巴细胞分布;图M-P分别显示免疫后7、14、21和28天ASPSH组CD8+ T淋巴细胞分布注:图中细箭头所示为动脉周围淋巴鞘,粗箭头所示为红髓中阳性细胞A-D are respectively the distribution of CD4+ cells in control group of 7, 14, 21 and 28 days after immunization; E-H are respectively thedistribution of CD4+ cells in ASPSH group of 7, 14, 21 and 28 days after immunization; I-L are respectively the distribution of CD8+ cells incontrol group of 7,14, 21 and 28 days after immunization; M-P are respectively the distribution of CD8+ cells in ASPSH group of 7, 14, 21 and28 days after immunizationNote: The thin arrows indicate PALS, while the thick arrows indicate positive cells in the red pulp图1 ASPS对脾脏中CD4+ 和CD8+ T淋巴细胞定位分布的影响(250×)Fig 1 The effect of ASPS on distribution of CD4+and CD8+T lymphocytes in spleen (250×)
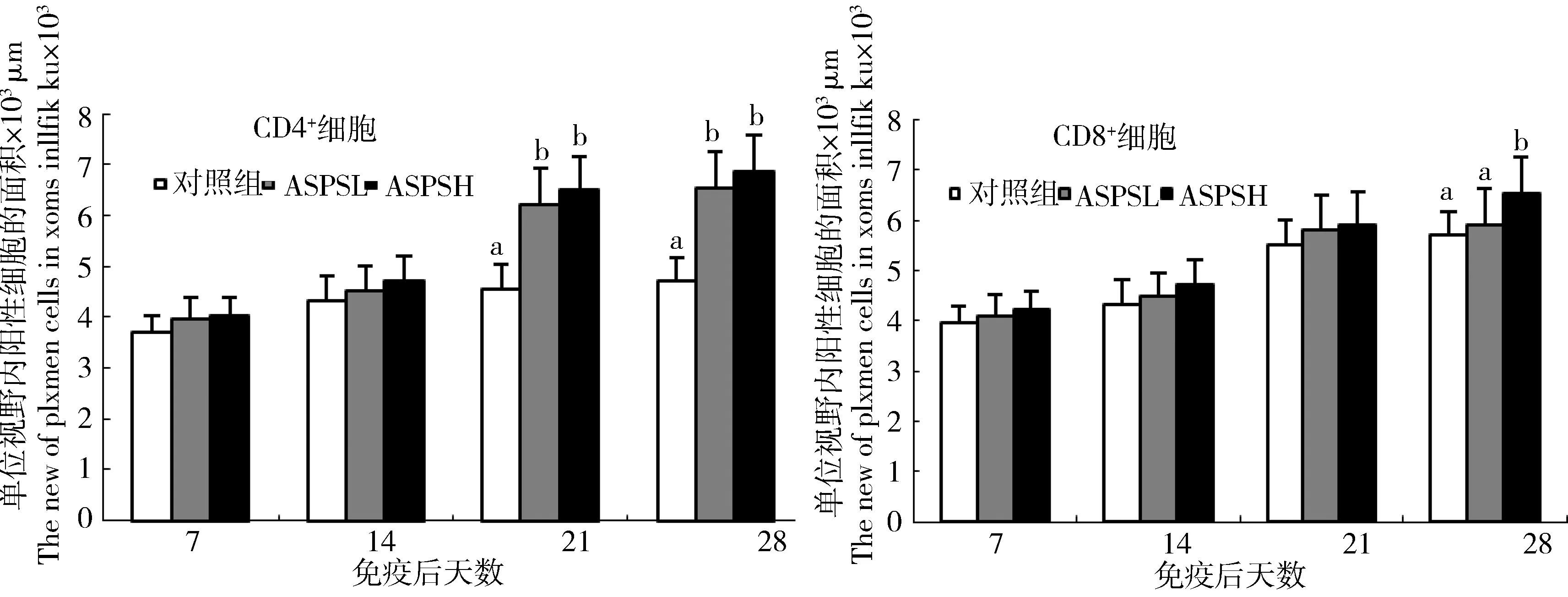
注:同一日龄肩标不同字母表示差异显著(P<0.05),肩标相同字母或无字母标注表示差异不显著(P>0.05)Different letters of shoulder label indicated significant difference (P<0.05), while the same letter ofshoulder label indicated no significant difference (P>0.05).图2 ASPS对脾脏中CD4+ 和CD8+ T淋巴细胞数量的影响Fig 2 The effect of ASPS on quantity of CD4+ and CD8+T lymphocytes in spleen
3 讨论与结论
T、B淋巴细胞是构成机体免疫系统的主要细胞群体,分别调节机体的细胞和体液免疫应答, 是适应性免疫系统的主要效应细胞。多糖能调节T、B细胞周期,刺激其分裂增殖,并促进相关细胞因子和抗体的分泌[8]。ASPS可激活NK(自然杀伤) 细胞和巨噬细胞,并对T、B细胞产生重要作用,从而增强机体的免疫功能[9]。Lee等[10]还发现, 刺五加多糖能够与TLR4受体以及CD14结合,进一步激活NF-κB信号通路,促进IL-1β,IL-6,IL-10和TNF-α的产生。Han等人[11]发现,ASPS能够与与TLR2或TLR4相互作用,能够激活小鼠的免疫细胞如巨噬细胞和B细胞,并且进一步活化核转录因子NF-kB、MAPK,然后调节免疫细胞产生各种细胞因子如TNF-α,IL-6,iNOS等,从而进一步调节免疫反应。目前多糖对T淋巴细胞免疫功能的调节主要通过检测淋巴细胞增殖能力以及相关细胞因子等方法进行的,另外对T淋巴细胞亚群的观察主要是利用流式细胞术对数量进行检测,但是关于多糖对CD4+和CD8+T淋巴细胞在免疫器官及组织中的精确定位变化还未见报道,这对于进一步揭示多糖的免疫调节机制具有重要意义。
脾脏作为鸡体内的最大的外周免疫器官对T依赖性抗原产生体液免疫应答是通过动脉周围淋巴鞘和椭球周围淋巴鞘之间的相互作用诱导产生的[12]。本文前期研究证明ASPS能够明显促进由CD3+T淋巴细胞构成的动脉周围淋巴鞘和由Bu-1+B淋巴细胞过程的椭球周围淋巴鞘的发育[8]。本研究发现CD4+T淋巴细胞是构成动脉周围淋巴鞘的主要T淋巴细胞亚群,与对照组比较,ASPSL组和ASPSH组位于红髓和白髓中散在的CD4+T淋巴细胞减少,而动脉周围淋巴鞘中CD4+T淋巴细胞的数量显著增多,从而使动脉周围淋巴鞘的面积明显增加。这说明在ASPS作用下,CD4+T淋巴细胞在脾脏中发生迁移,主要募集到动脉周围淋巴鞘周围,并进一步增殖,具体原因和机理还需要以后进一步研究。由于CD4+细胞可以产生各种细胞因子,参与或协助细胞和体液免疫反应,ASPS能够促进脾脏中CD4+细胞的数量增加,另外影响其在脾脏的定位分布,都是增强免疫的表现。
研究同时发现,ASPS对脾脏中CD8+T淋巴细胞的数量以及定位分布影响较小,与对照组比较无明显变化。另外,免疫后21和28天时,与空白对照组比较,ASPS能够显著提高CD4+/CD8+T淋巴细胞比值(P<0.05)。因此在ASPS作用下,脾脏中CD4+T淋巴细胞增多以及CD4+/CD8+T淋巴细胞比值升高,证明脾脏免疫功能得到进一步提高。这也与其他学者利用流式细胞术对T淋巴细胞亚群检测的结果基本一致:邱妍等[13]的试验发现,合适剂量的黄芪、板蓝根、牛膝和山药等4种多糖均可以促进鸡CD4+T淋巴细胞增殖,从而增强细胞免疫。此外,鸡CD4+T 淋巴细胞还具有辅助B淋巴细胞产生抗体的作用,从而提高体液免疫。王宏军等[14]试验发现贵州南五味子多糖明显促进正常鸡体内T淋巴细胞增殖,CD4+细胞百分比升高,CD8+细胞百分比下降,CD4+/CD8+细胞比值升高。Zhao等[15]研究发现川明参多糖能够提高环磷酰胺致免疫抑制小鼠的CD4+/CD8+细胞比值,使其比值恢复至正常水平。因此,中药多糖对于改善和维持T淋巴细胞亚群的正常范围具有重要作用。
ASPS虽然对脾脏中CD8+T淋巴细胞的数量和分布无明显影响,但对CD4+T淋巴细胞的定位分布影响较大,能够促进红髓中CD4+T淋巴细胞向动脉周围淋巴鞘迁移,使动脉周围淋巴鞘面积增加,这从组织学角度证明ASPS能够通过影响CD4+T淋巴细胞的定位分布发挥免疫调节作用。

