建立双重荧光定量PCR方法检测蜱传疏螺旋体
杨小娜,张 琳,侯学霞,郝 琴
蜱是传播多种人兽共患病病原体的重要媒介,寄主范围广泛,包括哺乳动物、鸟类、两栖动物和其他脊椎动物。大多数蜱在幼蜱、若蜱、成蜱3个生长阶段中通过吸食宿主血液来维持生长和发育[1]。硬蜱携带的病原体常可引起莱姆病、斑点热、无形体病、埃立克体病、森林脑炎、新疆出血热、Q热、新型布尼亚病毒感染等疾病发生[2]。由于蜱携带的病原体较多,一些新的蜱传病原体不断发现,蜱传疾病在全球的分布范围不断扩大,对家畜和人类健康造成重大危害[3]。
蜱传疏螺旋体根据引起人类疾病的不同通常分为伯氏疏螺旋体和回归热螺旋体两个分类群。伯氏疏螺旋体(Borreliaburgdorferi,BB)是引起莱姆病的病原体,莱姆病在世界70多个国家均有报道,是北美洲和欧亚大陆国家最常见的蜱传疾病之一[4]。莱姆病可引起游走性红斑、关节炎和其他神经系统症状[5]。目前,莱姆病螺旋体可分为20多个基因型,其中至少有5个能引起人类疾病,包括B.burgdorferisensustricto(B.b.s.s)、B.garinii、B.afzelii、B.bavariensis和B.spielmani[6]。Borreliamiyamotoi(BM)于1994年在日本首次分离并被确认为一种新的螺旋体。2011年,俄罗斯首次出现了人类感染病例[7],随后在美国、欧洲、日本也发现了病例[8-10]。从系统进化上讲,它属于回归热螺旋体,与大多数回归热螺旋体不同的是它不引起典型的回归热,并通过硬蜱传播,可导致严重的疾病,如脑膜脑炎[11]。
在亚洲,全沟硬蜱不仅是传播B.burgdorferi的重要媒介,而且已被证实能够传播B.miyamotoi,白足鼠等啮齿动物、鸟类等也是两种螺旋体重要的宿主[5]。至今很多研究报道了B.burgdorferi与B.miyamotoi同时感染硬蜱的病原学证据,描述了二者在同一种群的流行状况,也发现了二者混合感染的患者[12]。两种病原具有相同的传播媒介(硬蜱)和宿主动物,同时人类B.miyamotoi感染有一些与莱姆病难以区分的临床表现,如皮肤红斑、神经系统受损症状等。在我国,尚未有报道利用荧光定量PCR方法用于检测B.miyamotoi,因此,研发一种高效、快速和敏感的检测方法用于检测和区分这两种病原体是非常必要的。在本研究中我们设计了一种能同时检测这两种病原体的双重荧光定量PCR方法,具有良好的灵敏度和特异度,并用这种方法检测了模拟样本和新疆采集的200只硬蜱,对该方法进行了初步的应用评价。
1 材料与方法
1.1 材料 对照菌株DNA:钩端螺旋体、土拉弗朗西斯菌、巴尔通体、布鲁氏菌、大肠埃希菌均由中国疾病预防控制中心传染病预防控制所相关科室提供。试剂与仪器:TaKaRa 荧光定量taq酶(TaKaRa Taq Version 2.0 plus dye, RR390);Roche LightCycler 480实时荧光定量PCR仪;天根DNA提取试剂(DNeasy Blood&Tissue Kit)。
1.2 方 法
1.2.1 引物探针合成 分别根据B.burgdorferirecA基因、B.miyamotoi甘油磷酸二酯酶生物合成基因(glpQ)设计引物和探针[13-14]。两组引物探针见表1,利用Primer-BLAST(https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi)确定其对目的基因的特异性。

表1 多重PCR引物和探针Tab.1 PCR primers and probes
1.2.2 标准品制备B.burgdorferirecA基因扩增片段为GTTCTGCAACATTAACACCTAAAGCTTTTGCATAAACAGGATCAAGAGCA-TGCTCAGCATCAATAAAAGCAGCTATCCCA-CCT(83 bp),B.miyamotoiglpQ基因扩增片段为ATGCACGACCCAGAAATTGACACAACCACA-AATGTTGCACAATTATTTCCCAATCGAGCT-AGAGAAAACGGACGATATTACGCCACTGA-CTT(78 bp),扩增片段交由上海生工公司合成质粒。将4 μg质粒干粉加入1 mL去离子水,得到质粒浓度4 μg/mL(4 ng/μL)。每个碱基的平均分子量660,pUC57质粒含2 710个碱基,单质粒分子量为660×(基因片段碱基数+2 710),每μL拷贝数=(质粒浓度/单质粒分子量)×10-9×阿伏伽德罗常数。计算得到两种质粒拷贝数均为1.3×109拷贝/μL。
1.2.3 单重荧光定量PCR
1.2.3.1 灵敏度 对荧光定量PCR反应的引物和探针浓度进行优化后,确定最佳反应体系。首先分别对recA、glpQ基因质粒进行单基因靶点的检测,将标准质粒梯度稀释为109~10-1拷贝/μL,每个浓度设置4个重复试验,确保引物探针的可用性。
1.2.3.2 特异度 利用建立的单重荧光定量PCR体系,分别检测钩端螺旋体、布鲁氏菌、土拉菌、巴尔通体、大肠埃希菌DNA。
1.2.4 双重荧光定量PCR实验
1.2.4.2 灵敏度 利用109~10-1拷贝/μL的阳性质粒标准品,建立20 μL反应体系,每个反应中含recA基因上下游引物和探针(10 μmol/L)分别1 μL,glpQ基因上下游引物和探针(10 μmol/L)分别0.8 μL,去离子水0.6 μL,两种阳性质粒各2 μL。每个浓度设置4个重复实验,4个实验均为阳性结果则判定为阳性,确定该方法的灵敏度。
1.2.4.3 与单重荧光定量PCR方法差异性比较 根据1.2.4.2灵敏度检测结果,将双重与单重实验的Ct值(荧光信号到达设定域值时所经历的循环数)进行比较,利用配对设计资料的Wilcoxon signed -rank test 符号秩和检验,判断单重与双重检测方法的结果有无明显差别。
1.2.4.4 标准曲线 利用1.2.4.2的实验数据,根据样本浓度对数和Ct值绘制标准曲线。
1.2.4.5 特异度 利用建立的双重荧光定量PCR体系,检测钩端螺旋体、布鲁氏菌、土拉菌、巴尔通体、大肠埃希菌DNA。
1.2.4.6 浓度变化对检测结果的影响 为探索使用双重荧光定量PCR方法检测病原体过程中,其中一种病原体在另一种病原体浓度变化背景下检测结果的差异。设置第1组实验:recA质粒浓度固定为104拷贝/μL,glpQ质粒浓度106~102拷贝/μL;设置第2组实验:glpQ质粒浓度固定为104拷贝/μL,recA质粒浓度106~102拷贝/μL。如果在某一种病原体浓度变化时,另一种病原体的Ct值没有显著变化,说明在一种病原体浓度变化为背景时,对另外一种病原体的检测没有显著影响。
1.2.4.7 探索其他病原体存在对检测两种病原体结果的影响 利用钩端螺旋体、布鲁氏菌、土拉菌、巴尔通体、大肠埃希菌DNA,设计如下实验:
(1)只有recA和glpQ两种阳性质粒。
(2)recA和glpQ两种阳性质粒加上述5种病原体DNA,作为实验组探索其他病原体存在对两种病原体检测的影响。
(3)只有上述5种病原体DNA,不含有recA和glpQ两种阳性质粒。
(4)不含有任何病原体DNA,用去离子水补齐体系。
1.2.5 样品检测
1.2.5.1 模拟样本检测 将梯度稀释的标准模板(107~103拷贝/μL)分别取1 μL加入9 μL检测阴性(巢式PCR和荧光定量PCR反应均为阴性)的蜱DNA中,此时浓度变为106~102拷贝/μL,分别进行双重荧光定量PCR反应。通过批内及批间变异系数(CV)评价反应的重现性。批内重现性:同一批次内,106~102拷贝/μL的模拟样本分别设置3个平行样本,分析各个稀释度反应Ct值的变异系数。批间重现性:以不同批次间(不同时间进行3次实验)标准模板各个稀释度反应Ct值的变异系数评价批间重现性。
1.2.5.2 实际样本检测 利用本研究设计的双重荧光定量PCR方法检测采集于新疆200只蜱虫B.burgdorferi和B.miyamotoi的携带情况。每次实验均设计阳性对照和阴性对照进行质控。
2 结 果
2.1 单重荧光定量PCR
2.1.1 灵敏度 用优化好的反应体系做单重荧光定量PCR反应,取recA基因上下游引物探针浓度为500 nmol/L,glpQ基因上下游引物探针浓度为400 nmol/L。两种基因能检测到的最低浓度均为101拷贝/μL,一个反应最少能检测20个基因拷贝。
2.1.2 特异度 利用单重荧光定量PCR体系,检测钩端螺旋体、布鲁氏菌、土拉菌、巴尔通体、大肠埃希菌DNA。检测结果均为阴性,说明特异性良好。
2.2 双重荧光定量PCR
2.2.1 灵敏度 双重荧光定量PCR方法对不同浓度梯度的标准品有很好的检测效果,重复样本的Ct值变化很小,重复性较好(图1)。recA和glpQ两种阳性质粒能检测到的最低浓度均为102拷贝/μL,一个反应最少能检测200个基因拷贝,与单重荧光定量PCR方法相比灵敏度下降了一个数量级。

AB A:B. burgdorferi recA基因扩增曲线;B: B. miyamotoi glpQ基因扩增曲线图1 双重荧光定量PCR灵敏度实验Fig.1 Sensitivity experiments of duplex real-time PCR
2.2.2 与单重荧光定量PCR方法差异性比较 利用双重和单重方法的Ct平均值,进行配对设计资料的Wilcoxon signed -rank test符号秩和检验。经检验,5
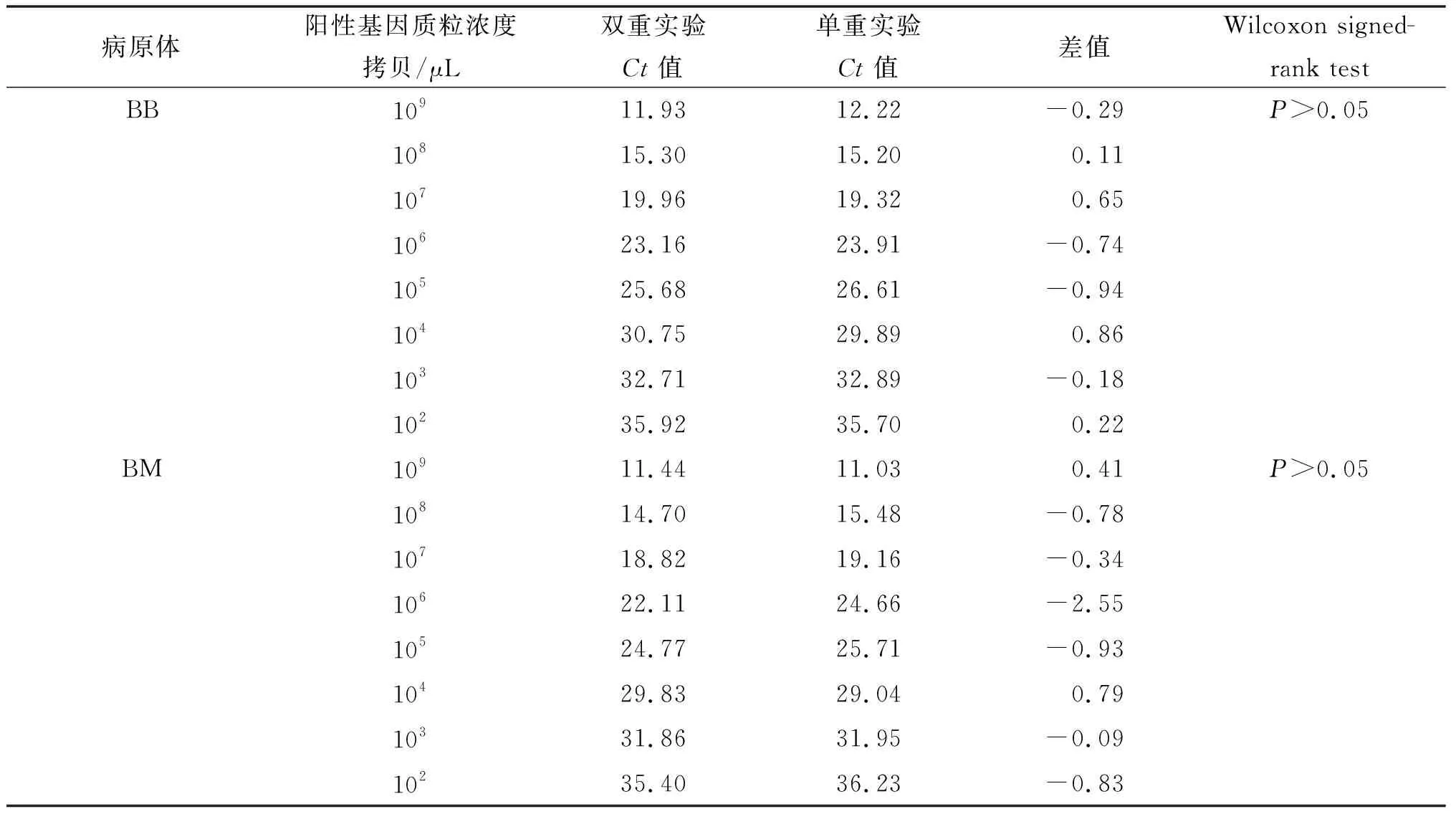
表2 不同浓度梯度标准品测量值和期望值的比较Tab.2 Comparison of measured values and expected values
2.2.3 标准曲线B.burgdorferirecA基因和B.miyamotoiglpQ基因的浓度对数分别与检测Ct值呈线性相关,R2分别为0.993 7、0.996 2,接近于1,拟合效果好(图2)。

ABA:B. burgdorferi recA基因标准曲线; B:B. miyamotoi glpQ基因标准曲线图2 双重荧光定量PCR标准曲线Fig.2 Duplex real-time PCR standard curve
2.2.4 特异度 利用双重荧光定量PCR体系,检测钩端螺旋体、布鲁氏菌、土拉菌、巴尔通体、大肠埃希菌DNA。检测结果均为阴性,说明特异性良好。
2.2.5 浓度变化影响 第1组实验:glpQ质粒浓度变化时(106~102拷贝/μL),recA质粒(104拷贝/μL)检测Ct值无明显差别;第2组实验:recA质粒浓度变化时(106~102拷贝/μL),glpQ质粒(104拷贝/μL)检测Ct值无明显差别(图3)。说明对于这两种疏螺旋体,其中一种病原基因浓度变化对另一种病原体检测的结果无明显影响。

AB图3 一种病原浓度变化对另一种病原体检测结果(Ct值)的影响Fig.3 Effect of concentration on detection results (Ct values)
2.2.6 其他病原体存在对检测B.burgdorferi和B.miyamotoi结果的影响 阴性对照(3)、(4)检测结果均为阴性,(1)、(2)BB和BM检测均为阳性,Ct值差别不大,但是(2)的最大荧光强度比(1)低(图4)。说明其他多种病原体DNA的存在会降低测量的荧光强度,但对于病原体的检出没有影响。

ABA:B. burgdorferi recA基因扩增曲线;B:B. miyamotoi glpQ基因扩增曲线图4 其它病原体干扰实验的基因扩增曲线Fig.4 Gene amplification curves when other pathogens interfere with the experiment
2.3 样本检测
2.3.1 模拟样本检测 通过对各浓度梯度(106~102拷贝/μL)模拟蜱样本进行检测,均产生阳性结果。同一批次内模拟蜱样本各浓度Ct值的变异系数为0.111~0.406(BB)、0.675~1.301(BM),各批次间(不同时间进行的3次试验)各浓度Ct值的变异系数为0.412~1.238(BB)、0.285~1.149(BM),说明反应具有较好的重现性和稳定性(图5)。
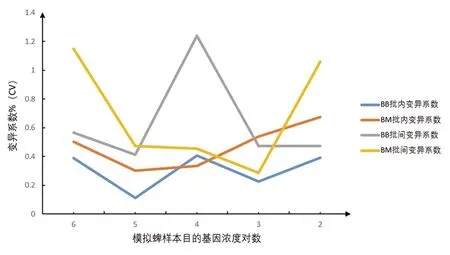
图5 模拟蜱样本批内和批间变异系数Fig.5 Intra-assay and inter-assay coefficient of variation of simulated tick samples
2.3.2 实际样本检测 在新疆地区采集到的200只蜱中,B.burgdorferi的recA基因检测有11个阳性(Ct值<37),B.miyamotoi的glpQ基因检测均为阴性。
3 讨 论
B.miyamotoi与B.burgdorferi具有相同的传播媒介和感染宿主,其感染具有相似的临床症状和体征,能导致人类严重疾病。我国已在黑龙江省牡丹江地区和山西省祁县地区发现了蜱感染B.miyamotoi的病原学依据,其它地区尚未有相关报道[12,15]。在我国,尚无鉴定B.miyamotoi的荧光定量PCR方法的建立。为了能同时检测和鉴别两种疏螺旋体,提高鉴定效率,本研究利用B.burgdorferi的recA基因和B.miyamotoi的glpQ基因,建立了一种双重荧光定量PCR方法。
本研究首先利用两种病原阳性质粒分别进行了单重荧光定量PCR实验,确保每对引物和探针都能扩增出对应的病原体,同时确定反应进行的最佳引物和探针浓度。为了增强实验结果分析的可靠性,在单重实验的基础上建立双重荧光定量PCR方法,实验结果证明两种病原体的引物探针没有交叉反应,对于不同浓度标准品的检测具有良好的区分度。双重检测实验灵敏度和特异度良好,标准曲线显示Ct值与两种病原标准品浓度的对数呈良好的线性相关关系。通过配对设计资料的Wilcoxon signed -rank test 符号秩和检验判定单重和双重方法测得的Ct值结果无明显差异。病原体浓度变化和其他病原体DNA的存在对检测Ct值没有明显的影响。我们利用建立的新方法检测模拟蜱样本和实际蜱样本,证明了双重荧光定量PCR方法的可行性和实用性。
在多重检测体系中,多对引物和探针及荧光基团之间会相互干扰,引起实验结果灵敏度低、特异性不强的情况,我们使用了两种方法来避免该问题。一是设计探针时使每种病原体探针的报告基团荧光发射最大波长处于不同的光谱范围,本实验选用的6-FAM(465-510)、VIC(533-580)两种荧光染料,其波长处于不同光谱范围。二是在建立双重荧光定量PCR方法前先做了颜色补偿实验,以确保荧光定量PCR仪的检测通道能区分每种病原体的探针,颜色补偿结果用于后续结果分析。
本研究建立的双重荧光定量PCR方法能快速检测蜱样本中B.burgdorferi和B.miyamotoi,但是能否用于临床标本的检测或者人类疾病的诊断分析还需要进一步的研究。该方法快速、灵敏、特异,为我们提供了一个有价值的检测工具,可用于病媒检测和风险评估,为疾病控制及生物安全提供了技术支持,也为临床检测提供了思路。

