人β2 微球蛋白在不同原核表达载体中的表达及活性比较
陈宴霞,黄曼娜,邱立明,刘曼,蔺庆辉
青岛中科爱博生物科技有限公司,山东青岛266400
β2-微球蛋白(β2-microglobμlin,β2MG)作为肾功能标志物是早期诊断肾病的一项重要生化指标[1-3],在正常情况下,由于其体积小,通常在肾小球易过滤,并被肾脏的近端肾小管细胞分解代谢[4-5],若肾功能受损,则血清中β2MG 就会升高。近年来,β2MG又作为多种肿瘤标志物备受众多学者关注,由于恶性肿瘤细胞具有超强合成β2MG 的能力,在临床上如肾癌、肺癌、乳腺癌、消化系统等恶性肿瘤患者血清中β2MG 含量超过正常范围,已作为联合检测指标广泛应用于肿瘤诊断和监测[5-8]。因此,临床关于β2MG 的血清学检测指标对于疾病诊断具有重要意义,值得大力推广应用。
β2MG 为一种低相对分子质量蛋白,是由99 个氨基酸组成的单链多肽,在第25 和80 位半胱氨酸有1 个链内二硫键,相对分子质量大小为11 800,与免疫球蛋白具有序列同源性,特别是与IgG 分子的CH3 结构域具有同源性[9]。鉴于其重要的临床应用价值,本研究旨在通过基因工程技术,利用两种原核表达载体重组表达人β2MG,并分别对获得的融合蛋白进行活性检测,为后续免疫原的筛选及制备相应的单克隆抗体创造条件,并为相关临床诊断试剂盒的研发奠定基础。
1 材料与方法
1.1 质粒及菌株 原核表达载体pET-28a(+)(5 369 bp,His-tag)和 pET-32a(+)(5 900 bp,Trx-Histags)由马来西亚Novagen 公司提供;E.coliDH5α和E.coliBL21(DE3)感受态细胞购自日本TaKaRa 公司。
1.2 主要试剂及仪器 质粒小量提取试剂盒为德国Qiagen 公司产品;核酸回收试剂盒购自北京百泰克生物技术有限公司;限制性内切酶EcoRⅠ、Hind Ⅲ为宝生物工程(大连)有限公司产品;T4 DNA 连接酶购自德国Promage 公司;HRP 标记的兔抗羊IgG(检测抗体)、TMB 显色液和BSA 均购自北京索莱宝有限公司;羊源β2MG 多克隆抗体(捕获抗体)购自深圳市菲鹏生物股份有限公司;Ni-NTA 树脂为美国通用电气(GE)公司产品。
1.3 不同表达载体重组质粒的构建 通过NCBI 网站下载 β2MG基因序列(NM_004048.4),去除信号肽,根据大肠埃希菌的优势密码子进行基因优化,使其利于在大肠埃希菌中表达。由于所选表达载体的5′端均有His 标签,在基因3′端分别加入了终止子,避免过多不必要的末端表达,在优化后基因序列两端加入酶切位点(EcoRⅠ/ HindⅢ),送生工生物工程(上海)股份有限公司合成。将合成序列进行酶切回收后,分别连接至 pET-28a(+)和 pET-32a(+)表达载体,构建重组质粒 pET-28a(+)-β2MG和 pET-32a(+)-β2MG,转化入感受态E.coliDH5α 中,分别进行 Kana(50 μg / mL)和 Amp(100 μg / mL)抗性 LB平板筛选培养,挑取阳性单克隆菌株,进行PCR 鉴定,阳性菌株送生工生物工程(上海)股份有限公司测序,并进行序列比对确认。
1.4 重组表达菌株的构建及目的基因的诱导表达 将测序正确的重组质粒转化入感受态E.coliBL21(DE3)中,分别进行 Kana(50 μg /mL)和 Amp(100 μg / mL)抗性LB 平板培养过夜,挑取长势较好的单克隆菌株于LB 液体培养基中培养,待菌液浓度(A600)达0.5 时,加入 IPTG(0.4 mmol /L),分别于 25 及 37 ℃梯度诱导表达过夜。取1 mL 各菌液,10 000×g离心1 min,收集菌体,加入 600 μL 蛋白缓冲液(25 mmol/ L Tris-HCl,pH 8.5)重悬,于冰上利用超声波破碎仪超声破碎处理5 min(超声3 s,关闭3 s,功率10 W),离心后分别取上清和沉淀,进行15% SDS-PAGE 分析,确定β2MG 在不同表达载体中表达的最佳诱导条件,其中pET-28a(+)载体的重组蛋白于37 ℃表达形式为 His-β2MG(相对分子质量 15 000),pET-32a(+)载体的重组蛋白于25 ℃表达形式为Trx-Hisβ2MG(相对分子质量30 000)。
1.5 重组β2MG 蛋白的扩大培养及纯化 取5 mL 菌液,接种于500 mL LB 液体培养基中扩大培养,按照最佳诱导温度诱导表达过夜,4 500 ×g离心15 min,收集菌体,加入蛋白缓冲液(25 mmol / L Tris-HCl,pH 8.5)重悬,6 000 ×g离心 20 min,弃上清,加入蛋白缓冲液,超声破碎处理30 min(超声3 s,间隔5 s,功率 10 W),10 000 ×g离心 15 min,收集纯上清表达菌株的上清液作为蛋白原液,直接过Ni 柱进行亲和纯化;若包涵体表达则收集沉淀部分,经洗涤、尿素溶解后作为蛋白原液,进行Ni 柱亲和纯化。收集各梯度蛋白洗脱液,分别取10 μL,经15%SDS-PAGE分析蛋白纯度,合并主峰蛋白液进行透析复性。
1.6 两种重组β2MG 蛋白活性的比较 采用间接ELISA 法。利用紫外分光光度法于nanodrop 仪测定蛋白浓度,加入酶标板(浓度为 25 μg / mL),4 ℃包被过夜;依次加入倍比稀释的羊源β2MG 多克隆抗体及 HRP 标记的兔抗羊 IgG(1 ∶10 000 稀释)作为一抗和二抗,37 ℃孵育1 h,使抗原抗体充分识别;加入100 μL TMB 显色液显色10 min;加入1% H2SO4溶液终止反应。于酶标仪波长450 nm 处读取吸光度值,比较不同载体表达的重组β2MG 蛋白之间的活性差异。
2 结 果
2.1 不同表达载体重组质粒的鉴定 重组表达质粒pET-28a(+)-β2MG和 pET-32a(+)-β2MG经 2%琼脂糖凝胶电泳分析,分别可见5 666、6 197 bp 的重组质粒片段,大小与预期相符;两种重组质粒β2MG基因的PCR 产物经2%琼脂糖凝胶电泳分析,可见297 bp 的特异性片段,大小与预期相符。见图1。测序结果经比对显示,插入片段的基因序列与预期一致,未发生突变。

图1 重组表达质粒的琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoretic profile of recombinant plasmids
2.2 重组表达菌株的鉴定 15% SDS-PAGE 分析显示,6 株 pET-28a(+)-β2MG/ BL21(DE3)重组菌在相对分子质量约15 000 处有明显的蛋白表达条带,6株 pET-32a(+)-β2MG/ BL21(DE3)重组菌在相对分子质量约30 000 处有明显的蛋白表达条带,大小均与理论值相符,见图2。
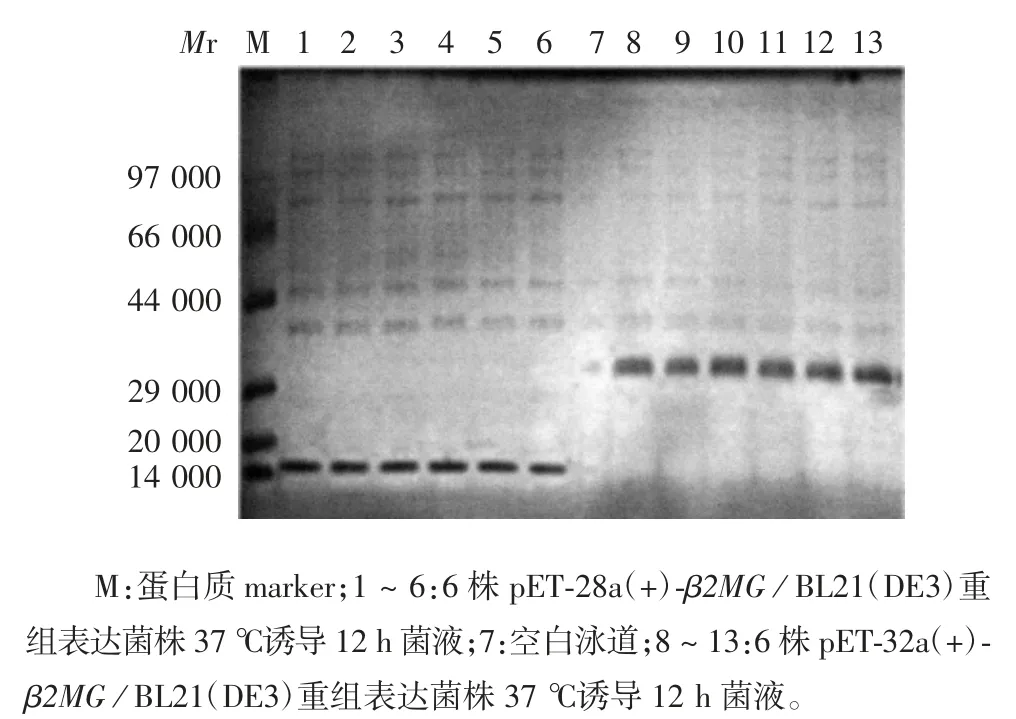
图2 重组表达菌株的鉴定Fig.2 Identification of recombinant bacterial strains
2.3 重组β2MG 蛋白的表达形式 15% SDS-PAGE分析显示,两种载体所表达的目的蛋白量相当,约占总蛋白的 65%。pET-32a(+)-β2MG/ BL21(DE3)于37 ℃诱导的上清和沉淀均有目的蛋白表达,而25 ℃诱导可实现全部上清表达;pET-28a(+)-β2MG/BL21(DE3)表达的目的蛋白无论低温或高温诱导均以包涵体形式存在。见图3。表明不同表达载体所表达的β2MG 溶解性不同。

图3 重组β2MG 蛋白表达形式的SDS-PAGE 分析Fig.3 Analysis of form of recombinant β2MG protein by SDS-PAGE
2.4 纯化蛋白的鉴定 15% SDS-PAGE 分析显示,纯化的重组β2MG 蛋白在相对分子质量约15 000和 30 000 处分别可见 His-β2MG 和 Trx-His-β2MG特异性条带,纯度可达95%以上,见图4。蛋白浓度约 3 mg / mL。
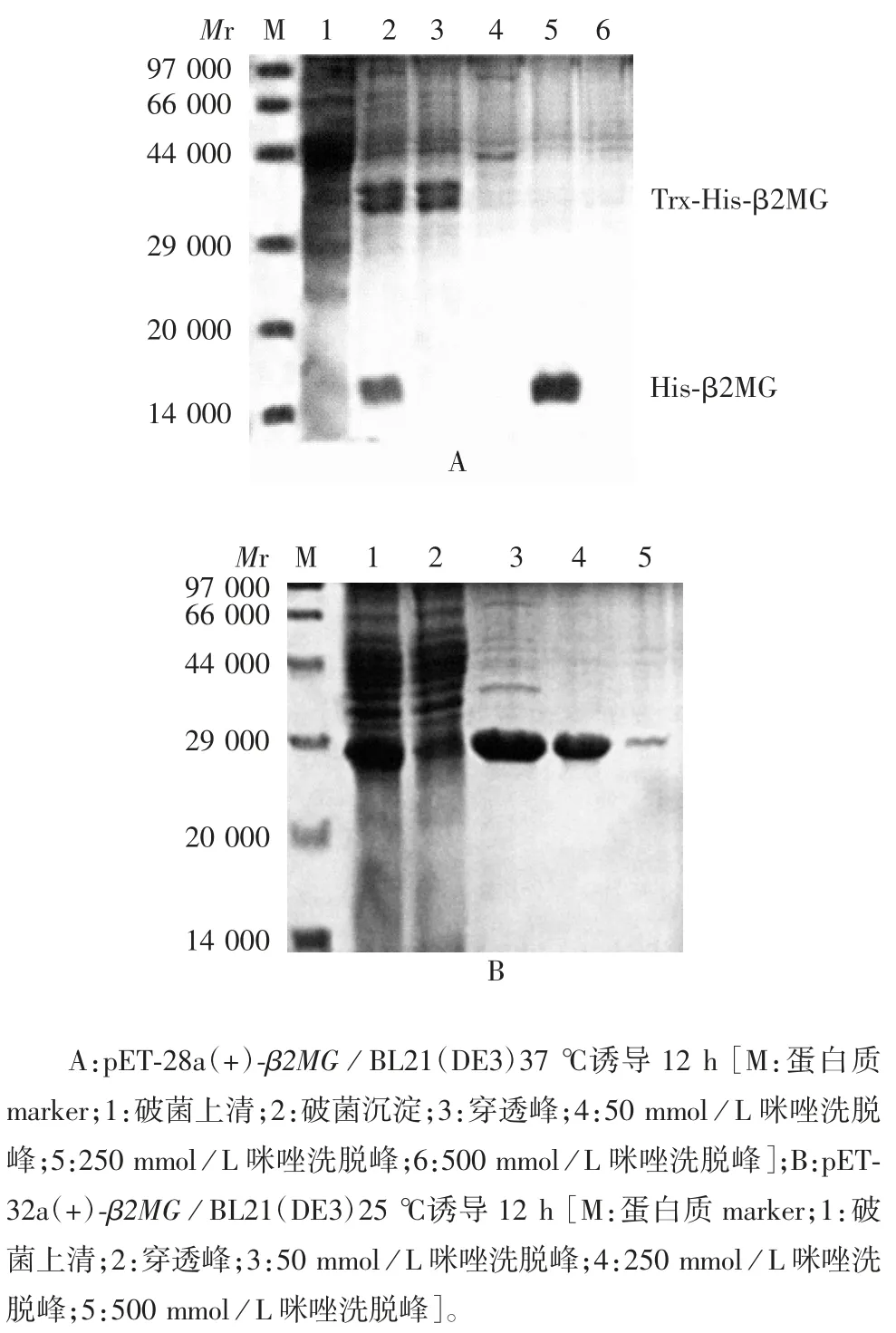
图4 纯化重组β2MG 蛋白的SDS-PAGE 分析Fig.4 SDS-PAGE profile of purified β2MG protein
2.5 两种重组β2MG 蛋白的活性比较 间接ELISA法检测结果显示,随着检测抗体浓度的升高,抗原抗体反应性整体呈上升趋势。与市售对标β2MG 相比,在相同检测抗体浓度下,自制重组蛋白His-β2MG与检测用羊源β2MG 多克隆抗体的免疫学反应性能略差,而自制重组蛋白Trx-His-β2MG 与检测抗体的免疫学反应性优于对标β2MG。见图5。表明不同表达载体对β2MG 的活性影响较明显。

图5 ELISA 法检测两种重组β2MG 蛋白的活性Fig.5 ELISA of activities of two recombinant β2MG proteins
3 讨 论
本研究应用基因重组技术将β2MG基因与不同载体连接,构建重组表达菌株,成功表达了Hisβ2MG 和 Trx-His-β2MG 两种重组蛋白,其中 Trx-Hisβ2MG 降低诱导温度可实现完全可溶性表达,表明低温诱导对获得可溶性表达具有促进作用,这可能是由于降低温度可放慢细胞内蛋白表达速率,分子聚集通常是由于高温下蛋白表达太快来不及正确折叠而形成,可见低温诱导是减小细胞内重组蛋白聚集的一个好方法[10]。通过分析两种蛋白在E.coliBL21(DE3)中的不同表达形式发现,β2MG 在相同的宿主细胞中表达形式不同与表达载体相关,这可能是由于不同表达载体中所含的N-端标签不同造成的,pET-32a(+)载体在 N-端含有增溶标签 Trx,该标签能促进二硫键正确配对,帮助蛋白进行正确折叠[11],有资料显示,Trx 作为增溶标签有利于蛋白的可溶性表达[12-13]。包涵体通常是由于蛋白瞬间表达量较高、蛋白错误折叠以及二硫键不能正确配对所导致,对于包涵体的一般处理方法是先变性,再通过合适的复性液进行透析复性,过程繁琐,且得到的蛋白活性不一定完整,因此,蛋白的包涵体表达在一定程度上限制了其生物学活性[14-16],这也合理解释了Trx-Hisβ2MG 的免疫学活性明显高于His-β2MG。
综上所述,本研究利用两种原核表达载体表达了重组人β2MG,表达的两种融合蛋白活性相差明显,且 Trx-His-β2MG 优于对标 β2MG,不同载体对β2MG 的活性影响较大,表明选择合适的表达载体是β2MG基因在大肠埃希菌中有效表达的一个重要影响因素[17]。本研究为进一步开展相关体外诊断试剂的研发及应用奠定了基础。

