乳腺癌超声弹性成像评分与免疫组化指标表达水平相关性分析
白玲娇,陈小军,王 婷
(延安市人民医院超声诊断科,陕西 延安 716000)
乳腺癌是女性常见的恶性肿瘤,其发生发展过程中,不同类型患者的发病原因、临床病理特征、治疗方式和预后均存在巨大差异[1]。早期确诊及疾病类型分析是影响治疗效果和生存时间的关键因素。近年来,随着有关乳腺癌分子生物学及个体精准化治疗的快速发展,以基因特性为基础的分子分型及免疫组化分析在乳腺癌诊疗中的作用越来越受重视[2],但基因特性分析和免疫组化指标测定材料获取、处理等过程繁琐,费用高,可重复性差。越来越多学者尝试通过分析患者影像学特征,预测乳腺癌患者免疫组化表达特性和分子分型[3-4]。超声弹性成像技术主要依据不同组织硬度差异,分析在外界刺激下组织所呈现出的弹性特性,从而客观定量评估组织特性的超声检查方式,具有无创、便捷、检出率高和可重复性强等优势[5]。以往报道均证实,超声弹性成像技术能全面评估肿瘤组织硬度,在乳腺影像报告和数据系统4类乳腺癌良恶性鉴别诊断中独具优势,从而为病情判断和治疗提供依据[6-7]。但关于超声弹性成像评分是否可用于乳腺癌免疫组化指标表达特性和分子分型的预测报道较为少见。鉴于此,本研究就超声弹性成像评分与乳腺癌免疫组化指标表达水平的相关性进行了分析,以期为寻求无创性乳腺癌生物学特性反应体系提供更多依据。
1 资料与方法
1.1 一般资料 收集2018年6月至2020年12月在延安人民医院就诊的乳腺癌疑似病例86例(96个乳腺肿块)患者临床资料为研究对象。病例纳入标准:≥18岁,初次就诊;超声检查前未接受穿刺活检,且未接受放疗、化疗等肿瘤相关治疗;均接受超声弹性成像检查和肿瘤病理检查;临床影像学和病理学检查等资料完整。排除标准:无法配合检查或乳腺内存在假体;肿块紧邻部位存在瘢痕;处于妊娠期;合并其他部位肿瘤。患者年龄29~67岁,平均(47.25±7.35)岁;肿块大小4.1~42.6 mm,平均(17.33±5.17)mm;病理检查结果:良性肿块27个,恶性肿块69个。
1.2 研究方法
1.2.1 超声弹性成像:使用GE LOGIO E9彩色超声诊断仪,使用高频探头对所有病灶区域进行纵、横、斜等多方位探查,探头频率设定为5~15 MHz,首先,选用常规超声模式探查可疑病灶大小、形态、回声和血供等情况;然后,调整为弹性成像程序,选择实时双幅模式,尽量保持探头垂直于皮肤,通过轻压-解压的手法,调控压放力度和检测频率,确保显示屏中所示质控量化参数品质因数(Quality Factor,QF)≥60,并调整取样框,保证取样框内包含乳腺肿块和其周围正常组织,且感兴趣区域尽量位于取样框中心。
1.2.2 免疫组化:手术或穿刺所取组织材料置于pH6.0,浓度为0.01 mmol/L的柠檬酸缓冲液中,96 ℃加热10 min;然后,加入浓度为30%的过氧化氢甲醇溶液,恒温培养30 min后,加入二氨基联苯胺(Diaminobenzidine,DAB,上海一基)作为一抗,于4 ℃下恒温孵育过夜;随后,加入雌激素受体(Estrogen receptor,ER)、孕激素受体(Progesterone receptor,PR)、人类表皮生长因子 2(Human epidermal growth factor receptor-2,HER-2)和Ki-67单克隆抗体(美国Sigma公司生产)作为二抗,放置于室温下孵育1 h;最后,采用DAB显色,苏木素复染细胞核,封片。
1.3 观察指标
1.3.1 超声弹性成像评分:超声弹性成像系统中弹性小的组织受压后会出现较大为宜变化,图像显示为红色,反之为蓝色[8]。采用改良超声弹性成像5分法评估疑似病灶的良恶性:成像显示病灶整体或大面积呈绿色=1分,成像显示病灶中心区蓝色、周边区域为绿色=2分,病灶内蓝绿相间,面积比接近1比1=3分,病灶整体呈蓝色,或内部散布少许绿色=4分,病灶区和周围均蓝色,内部伴有或不伴有绿色=5分,超声弹性成像评分≥4分判断为恶性,否则为良性病灶[9]。
1.3.2 免疫组化结果判读:邀请2名具有丰富经验的病理分析师进行阅片:肿瘤细胞核染色棕黄色颗粒占比≥10%,记为PR、ER阳性表达;染色阳性细胞占比≥14%,判定为Ki-67抗原高表达,否则为Ki-67低表达状态[10];细胞膜分子染色棕黄色或黄色为阳性,分别记为0、+、、,其中0、+记为HER-2阴性,记为HER-23阳性,则需进一步进行原位杂交基因扩增验证,基因扩增者为阳性,否则为阴性[11]。依据免疫组化指标表达水平,对恶性病灶进行分子分型:HER-2阴性、ER阳性和(或)PR阳性、Ki-67表达<14%为Luminal A型;HER-2阴性,ER阳性,同时满足PR阴性、Ki-67高表达中任意一项,或HER-2和ER表达均阳性,PR和Ki-67任一水平为Luminal B型;HER-2、PR、ER均阴性为Basal-like型[12]。
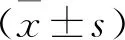
2 结 果
2.1 超声弹性成像评分在乳腺肿块良恶性诊断中的价值 见表1。经超声弹性成像评分判定为良性肿块34个,恶性肿块62个。以病理诊断结果为金标准,超声弹性成像评分判断恶性乳腺肿块的灵敏度为86.96%(60/69),特异性为92.59%(25/27),判断符合率为88.54%(85/96)。
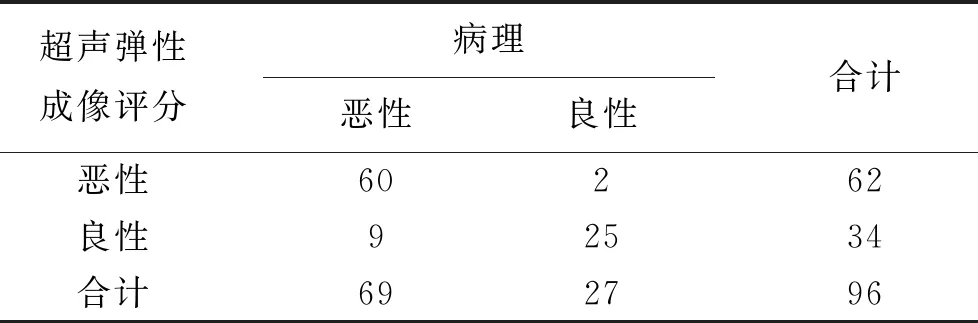
表1 超声弹性成像评分判断肿块良恶性的价值(例)
2.2 超声弹性成像评分与乳腺癌患者免疫组化指标相关性单因素分析 见表2。免疫组化PR阴性、HER-2阴性和Ki-67抗原高表达恶性肿瘤病灶的超声弹性成像评分显著高于PR阳性、HER-2阳性和Ki-67抗原低表达,差异具有统计学意义(P<0.05);免疫组化ER阳性与ER阴性及不同分子分型肿瘤病灶间的超声弹性成像评分间比较,差异无统计学意义(均P>0.05)。
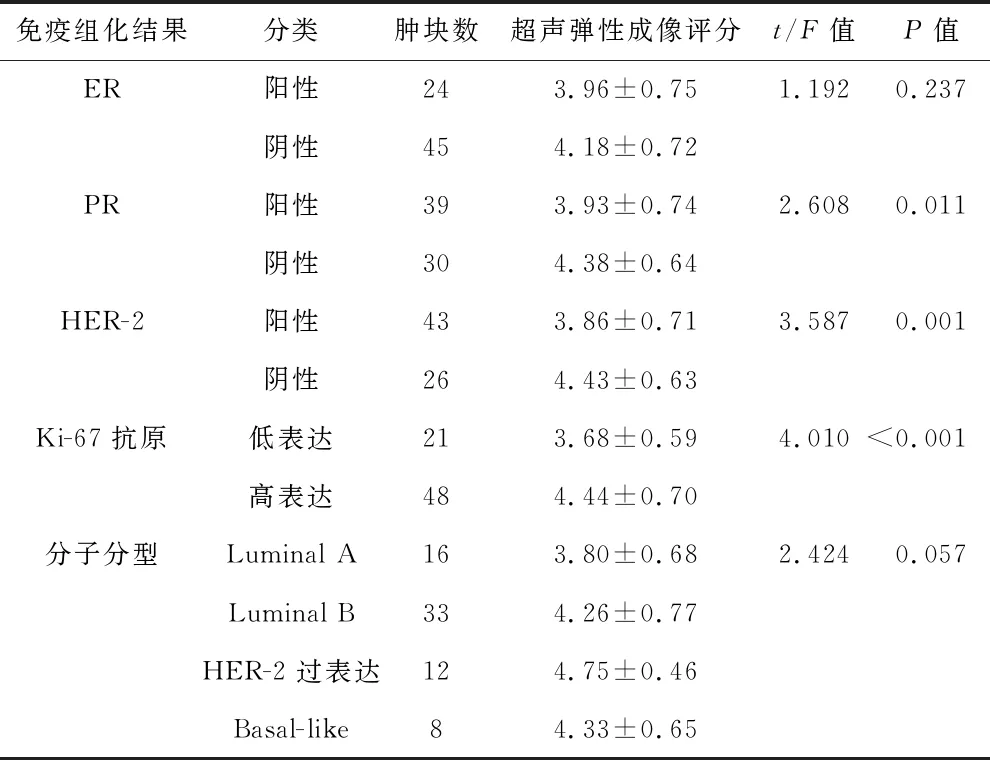
表2 超声弹性成像评分与乳腺癌患者免疫组化指标相关性单因素分析
2.3 超声弹性成像评分与免疫组化指标多元线性回归分析 见表3。将结果2中具有统计学意义的免疫指标作为自变量,超声弹性成像评分作为因变量,实施多元性回归分析,结果显示,超声弹性成像评分与免疫组化HER-2和Ki-67抗原表达情况间存在线性相关性,标准化回归系数β为0.376、0.316(均P<0.05)。

表3 超声弹性成像评分与免疫组化指标多元线性回归分析
3 讨 论
2018年Globocan数据显示,当年全球新发女性乳腺癌208.9万,死亡约62.7万,发病率和病死率均位居女性恶性肿瘤之首位。目前,虽然针对乳腺癌的研究较多,但关于其具体发病机制仍未完全明确,临床仍有60%左右患者未表现出明显危险因素[7]。但近年来针对癌症生物基因及免疫组化的相关研究提示,癌变的发生往往会引起机体免疫组化指标的异常变动,同时,癌变所致的炎症因子、肿瘤细胞因子等异常表达也会进一步刺激癌症细胞的增殖。临床积极开展生化指标研究,可为治疗方案确定及预后预测提供重要指导。但生化指标测定过程较为繁琐,且某些指标测定试剂或试剂盒费用高,导致其临床应用价值受一定限制。
报道显示,乳腺肿瘤良恶性及恶性程度均与组织硬度密切相关,恶性肿瘤病灶硬度约为良性病灶的2~3倍[13]。因此,针对肿瘤硬度的定量分析可为疾病类型判断及预后分析提供更多有用信息。弹性成像指对目标检测部位施加一项刺激,目标组织在此刺激作用下会做出满足生物力学和弹性力学的反应,从而客观准确的反应目标组织硬度,显著提高其在乳腺癌诊断中的准确性[6,14]。弹性成像评分属于超声弹性成像技术的量化指标之一,可较为准确的反应正常组织及病变组织间的相对硬度,恶性肿块质地较硬,弹性形变能力小,因此弹性成像评分较高;良性肿块质地柔软,弹性评分相对较低,良恶性肿块在硬度和组织弹性方面均存在较大差异,故临床可借助弹性成像评分对目标组织进行量化评估,为其良恶性鉴别诊断提供依据[15]。本研究纳入的96个疑似乳腺癌肿块经超声弹性成像评分判定为良性肿块34个,恶性肿块62个,以病理诊断结果为金标准显示,超声弹性成像评分判断恶性乳腺肿块的灵敏度为86.96%,特异性为92.59%,判断符合率为88.54%,与王凹弟等[9]报道结果基本一致。证实,超声弹性成像评分法在乳腺癌早期诊断中具有良好应用价值。目前虽关于弹性成像评分在乳腺癌诊断中的应用较多,但关于其评分是否能一定程度上反应局部生化指标表达情况,临床尚未明确。
乳腺癌属于激素依赖性(ER、PR)恶性肿瘤,其发生发展与机体内雌激素表达密切相关。PR是雌激素与其受体结合诱导分泌。HER-2作为乳腺癌和胃癌等预后判断的重要免疫组化指标,其过表达会导致患者临床特征及生物学行为出现特殊性,主要表现为肿瘤细胞增殖活跃,细胞代谢所需能量和氧气不足;刺激局部钙质分泌,导致肿瘤内发生钙化,肿块硬度增大[16];同时有研究证实,HER-2过表达能上调乳腺细胞血管生成相关因子表达,促进乳腺肿块内新生血管生成和肿瘤细胞增殖,从而增加肿块硬度[17]。Ki-67可表达于细胞增殖的各个时期,但在细胞静止期G0期不表达,故其高表达则表示局部细胞处于增殖活跃期,局部细胞快速增殖,并持续向胞外基质侵袭黏附,导致胞外基质黏连蛋白结构、功能异常,促使肿块与周围组织黏连,最终导致肿块弹性下降[18-19]。本研究通过单因素对比和多元线性回归分析显示,免疫组化PR阴性、HER-2阴性和Ki-67抗原高表达恶性肿瘤病灶的超声弹性成像评分显著高于PR阳性、HER-2阳性和Ki-67抗原低表达,超声弹性成像评分与HER-2和Ki-67抗原表达情况间存在线性相关性(β=0.345、0.376、0.316),提示乳腺组织中PR、HER-2和Ki-67抗原表达均会对超声弹性成像评分造成影响。
综上所述,超声弹性成像评分与乳腺癌免疫组化指标HER-2和Ki-67抗原表达情况存在相关性,故一定程度上可作为反映乳腺癌病灶生物学特性的影像学指标,为乳腺癌诊治及预后判断提供参考。

