UBE2C和UBE2T与胰腺癌患者预后及免疫细胞浸润的关系
于运亮,李婷,王莉莉,丛培英,封建凯
1 滨州医学院烟台附属医院检验科,山东烟台 264000;2 烟台山医院病理科
泛素—蛋白酶体途径是细胞内蛋白质选择性降解的重要途径,其中泛素结合酶E2在泛素化系统中具有重要作用,是蛋白质泛素化过程中必不可少的组成部分[1]。 泛素结合酶E2C(UBE2C)和E2T(UBE2T)是泛素结合酶E2家族的成员,对调控细胞有丝分裂、细胞周期、机体免疫反应等起重要作用[2-4]。研究指出,UBE2C 和UBE2T 与直肠癌[5]、肺癌[6]、前列腺癌[7]、胃癌[8]、肝癌[9]等多种肿瘤的发生发展密切相关。目前,关于UBE2C和UBE2T是否参与胰腺癌进展的研究较少。本研究利用Oncomine、TIMER、Kaplan-Meier plotter 等多种数据库综合分析UBE2C 和UBE2T 在胰腺癌中的表达水平及其与患者预后的关系,探讨两者在胰腺癌中的调控机制,并初步分析两基因在肿瘤微环境中的表达模式及与免疫细胞浸润的相关关系,为阐明UBE2C和UBE2T基因在胰腺癌发生发展中的作用奠定基础。
1 资料与方法
1.1 胰腺癌中UBE2C 和UBE2T 表达检测 从Oncomine 数据库中筛选目的基因,检索条件设置如下。 ①“Gene:UBE2C/UBE2T”;②“Analysis type:cancer vs. normal analysis”;③“Cancer type:Pancreat⁃ic cancer”;④“Date type:mRNA”;⑤临界筛选条件(P<0. 000 1,fold change>2. 0,gene rank=top 10%)。利用GEPIA2. 0 数据库“Expression DIY”模块分析胰腺癌不同亚型中两者的表达模式。使用EMBL-EBI数据库中的“Gene expression”模块检测UBE2C 和UBE2T的mRNA在25种胰腺癌细胞系中的表达情况。
1.2 UBE2C 和UBE2T 表达与胰腺癌患者预后分析 利用GEPIA 的“Survival”模块检测UBE2C和UBE2T 基因的表达与胰腺癌患者总生存期和无病生存期的关系。采用Kaplan-Meier plotter 中“pan-cancer”模块在线分析不同临床病理特征的胰腺导管癌患者UBE2C 和UBE2T 的表达与其总生存期的关系。
1.3 胰腺癌UBE2C和UBE2T共表达基因的富集分析 利用Oncomine 数据库筛选胰腺癌中与UBE2C和UBE2T 相关的前150个共表达基因[10],同时使用cBioPortal数据分析平台下载两基因共表达基因集中的前150个基因(数据集来源:Pancreatic adenocarci⁃noma,TCGA,Firehose Legacy)。使用FunRich软件对Oncomine和cBioPortal包括UBE2T和UBE2C的共表达数据集取交集,进一步获得共表达基因,随后对这些基因进行GO功能注释和KEGG通路分析,分析两基因参与的生物学进程、功能、信号通路等内容。
1.4 UBE2C 和UBE2T 共表达基因互作网络的构建及核心(Hub)基因的筛选 使用String 数据库构建共表达基因蛋白互作网络,物种选择类型为“Homo sapiens”,置信度选择“Medium 0. 400”,相互作用最大数选择10,得到基因的相互作用网络后将数据导入至Cytoscape 软件。 采用Cytoscape 软件中的“Cytohubba”插件挑选出与周围基因具有高度连通性的前10个基因作为Hub 基因,随后根据互作节点的数量的度值降序进行排序。使用GEPIA 中的“Survival”模块分析Hub 基因的表达与胰腺癌患者总生存期之间的关系。
1.5 UBE2C 和UBE2T 表达与胰腺癌患者免疫细胞浸润的相关性分析 选取TIMER 数据库中的“Gene”模块检测在胰腺癌中UBE2C 和UBE2T 基因的表达与肿瘤纯度及6种免疫细胞(B细胞、CD4+T细胞、CD8+T 细胞、巨噬细胞、中性粒细胞和树突状细胞)浸润之间的关系,选取GEPIA 的“Correlation”模块检测两基因与巨噬细胞标记基因的关系。
1.6 统计学方法 采用SPSS21. 0 和R3. 6. 3 软件对数据进行统计分析;使用t检验分析UBE2C 及UBE2T 在正常胰腺组织和胰腺癌组织之间的表达差异;使用GEPIA2. 0 和Kaplan-Meier 图绘制胰腺癌患者生存曲线,比较采用Log-Rank 检验;使用Spear⁃man 法分析胰腺癌中UBE2C 与UBE2T 的相关性,并分析两基因的表达与免疫细胞及其标记基因的相关性。P<0. 05为差异有统计学意义。
2 结果
2.1 UBE2C 和UBE2T 在胰腺癌中的表达情况 根据前文的筛选条件,本研究最终得到2个数据集涉及UBE2C 和UBE2T 在胰腺癌组织和正常胰腺组织中的表达情况[10-11]。 其中PEI 等[10]的研究显示,UBE2C 和UBE2T 在36例胰腺癌组织中的表达高于16例正常胰腺组织(P<0. 05);LACOBUZIO-DONA⁃HUE等[11]的研究显示,UBE2C在31例胰腺癌组织中的表达高于5例正常胰腺组织(P<0. 05)。
GEPIA2. 0 数据库显示UBE2C 和UBE2T 在179例胰腺癌组织中的表达高于171例正常胰腺组织(P<0. 05)。两基因在胰腺癌基底细胞型(65例)和经典型(86例)两种亚型中的表达同样高于171例正常胰腺组织(P均<0. 05)。
EMBL-EBI 数据库显示UBE2C 在21 种胰腺癌细胞系中表达相对较高,而UBE2T 在KP-2、Hs 766T、PA-TU-8902 等细胞系中表达相对较高,两者在KP-2等细胞株中表达均上调(图1)。

图1 UBE2C和UBE2T在25种胰腺癌细胞系中的表达情况
2.2 UBE2C 和UBE2T 表达与胰腺癌患者临床病理参数的关系 在GEPIA 数据库“Survival”模块中,关于UBE2T 和UBE2C 高表达和低表达的胰腺癌患者各收集了89例,其中UBE2C 和UBE2T 高表达患者总生存期和无病生存期均缩短,高表达两基因的胰腺癌患者预后不良(P均<0. 05)。
Kaplan-Meier plotter 数据库结果显示,整体来看,与低表达患者相比,高表达UBE2C 和UBE2T 的胰腺导管癌患者总生存期均缩短(P均<0. 05)。亚组分析结果见表1。
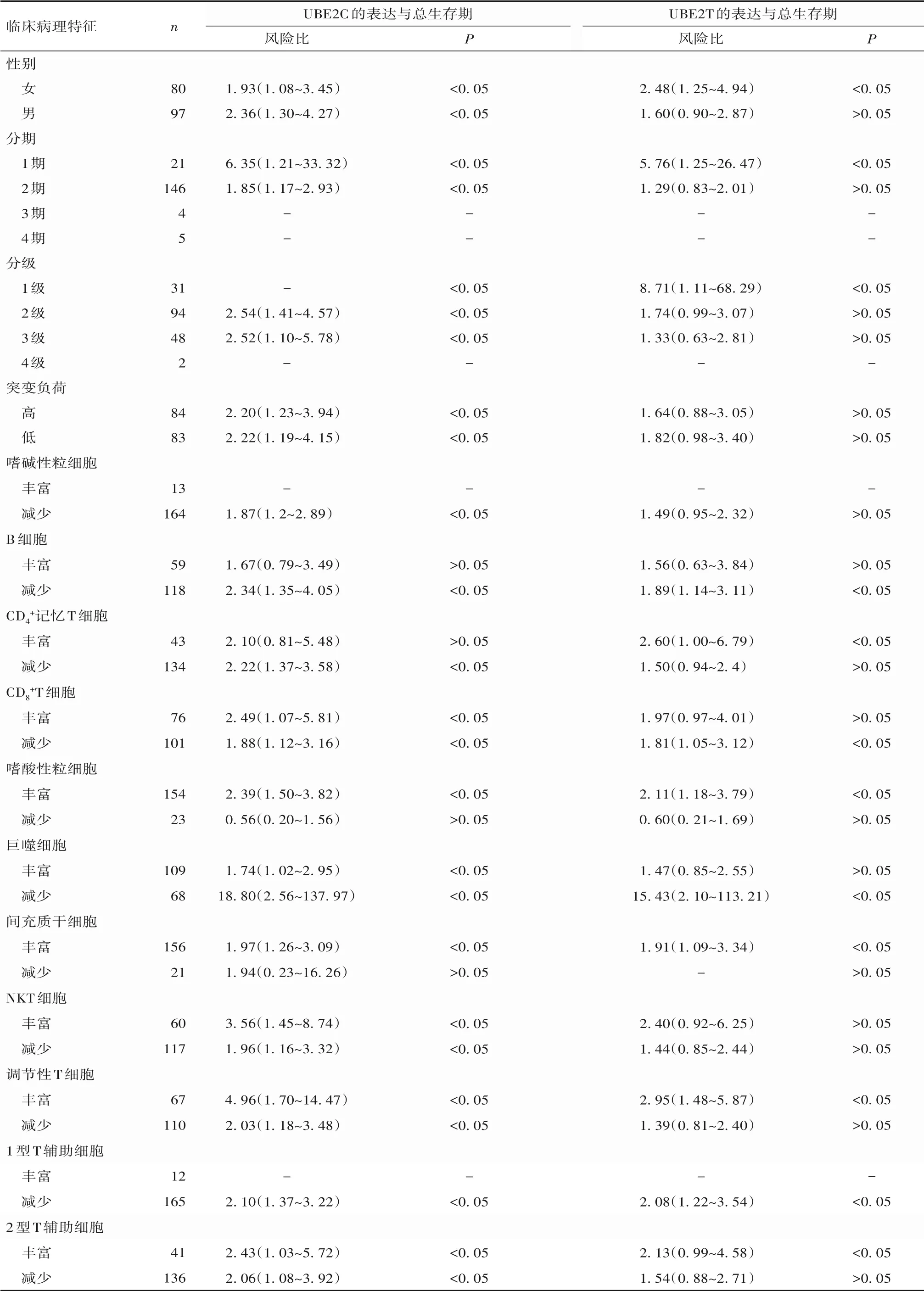
表1 基于不同临床病理特征分析UBE2C和UBE2T表达与胰腺导管癌患者总生存期之间的关系
2.3 UBE2C和UBE2T在胰腺癌中的相关性 GEPIA结果发现UBE2C 和UBE2T 在胰腺癌中高度相关(r=0. 82,P<0. 001)。TIMER 数据库同样显示两基因在胰腺癌中存在正相关关系(r=0. 803,P<0. 001)。
2.4 胰腺癌中UBE2C和UBE2T共表达基因的富集分析结果 Oncomine 和cBioPortal 数据库包括UBE2T 和UBE2C 的有4个共表达数据集,与4个数据集都有交集的共表达基因共有59个。这些共表达基因具有丝氨酸/苏氨酸蛋白激酶的激活、调控机体运动的分子生物学功能(P<0. 05),主要参与细胞周期、纺锤体组装的生物学过程(P<0. 05),主要参与构成染色体、着丝点、微管等结构(P<0. 05),在细胞周期、Aurora-B 信号通路、DNA 复制、M 期/M-M/G1期等信号通路中富集(P<0. 05)。
2.5 胰腺癌中UBE2C和UBE2T共表达基因互作网络及Hub 基因UBE2C 和UBE2T 共表达基因互作网络见图2。 Hub 基 因 有PBK、CEP55、BIRC5、MELK、CDK1、NUSAP1、TPX2、BUB1、TOP2A 和BUB1B,主要参与细胞器裂变、核分裂、有丝分裂、细胞周期等生物学过程,Hub 基因与胰腺癌患者预后的关系见表2。
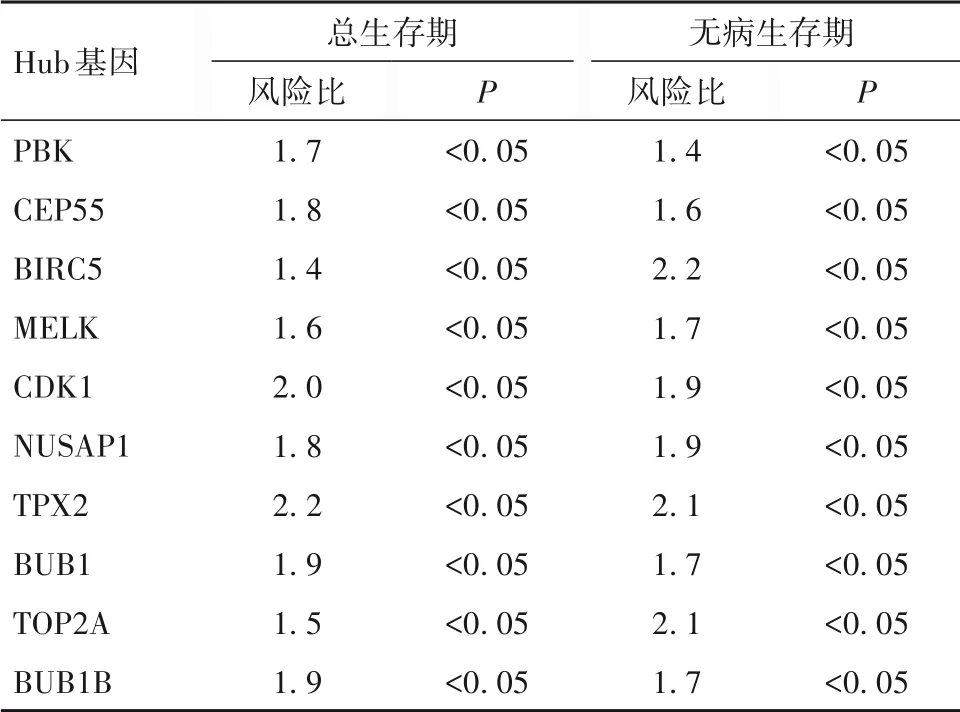
表2 Hub基因的表达与胰腺癌患者预后的关系
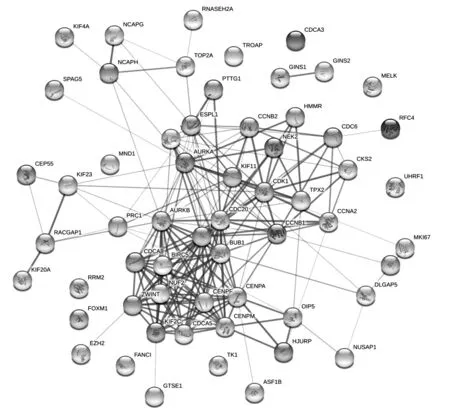
图2 共表达基因的蛋白互作网络
2.6 UBE2C 和UBE2T 表达与胰腺癌患者免疫细胞浸润的关系 UBE2C 与CD8+T 细胞(r=-0. 161,P<0. 05)和巨噬细胞(r=-0. 222,P<0. 05)呈弱负相关;UBE2T 与CD4+T 细胞(r=-0. 202,P<0. 05)和巨噬细胞(r=-0. 221,P<0. 05)呈弱负相关。
UBE2C 和UBE2T的表达与CCL2、IL10 和MS4A4A 呈弱负相关关系,而与PTGS2 呈弱正相关关系(P<0. 05),见表3。
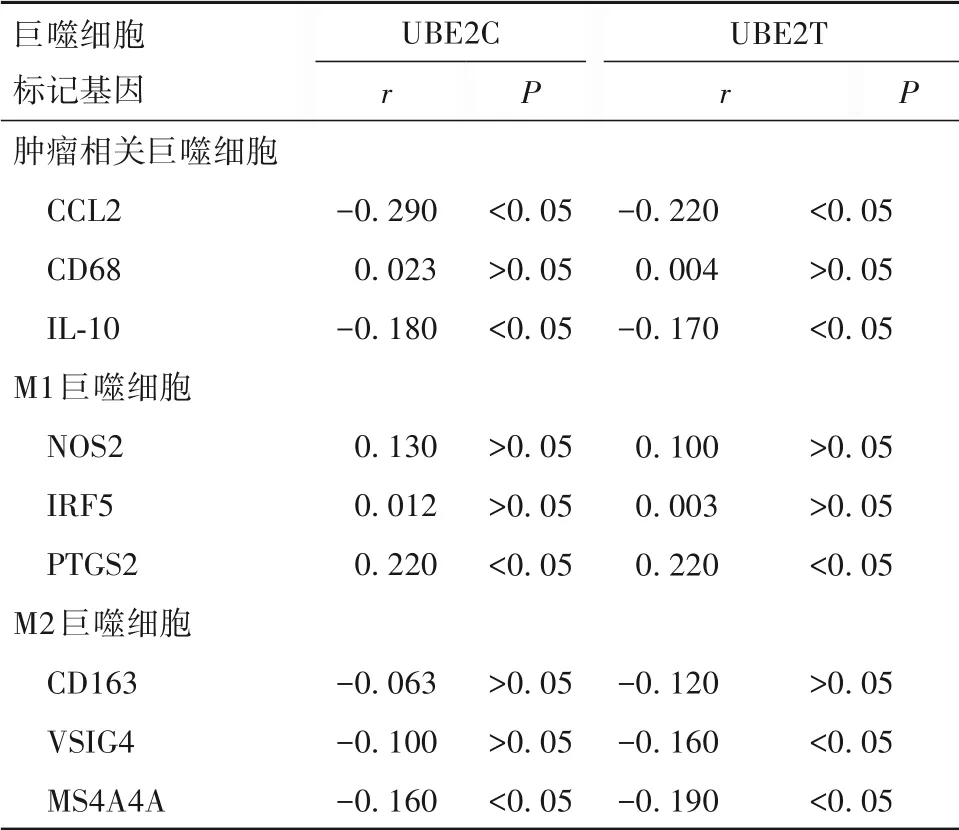
表3 UBE2C和UBE2T与胰腺癌中巨噬细胞标记基因的相关性
3 讨论
作为世界范围内病死率最高的恶性肿瘤之一,胰腺癌严重威胁人类的生命健康[12]。胰腺癌具有多种组织学类型和生物学特征,总体预后较差,寻找新的胰腺癌早期诊断方法及治疗手段仍然是临床亟待解决的问题。随着生物信息学、肿瘤免疫学技术的迅猛发展,非特异性免疫刺激剂、靶向治疗以及肿瘤疫苗等治疗胰腺癌的方法已逐渐成为胰腺癌综合治疗的重要组成部分[13]。
UBE2C 和UBE2T 与多种肿瘤的增殖、迁移、侵袭、免疫反应等密切相关[4-9]。本研究综合分析多种公共癌症数据库,发现UBE2C和UBE2T同样在胰腺癌组织中表达上调,在胰腺癌基底细胞亚型和经典亚型组织中的表达也显著上调,而且在常见的20多种胰腺癌细胞系中高表达,说明两基因在胰腺癌组织和细胞水平均高表达。通过对不同临床病理因素胰腺癌患者进行生存分析发现,UBE2C 和UBE2T高表达的胰腺癌患者总生存期和无病生存期均缩短,提示两者同样在胰腺癌中扮演促癌因子的角色,与之前两者在其他肿瘤中的研究相似[5-9]。胰腺导管癌是最常见的胰腺肿瘤,占胰腺肿瘤的85%~90%[14]。本研究发现两基因高表达的女性、1 期或1级胰腺导管癌患者的总生存期均显著缩短,预后较差;两基因高表达的B细胞、CD8+T细胞、巨噬细胞含量减少的患者,以及嗜酸粒细胞、间充质干细胞等含量丰富的胰腺导管癌患者的总生存期同样显著缩短。由此可见,UBE2C 和UBE2T 与肿瘤微环境中的免疫细胞密切相关,两者很可能参与肿瘤细胞的免疫逃逸和免疫抑制过程。
本研究利用GEPIA 和TIMER 数据库分析UBE2C 和UBE2T 的相关性,结果发现两基因在胰腺癌中表达高度相关,提示两者可能在胰腺癌中具有协同调控作用。既往研究证实,泛素结合酶E2家族很多分子参与肿瘤细胞周期调节、细胞分化、DNA损伤修复等过程。本研究通过对共表达基因进行筛选和富集分析发现,胰腺癌中UBE2C和UBE2T共表达的基因主要富集于细胞周期、DNA 复制过程中,与之前关于两基因功能的研究一致[3-4]。另外,通过筛选Hub 基因发现PBK、CEP55、BRIC5 等分子主要参与细胞周期、有丝分裂生物学过程,而且这些分子在胰腺癌中高表达,与胰腺癌患者预后不良有关,进一步提示UBE2T 和UBE2C 可能在胰腺癌细胞异常增殖过程中发挥重要调控作用。综上所述,UBE2C和UBE2T 很可能协同调控胰腺癌细胞的增殖和凋亡过程进而促进胰腺癌的进展。
肿瘤微环境具有复杂性和多样性的特点,而自身免疫系统在对抗肿瘤的过程中至关重要,通过分析肿瘤免疫系统将有助于改善免疫治疗的反应性。将大规模公共转录组学数据挖掘,应用于癌症免疫研究与癌症免疫治疗已成为肿瘤免疫领域的热点。大量研究表明,胰腺癌浸润的巨噬免疫细胞与患者的预后有关,并在抑制或促进肿瘤的发生发展、肿瘤免疫监视、肿瘤免疫逃逸等多种过程中发挥重要作用[15-16]。利用TIMER 数据库对胰腺癌肿瘤微环境中免疫细胞浸润程度进行分析,发现UBE2C 和UBE2T的表达均与巨噬细胞浸润呈负相关关系。研究证实巨噬细胞具有促进或抑制癌细胞生长、转移、促进血管生成、免疫抑制等多重作用。本研究发现UBE2C和UBE2T 不仅与巨噬细胞浸润程度有关,而且与巨噬细胞标记基因CCL2、IL-10 具有一定相关关系。研究证实阻断CCL2 可抑制巨噬细胞聚集,从而影响肿瘤的转移和生长[17]。IL-10 被证实参与调节胰腺癌细胞的生长、分化、炎性反应和免疫反应等过程,其能够抑制巨噬细胞在受到促炎性刺激后发生的代谢程序的改变[18]。MS4A4A 也被证实在巨噬细胞分化、激活、极化等过程中具有选择性表达的作用,是调控巨噬细胞的重要分子[19]。本研究发现UBE2C 和UBE2T 与CCL2、IL-10 和MS4A4A 呈明显负相关关系,说明两基因很可能通过调控巨噬细胞分化、激活过程进而调控胰腺癌免疫应答机制,但两者发挥作用的具体机制还需进一步阐明。免疫疗法旨在利用人体自身的免疫系统对抗肿瘤细胞,肿瘤中浸润的免疫细胞最有可能作为药物靶标来提高患者的生存率。通过激活巨噬细胞以达到抗肿瘤免疫治疗效果的研究备受关注,深入了解UBE2C 和UBE2T 在胰腺癌中与肿瘤巨噬细胞的作用及其作用机制必将对胰腺癌的治疗产生深远的影响。
综上所述,本研究明确了UBE2C和UBE2T在胰腺癌中的表达模式,证实两基因在胰腺癌中高表达与患者预后不良密切相关。UBE2C 和UBE2T 很可能协同调控胰腺癌细胞周期、DNA 复制、细胞增殖进而影响胰腺癌的进展。UBE2C 和UBE2T 的表达与多种免疫细胞尤其是巨噬细胞浸润密切相关,提示两者在胰腺癌免疫治疗方面具有重要的研究价值,为胰腺癌治疗的免疫机制研究提供了新的见解和思路。UBE2C 和UBE2T 有望成为胰腺癌免疫治疗的新靶点和预后标志物,但两者在胰腺癌中发挥作用的具体机制还需要进一步探究。

