马蜂内生酵母种群结构分析及Metschnikowia pulcherrima的分离和鉴定
余 蔓,雷勇辉,孙燕飞,熊 杰,李 杨*
(1.石河子大学生命科学学院,新疆石河子 832003;2.石河子大学农学院,新疆石河子 832003)
昆虫体内栖息着一些特殊的内生微生物,在长期协同进化过程中,内生微生物有利于昆虫的适应与生存,还对昆虫的营养代谢、生长发育、生殖行为、免疫抗病等生命过程产生重要影响(王爱静等,2000,张振宇等,2017)。
昆虫内生酵母是昆虫内生微生物中的常见类群之一。近年来,在介壳虫等昆虫体内先后发现许多内生酵母新种(Heetal.,2013;Oliveiraetal.,2014;Renetal.,2015;Liuetal.,2016)。在东亚飞蝗Locustamigratoriamanilensis体内发现有掷孢酵母属Sporobolomyces和拟威尔嗜杀酵母属Cyberlindnera(刘开平等,2018)。刺腿食蚜蝇IschiodonscutellarisFabricius体内含有的酵母种群也十分丰富(米桃桃等,2019)。这些昆虫内生酵母菌具有特殊的生理生化特性,例如褐飞虱Nilaparvamlugens体内含有一种酵母可将尿酸转化为氨基酸供给宿主昆虫营养(侯云等,2013),某些内生酵母还具有分解木聚糖的特性(Oliveiraetal.,2014)。
马蜂VespavelutinaSmith是一种广泛分布的群居社会性昆虫。马蜂主要以鳞翅目幼虫为食,因而可被应用于有效防治棉铃虫HelicoverpaarmigeraHübner等农业害虫(李铁生,1987)。最近有研究报道马蜂肠道内含有可抑制反枝苋Amaranthusretroflexus的11种丝状真菌(张蕴等,2015)。然而,截止目前,关于马蜂内生酵母的种类组成及多样性研究,尚未见报道。本文以新疆石河子本地采集的马蜂为材料,通过高通量测序技术分析了马蜂内生酵母种群组成,并对菌株进行了分离纯化和初步鉴定。本研究将为马蜂内生酵母的生理功能研究及酵母菌资源开发和应用奠定基础。
1 材料与方法
1.1 马蜂采集
2019年8月在新疆石河子西公园草坪上,用捕虫网捕获得30头马蜂,将捕获的马蜂装入含乙醚的离心管中,带回实验室,冰箱保存备用。
1.2 培养基
(1)马铃薯葡萄糖培养基:马铃薯20.0%,葡萄糖2.0%,琼脂2.0%,pH6.0(玛依古丽·库尔班等,2015)。
(2)生理生化培养基:参照2011年《The Yeast:A taxonomic study》的方法配制碳源同化基础培养基、糖类发酵基础培养基、尿素培养基、无维生素培养基(周新丽等,2011)。
1.3 实验方法
1.3.1马蜂内生酵母高通量测序分析
挑选30头马蜂,浸泡在75%乙醇中30 min,在超净工作台用无菌水冲洗3次,加适量无菌水,用研钵研磨成匀浆,滤纸片过滤,再用0.45 μm过滤膜真空抽滤,最后将滤膜送至美吉公司测序。通过Illumina(MiSeq)平台,以NL-1、NL-2测序引物进行26S rDNA高通量测序(Robnettetal.,2013)。在97%的相似度下,利用软件QIIME(v.1.8.0)统计样品中每个操作分类单位(operational taxonomic unit,OTU)物种丰富度信息,并对测序结果进行Alpha多样性分析,其中包括Shannon多样性指数(Shannon diversity index)、Simpson多样性指数(The Simpson index)、Chao1丰富度估计指数(The Chao1 estimator)、ACE丰富度估计指数(The ACE estimator)(焦晶凯等,2014)。
1.3.2可培养酵母的分离纯化
将虫体研磨匀浆,吸取1 mL液体,按梯度稀释,取适当稀释度液体100 μL涂布于马铃薯葡萄糖培养基上,28℃培养2~3 d,挑取初步确认为酵母单菌落,平板划线纯化2~3次。将分离纯化的酵母菌株置4℃斜面保藏。
1.3.3菌株鉴定
(1)观察菌株菌落和细胞形态,并参照2011年《The Yeast :A taxonomic study》进行生理生化指标测定(糖发酵、碳同化、无维生素培养试验等)。
(2)菌株经液体培养后,收集菌体,采用buffer快速抽提法提取基因组DNA(郭奕惠等,2006),以基因组DNA为模板,PCR扩增26S rDNA序列。PCR扩增体系:ddH2O 14.75 μL,10×Taq buffer 2 μL,dNTP 1.5 μL,MgCl21 μL,上游引物NL-1(5′-GCATATCAATAAGCGGAGG AAAAG-3′)1 μL,下游引物NL-4(5′-GGTCCG TGTTTCAAGACGG-3')1 μL,模板DNA 2.5 μL,Taq酶0.25 μL。PCR条件:94℃ 10 min,94℃ 1 min,56℃ 1 min,72℃ 1.5 min,30个循环。PCR产物经凝胶电泳检测条带正确后,送至上海生工生物公司进行测序,将测序所得26S rDNA序列与GenBank中的序列进行比对,利用MEGA-X软件进行系统发育分析并构建系统发育树。
2 结果与分析
2.1 马蜂内生酵母高通量测序多样性分析及Alpha多样性分析
通过Illumina(MiSeq)平台对马蜂样品中提取的DNA进行26S rDNA高通量测序分析并优化,通过OTU聚类分析,真菌的OTU数分别为11个门、25个纲、42个目、49个科、54个属、60个种,未分类2个;与2011年《The Yeast :A taxonomic study》和GenBank数据库新种对比后,并进一步优化分类鉴定,内生酵母含有3个门、6个纲、7个目、8个科、10个属、10个种(表1,表2),酵母类OUT数在真菌OTU总数的所占比例大于或等于0.5%。
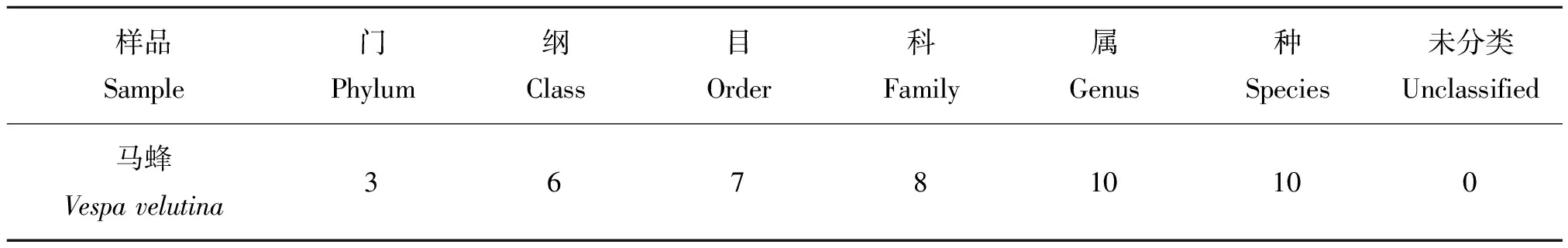
表1 各OTU上酵母类群统计结果

表2 马蜂内生酵母类群属水平分布情况
在属的水平上,Cutaneotrichosporon为内生酵母菌的优势属,占70.05%,孢圆酵母属Torulaspora占19.78%,Sporidiobolales-unclassified占5.88%,毕赤酵母属Pichia占1.34%,而酵母菌属Saccharomyces、Pseudozyma、拟威尔嗜杀酵母属Cyberlindnera、黑粉菌属Filobasidium、Pleurostylic和金担子菌属Aureobasidium占比例都小于1%。
在种的水平上,马蜂内生酵母共有10个种,其中,Cutaneotrichosporoncutaneum和Torulasporadelbrueckii及Sporidiobolalessp.为优势种,所占比例依次为54%、30%和9%,其余7个种所占比例较小,都小于2%(表3);而Sporidiobolalessp.属于未鉴定的种,很可能是一种酵母新种。总体上,马蜂体内内生酵母种群组成多样,且分布不均。

表3 马蜂内生酵母类群种水平分布情况
通过软件QIIME(v.1.8.0)对样品进行Alpha多样性分析,结果如表4所示。ACE指数84.38456,Chao1指数76,表明马蜂内生酵母种群多样性较高,丰富度较大;Shannon指数为0.619215,Simpson指数为0.681265,显示内生酵母种群均匀度适中。

表4 马蜂内生菌群微生物多样性
2.2 可培养酵母菌株形态特征与生理生化特征
通过稀释平板分离纯化,获得一株酵母菌,命名为MF-17菌株,经菌落、细胞形态特征观察,菌株MF-17菌落红色圆形状奶油质地,边缘整齐,表面光滑湿润,侧面凸起,细胞大小为5~10 μm,细胞形态呈卵圆形,无性生殖为单端芽殖(图1)。
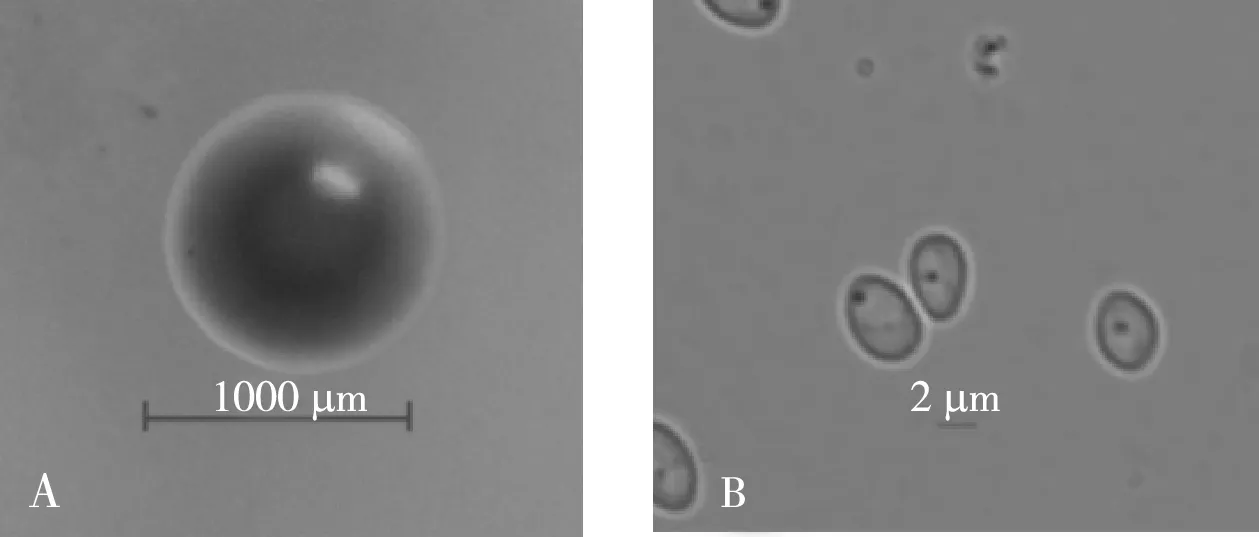
图1 MF-17菌株的菌落和细胞形态
菌株MF-17的糖类发酵及其它生理生化指检测结果如表5所示。在无维生素培养基上菌株MF-17不能生长;菌株最高生长温度可达40℃;菌株因不产生尿素酶而不能分解利用尿素。糖发酵试验结果显示,菌株MF-17可分解利用葡萄糖发酵产酸产气,而在以乳糖、麦芽糖、蔗糖、淀粉等6种糖为碳源的培养基中却不能产酸产气。

表5 MF-17菌株生理生化测定结果
碳源同化结果如表6所示,在有氧条件下,菌株MF-17可以利用半乳糖、麦芽糖、蔗糖、松三糖及甘油,而不能利用鼠李糖、棉子糖和阿拉伯糖。在无氧发酵和有氧状态下,菌株对麦芽糖、蔗糖的分解利用能力存在差异,表明菌体在不同条件下对同一底物的分解利用可能存在多种不同的分解机制。对照菌种鉴定手册,综合形态特征及生理生化特征检测结果,初步鉴定菌株MF-17属于Metschnikowia。

表6 MF-17菌株碳源同化结果
2.3 基于26S rDNA D1/D2区序列系统发育树分析
以MF-17菌株基因组DNA为模板,以通用引物扩增26S rDNA的D1/D2区,获得序列为516 bp,测序结果与GenBank数据库已知序列比对,结果显示,MF-17菌株与菌株Metschnikowiapulcherrima(KY108494.1)序列同源性高达98.785 %。
利用MEGA-X构建系统发育树,如图2所示,MF-17菌株在系统发育树上与M.pulcherrima(KY108494.1)菌株处于同一进化分支,与基于生理生化特征的鉴定结果基本相符。综合形态、生理生化特征及分子系统发育分析结果,可确定菌株MF-17为M.pulcherrima。
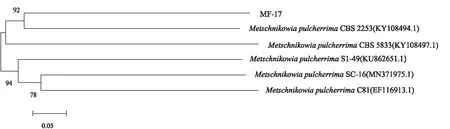
图2 MF-17菌株系统发育树
3 结论与讨论
迄今为止,高通量测序技术是研究特定生境微生物群落组成及物种多样性的有效方法。本研究利用高通量测序技术测定新疆石河子的马蜂内生酵母种群组成及丰度,内生酵母共10个属,内生酵母种类组成多样,但具体种属丰度相差较大。其中Cutaneotrichosporon为优势属,占比70.05%。此外,在样品中测得一种未能鉴定到种的酵母Sporidiobolalessp.,可能为潜在的酵母新种资源。
理论上,通过稀释平板分离方法可分离昆虫体内的大多数或部分内生酵母(米桃桃等,2019),但本研究从马蜂体内未能分离获得高通量分析结果显示的酵母优势种。可能的原因是优势种内生酵母对昆虫体内环境依赖性较强,在与自然生境条件明显不同的实验室培养条件下,酵母菌不能离体生长(廖丽花,2018);此外,也可能因为内生酵母对营养、温度、pH、氧气等可能有复杂而特殊需求,而用常规的PDA培养基分离方法不能获得酵母菌培养物;再者,内生酵母在离体培养条件下由于环境不适而生长缓慢,导致在一定短时间内无法形成肉眼可见的单菌落,因而可能被忽略。
本研究从马蜂体内分离了一株内生酵母MF-17菌株,鉴定为M.pulcherrima。菌株MF-17最高生长温度比对照菌株M.pulcherrima(KY108494.1)稍高,可能与长期适应昆虫体内特殊环境有关。据研究报道,M.pulcherrima属于一种非酿酒酵母,分泌胞外酶能力强,多附生于植物体表,有拮抗植物病害的作用,也是使酿酒增香或变质的因素(Esteve-Zarzosoetal.,1998;Schenaetal.,2000;Spadaroetal.,2002;Jollyetal.,2006)。也有少数报道在昆虫或其它动物体分离到M.pulcherrima,例如,果蝇体内也含有梅奇酵母属Metschnikowia,且两者有密切的联系,利用这种关系可以研发引诱剂并参与到农业病虫害防治中(Hamby,2012)。本研究从马蜂体内也分离出了此属酵母,后续可深入研究,挖掘其在植物病虫害防治或果酒酿造方面可能的应用潜力。
然而,平板分离获得的M.pulcherrima并不存于先前的高通量测序结果显示的10个酵母种之中。据推测,在高通量测序时,因PCR扩增过程的微量碱基错配,高通量测序结果出现偏差,可能导致某些酵母菌种未能检测到(张帆等,2019)。此外,由于不同马蜂个体内生酵母种类存在差异或采样批次不同,可能导致高通量测序样品和分离样品存在差异。其实,平板分离纯化获得菌与高通量分析结果不一致的情况,在其他类似研究也屡次被报道。最近有研究揭示在二月兰Orychophragmusviolaceus、龟甲饮片中分离真菌与高通量测序分析结果不尽相符(张帆等,2019,肖博文等,2020)。高通量测序分析法与平板分离法相结合,才可能相对较全面准确地认识昆虫内生微生物种群构成及丰富度分布特点。严格地说,由于本研究采集的马蜂样品有限,实验结果虽然并不能全面准确地反映马蜂内生酵母的种群组成实际情况,但在一定程度上,也体现了马蜂内生酵母组成的多样性特点。本研究通过平板分离方法只分离得到的一株内生酵母菌株,在后续研究中,可考虑模拟内生菌自然生境条件,通过对培养基、生长温度、pH等条件优化,有望分离到更多的内生酵母。

