曲妥珠单抗致女性乳腺癌患者心脏毒性风险Meta分析*
魏 华,张永俊,郑咏池,藕顺龙,颜晓燕,蒋 倩△
(1.四川省都江堰市人民医院,四川 成都 611830;2.成都医学院,四川 成都 610500;3.四川省肿瘤医院·电子科技大学医学院附属肿瘤医院,四川 成都 610041)
乳腺癌的发病率和死亡率居女性恶性肿瘤首位[1],预计到2035年,我国乳腺癌的发病例数将超25万例,较2012年增加34.4%[2-3]。20%~30%乳腺癌患者的人表皮生长因子受体2(HER2)呈过表达(简称HER2阳性乳腺癌),其侵袭性强,易复发转移,化学治疗(简称化疗)缓解期短,预后生存期差[4]。曲妥珠单抗为HER2阳性乳腺癌的一线治疗药物,含曲妥珠单抗的治疗方案可显著延缓疾病的进展时间,延长无疾病生存时间及总生存时间[5-6],但长期用药可能会导致远期心脏毒性,以无症状性左室射血分数(LVEF)降低、心动过速、胸痛及充血性心力衰竭(CHF)等为主要临床表现的心脏毒性事件在临床常见[7]。目前,受纳入研究的局限性和随访时间[5-6]、年龄的限制[8],可能无法对曲妥珠单抗诱导心脏毒性事件的结果作全面、明确地判定,证据适用性不足。本研究中系统评价了曲妥珠单抗上市20年来的心脏毒性事件风险。现报道如下。
1 资料与方法
1.1 文献纳入与排除标准
纳入标准:随机对照试验(RCT)、队列研究、病例-对照研究;HER2阳性乳腺癌;年龄不限;干预措施为试验组患者予曲妥珠单抗联合或不联合其他常规治疗,对照组患者除不采用曲妥珠单抗治疗外,其他方案与试验组相同;结局指标为心脏毒性事件的发生率及风险,LVEF下降的发生率及风险,心力衰竭(简称心衰)的发生率及风险。
排除标准:曲妥珠单抗使用疗程不同;缺乏对照措施;不能提取相关心脏毒性事件的结局数据;重复发表文献;无法获取全文;非中、英文文献;如遇同一研究发布多次随访结果,保留最新随访结果。
1.2 文献检索策略
计算机检索PubMed,Embase,The Cochrane Library,Web of Science,CBM及临床试验注册平台数据库(clinicaltrials.gov)、万方(WanFang)、维普(VIP)、中国知网(CNKI)等数据库,以及美国临床肿瘤学会(ASCO)会议摘要中相关的RCT和观察性研究,检索时间自建库起至2020年2月,并于统计前再次补充检索。采用主题词和自由词相结合的方式进行检索,中文检索词为“曲妥珠单抗”“赫赛汀”(主题词)及“乳腺癌”“乳腺肿瘤”(自 由 词),英文检索词为“Breast Neoplasms”“Trastuzumab”(主题词)及“Breast Cancer”“Breast Tumor”“Herceptin”“clinical trial”“random”“cohort studies”“case-control studies”(自由词)。
1.3 文献筛选和资料提取
由2名研究者独立筛选文献、提取资料并交叉核对,如有分歧则通过讨论或咨询第三方协助解决。阅读文题和摘要初筛文献,排除明显不相关的文献后,进一步下载并阅读全文以确定是否纳入。资料提取内容包括:①纳入研究的基本信息,如文题、作者、杂志、国家等;②研究对象的基线特征,如样本量、患者年龄、干预措施、研究设计、随访时间、基线LVEF、无症状LVEF下降的定义等;③偏倚风险评价的关键要素;④结局指标数据,如总心脏事件发生数量、LVEF下降的人数、心衰的发生人数等。
1.4 纳入研究偏倚风险评价
由2名研究者独立进行偏倚风险评价。采用Cochrane协作网推荐的RCT偏倚风险评价工具评价纳入RCT的偏倚风险,采用纽卡斯尔-渥太华量表(NOS)评价纳入观察性研究的偏倚风险。
1.5 统计学处理
采用STATA 16.0统计学软件进行Meta分析。心脏毒性事件以相对危险度(RR)为效应分析统计量,若研究结局事件为稀有数据,以比值比(OR)为效应分析统计量,各估计值以点估计和95%置信区间(CI)表示。纳入研究结果间的异质性采用χ2检验进行分析(检验水准为α=0.1),同时结合I2定量判断异质性的大小。若各研究间无统计学异质性,则采用固定效应模型进行Meta分析;若各研究间存在统计学异质性,则进一步分析异质性来源,排除明显临床异质性影响后采用随机效应模型进行Meta分析。明显的临床异质性采用亚组分析或敏感性分析,或只进行描述性分析。P<0.05为差异有统计学意义。分别对曲妥珠单抗联合不同治疗方案,每3周给药1次和随访时间在5年及5年以上的患者进行亚组分析。采用倒漏斗图和Egger检验判断是否存在发表偏倚。
2 结果
2.1 文献筛选流程及结果
初筛共检索到相关文献33 898篇,最终纳入文献27篇,包括17项RCT,10项队列研究,分别有19 137例和78 198例患者。文献筛选流程及结果见图1,纳入研究基本特征见表1。表1中。A为多柔比星,C为环磷酰胺,(non)-H为(非)曲妥珠单抗,D为多西他赛,T为紫杉醇,F为氟尿嘧啶,E为表阿霉素,C为环磷酰胺,E为盐酸表柔比星,L为拉帕替尼,V为长春瑞滨,Neo CT为新辅助化疗;4→2为负荷剂量4 mg/kg,以后每周2 mg/kg。

图1 文献筛选流程Fig.1 The flow chart of literature screening

表1 纳入研究基本特征Tab.1 Basic characteristics of the included studies
2.2 纳入研究偏倚风险评价结果
纳入RCT偏倚风险评价结果见表2。
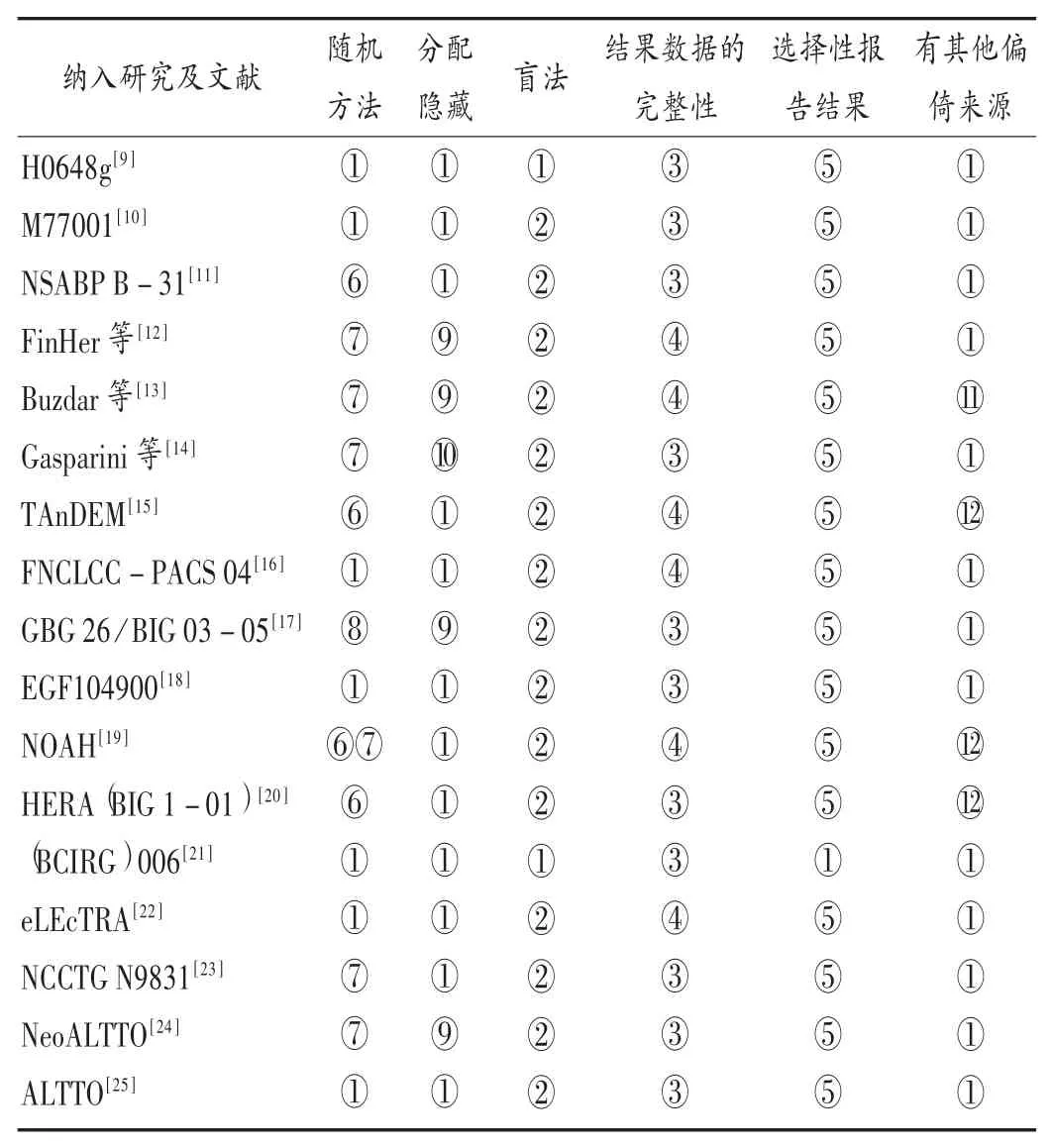
表2 纳入RCT偏倚风险评价结果Tab.2 Bias risk assessment in the included RCTs
2.3 Meta分析结果
总心脏事件风险:纳入17项RCT[9-25],10项队列研 究[26-35]。其 中,17项RCT[9-25]共19 137例 患 者 的Meta分析结果显示,接受曲妥珠单抗治疗患者总心脏事件的发生率为10.3%[95%CI(7.7%,12.9%)],曲妥珠单抗组较对照组总心脏事件发生风险显著增加[RR=1.92,95%CI(1.40,2.64),P<0.01]。10项队列研究[26-35]共78 198例患者的Meta分析结果显示,接受曲妥珠单抗治疗患者总心脏事件的发生率为13.6%[95%CI(7.6%,19.6%)],曲妥珠单抗组较对照组总心脏事件发生风险显著增加[RR=2.45,95%CI(1.81,3.32),P<0.01]。详见图2。

图2 曲妥珠单抗组与对照组总心脏事件发生风险的Meta分析森林图Fig.2 Meta-analysis forest plot:Comparison of the overall risk of cardiac events between the trastuzumab group and the control group
LVEF下降风险:纳入14项RCT[10-13,15-21,23-25]共17 171例患者。Meta分析结果显示,10 958例接受曲妥珠单抗治疗患者LVEF下降总发生率为8.4%[95%CI(5.9%,10.9%)],曲妥珠单抗组较对照组LVEF下降发生风险显著增加[RR=1.66,95%CI(1.24,2.24),P<0.01]。详见图3。

图3 曲妥珠单抗组与对照组LVEF下降发生风险的Meta分析森林图Fig.3 Meta-analysis forest plot:Comparison of the risk of LVEF reduction between the trastuzumab group and the control group
CHF风险:纳入15项RCT[9-12,15-25]共18 972例患者。12 036例接受曲妥珠单抗治疗患者CHF的总发生率为1.5%[95%CI(1.2%,1.8%)],固定 效应模型Peto法Meta分析结果显示,曲妥珠单抗组较对照组CHF发生风险显著增加[OR=2.05,95%CI(1.63,2.59),P<0.01]。详见图4。

图4 曲妥珠单抗组与对照组CHF发生风险的Meta分析森林图Fig.4 Meta-analysis forest plot:Comparison of the risk of CHF between the trastuzumab group and the control group
Ⅲ级或Ⅳ级严重CHF风险:纳入6项RCT[9,15,19,21,24-25]共11 769例患者。固定效应模型Peto法Meta分析结果显示,曲妥珠单抗组较对照组Ⅲ级或Ⅳ级严重CHF发 生风险显著增加[OR=3.52,95%CI(2.35,5.26),P<0.01]。详见图5。

图5 曲妥珠单抗组与对照组Ⅲ级或Ⅳ级严重CHF发生风险的Meta分析森林图Fig.5 Meta-analysis forest plot:Comparison of the risk of gradeⅢorⅣsevere CHF between the trastuzumab group and the control group
亚组分析:LVEF下降亚组分析结果显示,曲妥珠单抗组与对照组联合非蒽环类药物化疗、每周给药1次及随访时间≥5年的差异均无统计学意义(P>0.05)。CHF亚组分析结果显示,曲妥珠单抗组与对照组联合非蒽环类药物化疗的差异无统计学意义(P>0.05)。详见表3。
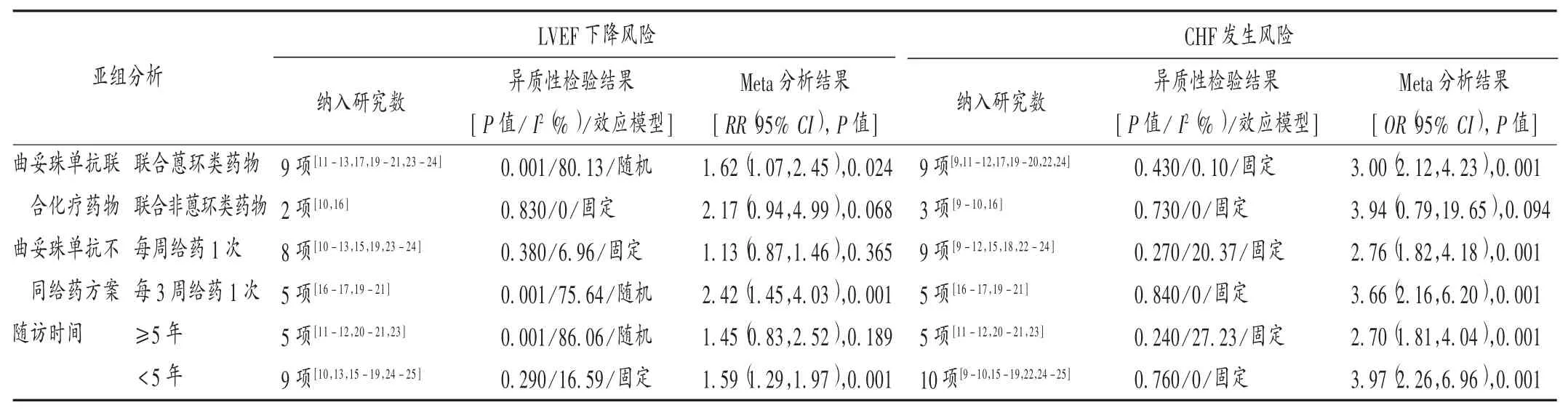
表3 曲妥珠单抗组与对照组联合蒽环类药物LVEF下降和CHF发生风险比较的亚组分析Tab.3 Subgroup analysis:Comparison of the risk of LVEF reduction and CHF between the trastuzumab group and the control group combined with anthracycline
2.5 敏感性分析
采用固定效应模型和随机效应模型进行敏感性分析,结果两者的效应量相差不大,提示本研究结果稳健性良好。详见表4。

表4 随机效应模型和固定效应模型计算结果比较Tab.4 Comparison of calculation results between the random-effects model and the fixed-effects model
2.6 发表偏倚
基于LVEF下降和CHF进行的发表偏倚评价倒漏斗图结果显示,各研究在漏斗两侧分布基本对称,Egger检验结果提示,发表偏倚不存在显著性(P=0.999 5,0.104 0)。详见图6。
3 讨论
1项接受曲妥珠单抗联合紫杉醇治疗患者的回顾性分析中,症状性心衰的发生率约为9%[36]。BRIA等[37]的Meta分析结果表明,接受曲妥珠单抗治疗1年的患者发生Ⅲ级或Ⅳ级CHF的风险均显著增加,绝对差值(AD)为1.61%(P<0.000 01);无症状LVEF下降的风险也显著增加,AD为7.20%(P<0.000 01)。但该研究可能受限于RCT的严格纳入、排除标准和随访时间等,证据的适用性可能不足。队列、病例对照等观察性研究是更接近真实世界的临床实践,是不良反应重要的证据来源。LEUNG等[8]的Meta分析结果表明,中位年龄67.5岁患者的CHF和CHF/心衰/心肌病的总发生率在2项RCT和5项队列研究中分别为6.4%(4.1%,9.4%)和16.4%(16.19%,16.61%),同样该研究受到年龄的限制,可能无法作全面评价。
本研究中分别纳入17项RCT和10项队列研究共97 335例早期和晚期乳腺癌患者,含曲妥珠单抗治疗患者的总心脏事件发生率分别为10.3%和13.6%;LVEF下降和CHF的发生率分别为8.4%和1.5%。与对照组比较,曲妥珠单抗显著增加了患者总心脏事件、LVEF下降、CHF发生风险。本研究中纳入了真实世界研究数据,量化了曲妥珠单抗用于早期新辅助和晚期患者的心脏风险,其结果与之前报道的临床试验基本一致,但与JOENSUU等[12]报道结果相反,而该研究纳入患者数量有限。BUZDAR等[13]的随机前瞻性研究报道了曲妥珠单抗和蒽环类药物在新辅助化疗环境中的联合使用情况,未报道CHF事件,LVFE无症状下降的发生率与未接受曲妥珠单抗治疗的对应者相当。值得注意的是,该试验中曲妥珠单抗的暴露时间为24周。针对心脏毒性发生的中位时间仍无明确报道,本研究结果表明,CHF在治疗后数年内仍存在较高风险。
本研究中存在的局限性:1)对于心脏毒性的判定标准不一,LVEF的基线及其下降水平的标准各异,如美国纽约心脏病协会(NYHA)分类评估CHF为主观判定,其结果可能存在潜在偏倚;2)总心脏毒性发生风险合成结果异质性较大,可能源于临床异质性;3)该Meta分析基于研究水平进行,患者水平的危险因素等混杂因素无法被评估;4)真实世界数据资料的LVEF下降和CHF报告有限,不足以评估长期心脏毒性,可能需长时间的随访及更多真实世界研究数据来进一步补充曲妥珠单抗的心脏毒性。

A.LVEF下降风险 B.CHF发生风险图6 发生偏倚评价倒漏斗图A.Risk of LVEF reduction B.Risk of CHFFig.6 Inverted funnel plot of bias assessment
综上所述,曲妥珠单抗可显著增加HER2阳性乳腺癌患者LVEF下降和CHF的发生风险,建议患者特别是高危人群在使用曲妥珠单抗治疗的数年内定期监测心脏病学相关指标。

