三氧化二砷对组织纤维化的作用及机制研究进展
支凤楠,沈秀芸,刘 冰,蒋雅楠,
(1.哈尔滨医科大学药学院药理学教研室,黑龙江省生物医药工程重点实验室-省部共建国家重点实验室培育基地,心血管药物研究教育部重点实验室,黑龙江 哈尔滨 150081;2.黑龙江省医学科学院北方转化医学研究合作中心,黑龙江 哈尔滨 150081)
砷毒性是威胁全球健康的重要因素之一。长期以来,印度、巴基斯坦和墨西哥等国家地区的居民常因饮用含砷地下水而导致砷蓄积中毒[1-3]。急性砷中毒主要表现为恶心、呕吐、腹痛和严重腹泻等症状,慢性砷中毒会导致多种系统疾病[4]。三氧化二砷是最具代表性的砷化合物之一,其对急性早幼粒细胞白血病和肝癌等疗效显著[5-6]。近年研究发现,三氧化二砷与多种组织纤维化密切相关。纤维化是一种修复或反应性过程,其主要特征是过量的纤维结缔组织的形成和沉积导致组织和器官的结构重塑[7]。目前的研究表明,多种通路参与纤维化的发生、发展过程,如转化生长因子β1(transforming growth factor-β1,TGF-β1)/Smad信号通路和Wnt信号通路等[8-9]。本文综述三氧化二砷对不同组织纤维化的作用(表1)及机制,以期为三氧化二砷毒性防治和临床合理用药提供新思路。
1 三氧化二砷对心肌纤维化的作用及机制
三氧化二砷在临床应用时有一定的不良反应,而心脏毒性是其中最严重的不良反应之一,主要表现为心律失常(如长QT间期综合征,尖端扭转型室性心动过速等),严重时可诱发心源性猝死[10-12]。心肌纤维化可干扰心脏正常的电生理功能,诱发多种心律失常[13-14]。目前已有研究表明三氧化二砷可以调控多种信号通路诱导心肌纤维化。初文峰等[15]发现,三氧化二砷可通过促进豚鼠心肌成纤维细胞分泌TGF-β1诱导心肌纤维化,加重长QT间期综合征,并伴有离子通道相关蛋白HERG和Kir2.1表达下调,而应用TGF-β/Smad抑制剂LY-364947可缓解三氧化二砷诱导的心肌纤维化和心律失常(表1)。另一项研究表明,大鼠隔天iv给予三氧化二砷0.4,0.8和1.6 mg·kg-1,连续2周,均可诱发心肌纤维化,其作用是通过激活蛋白激酶B(protein kinase B,Akt)/糖原合酶激酶 3β(glycogen synthase kinase-3β,GSK-3β)/锌指转录因子 Snail信号通路,促进内皮向间充质转化并且使胶原蛋白(collagen,Col)Ⅰ、ColⅢ、基质金属蛋白酶(matrix metalloprotein,MMP)2和MMP9等促纤维化基因表达(表1)[16]。一项荟萃(Meta)分析发现,砷对TGF-β信号转导通路具有双向调节作用。低浓度砷(≤5 μmol·L-1)可以增加心和肝等器官及多种细胞(包括心肌成纤维细胞和HL-60等细胞)中TGF-β1的表达,而高浓度砷(>5 μmol·L-1)具有抑制其TGF-β1表达的趋势,说明高浓度砷可抑制纤维化,低浓度砷可以诱导纤维化。在体实验结果显示,低剂量砷(<5 mg·kg-1)可上调心脏等组织中TGF-β1的表达,由于三氧化二砷等含砷化合物具有较高毒性,高剂量砷(≥5 mg·kg-1)的作用尚不明确[17]。临床上,三氧化二砷注射液(亚砷酸)静脉给药的剂量为成人 10 mg·d-1,儿童每天0.16 mg·kg-1,砷血浆峰浓度约为 6.85 μmol·L-1[18-19]。推测三氧化二砷给药期间,绝大部分时间的血药浓度<5 μmol·L-1,提示临床治疗剂量很可能诱发心肌纤维化。
2 三氧化二砷对肾纤维化的作用及机制
肾纤维化可导致肾结构改变,血液供应减少,最终导致肾功能衰竭[20]。近年研究发现,三氧化二砷可影响肾纤维化,但其对肾纤维化的作用仍存在争议。一方面,Chang等[21]研究发现,肾皮质/近端小管细胞用亚砷酸钠0.1和10 μg·L-1处理60 d,可促进上皮-间充质转化导致肾纤维化(表1),表现为纤维化标志物ColⅠ、TGF-β、α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、MMP2和MMP3表达增加。另一方面,Maghmomeh等[22]研究发现,SD大鼠ig给予三氧化二砷(3.5 mg·kg-1,21 d)可以改善顺铂诱发的肾纤维化,表现为肾TGF-β1和α-SMAmRNA水平及羟脯氨酸含量降低,其作用与阻断Hedgehog信号,降低Shh,Smo和PtchmRNA表达水平以及GLI家族锌指蛋白1和2表达水平有关。在体研究中,三氧化二砷(3.5 mg·kg-1)为高剂量,而离体研究中亚砷酸钠(0.1和10 μg·L-1)为低剂量,这提示砷可能存在剂量依赖性的双重调控作用。而且,在体水平实验还受其他因素影响,无法与离体水平实验结果完全相同。因此,三氧化二砷对肾纤维化的作用差异可能与给药剂量有关,仍需进一步研究。
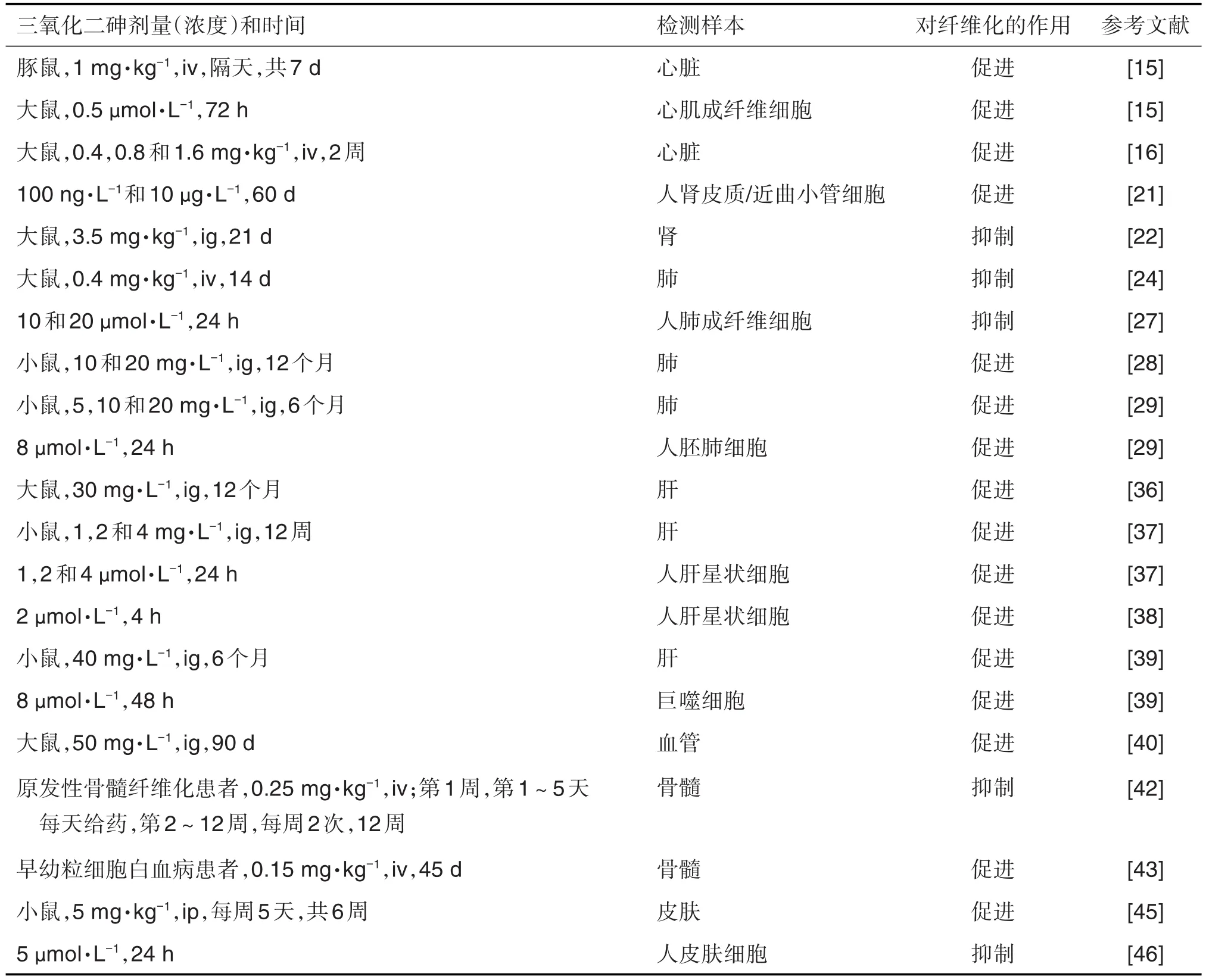
表1 三氧化二砷对组织纤维化的作用
3 三氧化二砷对肺纤维化的作用及机制
肺纤维化是正常的肺泡组织被损坏或胶原蛋白过度沉积导致的结构异常[23]。一项研究表明,SD大鼠iv给予三氧化二砷0.4 mg·kg-1,连续14 d,可以减轻博来霉素诱导的肺纤维化,使肺间质组织变薄,胶原蛋白沉积减少,α-SMA表达减少,E钙黏蛋白表达增多,其作用机制与三氧化二砷上调miR-98表达、进而抑制miR-98的靶基因信号转导与转录激活因子3表达水平有关[24-26]。另一项研究表明,三氧化二砷(10和20 μmol·L-1)可以抑制TGF-β1诱导的人肺成纤维细胞向肌成纤维细胞转化,使α-SMA和ColⅠ mRNA和蛋白表达下调[27]。然而,最新研究表明,亚砷酸盐(8 mmol·L-1,48 h)通过上调长链非编码RNA(long noncoding RNA,lncRNA)H19 的表达诱导巨噬细胞M2极化,并通过增加c-Myc诱导肺纤维化[28]。并且三氧化二砷还可以通过促进miR-21表达、降低磷酸酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)表达、促进Akt磷酸化,进而增加糖酵解相关蛋白的表达,最终导致肺纤维化[29]。而高浓度三氧化二砷(50 μmol·L-1,24 h)可通过激活丝裂原活化蛋白激酶及促进活性氧的产生,诱导肺成纤维细胞凋亡[30-31]。以上研究结果表明,三氧化二砷对纤维化的作用受给药剂量的影响。
4 三氧化二砷对肝纤维化的作用及机制
肝纤维化是三氧化二砷肝毒性的主要表现之一[32-33]。活化的肝星状细胞是肝纤维化发展的中心环节,也是细胞外基质产生的主要原因[34-35]。SD大鼠饮用含亚砷酸钠的水溶液(30 mg·L-1,12个月)可激活TGF-β/Smad通路,促进α-SMA、ColⅠ和纤连蛋白表达,导致肝纤维化[36]。与此相似,在C57BL/6J小鼠和肝星状细胞中,三氧化二砷均能通过上调过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor alpha,PPARα)诱导肝星状细胞的活化进而诱导肝纤维化[37]。也有研究发现,三氧化二砷(2 μmol·L-1,4 h)可诱导肝星状细胞细胞中早幼粒细胞白血病蛋白的泛素化,进而促进肝纤维化的发生发展[38]。三氧化二砷也可促进LX-2细胞中miR-21表达,抑制PTEN表达,并促进重组人精氨酸酶1的激活,进而促进巨噬细胞M2极化和促纤维化细胞因子的分泌,导致肝纤维化[39]。因此,临床应用三氧化二砷时应密切监测肝功能,早期预防肝纤维化。
5 三氧化二砷对其他组织纤维化的作用及机制
三氧化二砷也可以影响血管纤维化、骨髓纤维化和皮肤纤维化。研究表明,饮用含亚砷酸的水(50 mg·L-1,90 d)可诱导Wistar大鼠血管纤维化和血管重构,表现为羟脯氨酸/总胶原水平增加、胶原纤维的增殖以及主动脉壁和胶原外膜的厚度增加,其作用是通过激活血管紧张素Ⅱ1型受体和TGF-β通路[40]。因此,在临床应用三氧化二砷时应关注血管损伤。
原发性骨髓纤维化是一种骨髓增殖性肿瘤[41]。研究表明,沙利度胺、三氧化二砷、地塞米松和抗坏血酸联合应用对原发性骨髓纤维化有疗效,三氧化二砷通过促进细胞凋亡和抑制细胞再生机制抑制血管内皮生长因子的产生而发挥作用,而沙利度胺可通过消耗细胞内的谷胱甘肽增强三氧化二砷活性[42]。然而,另有研究结果表明,在临床应用三氧化二砷治疗急性早幼粒细胞白血病时会引起骨髓纤维化[43]。2项研究均是临床观察结果,前者研究提示联合用药可能达到增效减毒的目的,而后者研究中所谈及的三氧化二砷引起骨髓纤维化的作用仅是在1例患者治疗过程中观察到的结果,因此,三氧化二砷是否可以引起骨髓纤维化仍有待深入研究。
皮肤纤维化是一种常见的纤维化疾病,以成纤维细胞增生和细胞外基质的过度沉积为特征,包括硬皮病和肥厚性瘢痕等[44]。研究表明,BALB/c小鼠每周5 d ip给予三氧化二砷(5 mg·kg-1)可以改善次氯酸诱导皮肤纤维化,表现为皮肤中ColⅠ、肌成纤维细胞标志物α-SMA表达和磷酸化Smad2/3下调[45]。而在细胞水平上,人皮肤细胞给予5 μmol·L-1三氧化二砷24 h,可抑制TGF-β1诱导的成纤维细胞向成肌纤维细胞的分化和活性氧的积累而减轻皮肤纤维化,其机制与抑制红细胞衍生核因子2样蛋白2和Smad2/3途径并且增加血红素加氧酶1的表达有关[46]。但目前对皮肤纤维化的研究相对较少,仍需进一步探索。
6 三氧化二砷对非编码RNA的调控作用
lncRNA在多种组织器官功能异常中发挥关键作用[47-49]。近年研究发现,三氧化二砷的心脏毒性和抗肿瘤作用与调控lncRNA有关。在心脏中,三氧化二砷可通过调控lncRNA钾电压门控通道亚家族Q成员1重叠转录物1(potassium voltage-gated channel subfamily Q member 1 overlapping transcript 1,KCNq10T1)/KCNQ1通路诱导长QT间期综合征[50]。其也可抑制心脏lncRNA核富集的转录物 1(nuclear paraspeckle assembly transcript 1,NEAT1)表达,而过表达lncRNA NEAT1可通过抑制miR-124/NF-κB信号通路缓解三氧化二砷诱导的心肌细胞损伤[51]。三氧化二砷可通过调控lncRNA对肝癌、膀胱癌和乳腺癌产生作用。三氧化二砷可通过促进lncRNA母系表达基因3(maternally expressed gene 3,MEG3)表达,进而抑制肝细胞癌的上皮间质转化过程[37]。其也可促进肝癌细胞lncRNA编程调节因子(egulator of programming,ROR)表达,而敲减lncRNA ROR可缓解三氧化二砷诱导的肝癌细胞凋亡[52]。对于膀胱癌,三氧化二砷可通过促进lncRNA含有6B反义RNA1的卵巢肿瘤结构域表达进而诱导膀胱癌细胞氧化损伤[53]。三氧化二砷还可通过下调lncRNA Dicer酶1反义RNA1(DICER1 antisense RNA 1,DICER1-AS1)表达抑制乳腺癌细胞增殖[54]。三氧化二砷所调控的lncRNA中有些已被证实与纤维化相关。lncRNA KCNQ10T1与心肌纤维化、肾纤维化和肝纤维化相关[55-57]。lncRNA NEAT1与肝纤维化、肺纤维化和肾纤维化有关[58-61]。lncRNA MEG3可介导肝纤维化、肾纤维化和肺纤维化[62-64]。lncRNA ROR可促进心肌纤维化[65]。上述研究提示lncRNA在三氧化二砷调控纤维化过程中发挥重要作用。
7 结语
目前研究表明,三氧化二砷对多种组织纤维化均有影响,其作用与剂量和给药时间相关,临床常用剂量具有诱导多组织纤维化的风险,但作用机制仍未完全阐明,且临床上尚无防治三氧化二砷诱导纤维化的有效药物。有研究表明,三氧化二砷可通过调控环状RNA抑制肿瘤的发生发展[66-67]。但环状RNA在三氧化二砷诱导的纤维化中的作用机制还有待阐明。深入揭示药物对非编码RNA的调控作用也有助于预测三氧化二砷联合用药,实现增效减毒的目的,促进临床合理用药。

