年龄相关性黄斑变性中玻璃膜疣形成的病理机制及中西医防治策略
郑慧丽,朱 悦,王颖异,曹 程,陈晨凯,郭建明,段 然,郭 盛,,段金廒
(1.南京中医药大学中药资源产业化与方剂创新药物国家地方联合工程中心,江苏省中药资源产业化过程协同创新中心,江苏省方剂高技术研究重点实验室,江苏 南京 210023;2.宁夏枸杞创新中心,宁夏 银川 750000)
年龄相关性黄斑变性(age-related macular degeneration,AMD)是一种导致视力进行性丢失的疾病,主要影响视网膜中央凹黄斑区域,多见于60岁以上老人,是老年人视力不可逆转障碍的主要原因,可导致永久性视力障碍或失明,严重影响患者的生活质量。流行病学研究发现[1],在中国发达城市>50岁人群中早期AMD患病率为9.5%,晚期AMD患病率为1.0%。随着人口老龄化加剧,全球范围内受AMD影响的人数预计将在2040年增加到2.88亿[2],从而构成具有重大社会经济影响的公共卫生问题。
根据疾病进程,AMD有早期与晚期之分,早期以玻璃膜疣和视网膜色素异常为主要特征;晚期有2种经典的临床类型:干性(萎缩性)和湿性(脉络膜新生血管)。自从针对血管内皮生长因子(vascular endothelial growth factor,VEGF)的药物引入晚期湿性AMD的治疗以来,因AMD导致的失明和视力严重损失的发生率已经下降。但对于干性AMD的治疗,目前国际上尚无批准的临床药物。玻璃膜疣作为早期AMD的临床标志,为晚期AMD的重要风险因素,是防止疾病向晚期转化的关键病理环节。本文对玻璃膜疣形成、发展及干预途径,组学技术在玻璃膜疣及AMD研究中的应用进展、中医药对于玻璃膜疣认识与治法方面展开综述,有助于将西医的防治策略与传统中医的辨证论治相结合,调控玻璃膜疣的形成与发展,为AMD的预防及早期干预寻求有效方法。
1 玻璃膜疣病理特征及其组成
玻璃膜疣是AMD早期特征性病理变化,位于视网膜色素上皮(retinal pigment epithelium,RPE)细胞与Bruch膜(Bruch′s membrane,BrM)内胶原蛋白层之间,在黄斑及视网膜周边均可见。当外观小而圆、边界清晰、尺寸<63 μm时,称为硬性玻璃膜疣;中等尺寸的玻璃膜疣为63~125 μm,大型玻璃膜疣尺寸>125 μm,且边缘模糊。有研究认为,小的坚硬的玻璃膜疣是正常的衰老变化,无增加晚期AMD发生的风险,中等及大型玻璃膜疣的出现是晚期AMD的危险因素,如果双眼都有病变,则风险会进一步增加[3]。此外,玻璃膜疣体积的增长还可以预测晚期脉络膜新生血管(choroidal neovascularization,CNV)的形成[4]。
玻璃膜疣中含有超过129种蛋白,包括炎症反应相关蛋白:急性期蛋白、C反应蛋白、免疫球蛋白G、晶体蛋白和血清淀粉样蛋白P;补体因子:补体因子 C3(component 3,C3)、C5、C5b-9、C7、C8、C9、补体因子 H(complement factor H,CFH)和CFB;补体抑制因子:玻连蛋白(vitronectin)、载脂蛋白 J(apolipoprotein J,ApoJ)、膜辅助因子蛋白(membrane cofactor protein,CD46)和补体受体1型(complement receptor type 1,CR1);载脂蛋白:ApoE、ApoA1、Aβ和其他修饰性(糖基化、氧化、共价交联)蛋白等[5-7]。此外,脂质也是玻璃膜疣的重要组分,由磷脂酰胆碱和酯化胆固醇占主导地位的中性脂质约占沉积物体积的40%[8]。
2 玻璃膜疣形成机制
关于玻璃膜疣的形成有不同的推测和假说,其中RPE细胞-BrM-脉络膜复合体功能退化被认为与玻璃膜疣的形成密切相关。此外,易感基因、补体激活和胆固醇清除系统障碍也参与玻璃膜疣的形成。最近研究显示,羟基磷灰石(hydroxyapatite,HAP)小球是玻璃膜疣蛋白沉积的“种子事件”。
2.1 RPE细胞-BrM-脉络膜复合体功能障碍
在AMD早期,玻璃膜疣的形成与RPE细胞色素减少或者过度沉积密切相关[9]。RPE细胞成分脂褐素、细胞器和细胞碎片等都可在早期玻璃膜疣中检测到,Farkas等[10-11]认为退化的RPE细胞转化为无定形物质,最终填充了BrM的内部胶原蛋白层,从而形成玻璃膜疣。最近研究显示,覆盖在玻璃膜疣上的RPE细胞出现萎缩退化,且大的玻璃膜疣与更高的RPE细胞丢失概率相关[12-13]。上述发现提示,RPE细胞退化或死亡与玻璃膜疣的形成有关,但两者之间的因果关系尚不清楚。
BrM随年龄增长胶原蛋白交联度增加,弹性及大分子扩散能力下降,且以黄斑区域最为显著[14]。RPE细胞通过腺苷三磷酸结合盒转运体A1(ATP binding cassette transporter A1,ABCA1)/ABCG1途径卸载多余的脂质[15],由于BrM中弹力蛋白层结构及性能的改变,脂蛋白首先在内胶原蛋白层积累,然后向RPE层聚集,最终形成“脂质壁”。脂质壁阻碍RPE细胞和脉络膜血管之间的营养物质和毒性代谢物的正常交换,导致异质物质和炎性碎屑堆积,造成BrM增厚。
随着年龄增长,脉络膜变薄,毛细血管密度下降,供给BrM的血流面积变小,同时观察到玻璃膜疣沉积的增加。在人类黄斑切片中,血管密度与玻璃膜疣密度呈负相关[16-17]。Nassisi等[18]研究表明,在早期及中期AMD患者脉络膜血流障碍区域,2年内有玻璃膜疣扩大或者新生玻璃膜疣的出现。Lengyel等[19]研究发现,玻璃膜疣沉积倾向于发生在周边脉络膜的毛细血管柱之间的间隙上。以上结果表明,脉络膜毛细血管对视网膜代谢产物清除效率的降低是玻璃膜疣沉积的重要事件,适度的脉络膜微循环可能是防止玻璃膜疣形成的关键。
2.2 易感基因
Dietzel等[20]发现,CFH rs1061170 变体在早期及晚期玻璃膜疣的眼睛中更为常见,而年龄相关性黄斑易感蛋白2(age-related maculopathy susceptibility protein 2,ARMS2)rs10490924变体与晚期玻璃膜疣相关。Merle等[21]研究发现,CFH、C3、ARMS2、VEGF-A、金属蛋白酶抑制剂3(metalloproteinase inhibitor 3,TIMP3)、核蛋白定位蛋白4同源物(nuclear protein localization protein 4 homolog,NPLOC4)和热休克蛋白家族 H(heat shock protein family H,Hsp110)成员 1(Hsp110 member 1,HSPH1)变体的常见和罕见等位基因与玻璃疣体积进展成正相关,C2保护性等位基因可降低玻璃膜疣进展风险。有研究表明,CFH H402突变体与BrM中硫酸乙酰肝素的结合减少会引起BrM中脂蛋白积聚,加速玻璃膜疣形成[22-23]。此外,CFH H402突变体还通过降低与C反应蛋白的结合活性,抑制巨噬细胞和小胶质细胞清除RPEBrM之间的细胞碎片,促进玻璃膜疣的形成[24]。含表皮生长因子的类纤维蛋白样细胞外基质蛋白1(EGF-containing fibulin-like extracellular matrix protein 1,EFEMP1)基因中的p.R345W突变,可以通过激活补体途径,诱导RPE细胞下沉积物的形成[25]。
2.3 补体激活
Yang等[26]发现,激活补体替代途径,单次补体攻击RPE细胞后,APOE被释放到培养基中;重复攻击后,APOE积累于细胞外基质上。APOE沉积物的形成会导致其他已知玻璃膜疣蛋白的选择性沉积,包括玻连蛋白、凝集素和血清淀粉样蛋白P等[27],提示在玻璃膜疣形成时,蛋白质之间的特异性相互作用有助于玻璃膜疣中特定蛋白的积累。
2.4 巨噬细胞胆固醇转运失调
除脂蛋白沉积,巨噬细胞胆固醇反向转运受损也会影响玻璃膜疣的进展。在AMD中,巨噬细胞聚集在玻璃膜疣的周围[28]。研究表明,巨噬细胞中胆固醇外流调节因子ABCA1和ABCG1的缺失会引起胆固醇外排障碍,导致视网膜下出现富含胆固醇的玻璃膜疣样沉积物[28],而ABCA1和ABCG1在小鼠和人类巨噬细胞中的表达,随年龄增长而下调[29]。
2.5 羟基磷灰石小球沉积
Thompson等[30]根据HAP可在无玻璃膜疣的区域单独存在,并且玻璃膜疣均存在HAP的现象,提出HAP是玻璃膜疣形成的“种子事件”,并认为随年龄增加和(或)疾病进展,脂质颗粒开始在RPE-BrM内积累,当RPE下存在脂质液滴以及钙磷有效的平衡变化时,HAP可在脂滴表面沉淀,蛋白可选择性与HAP球直接作用被保留[31]。研究表明,89种玻璃膜疣蛋白中至少有30%可与HAP结合,如果只考虑血液来源的蛋白质,则比例高达50%[32]。表明HAP的沉积有助于玻璃膜疣中特定蛋白的积累。
3 玻璃膜疣中特定沉积物诱导AMD样病理变化的形成
沉积在BrM的脂质和蛋白质在视网膜特定的高氧、高光照环境中发生交联、氧化和糖基化等一系列反应,形成特定的抗原特异性表位,诱导补体及自身免疫系统激活,长期持续性的慢性炎症反应导致RPE细胞及感光细胞受损,并诱导晚期CNV的形成(图1)。
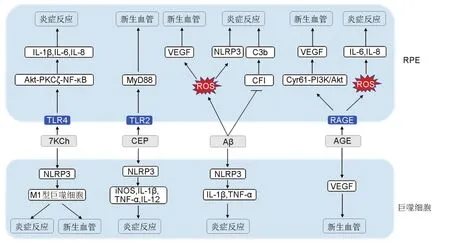
图1 玻璃膜疣沉积物诱导年龄相关性黄斑变性(AMD)病理变化的形成.IL:白细胞介素;Akt:丝氨酸/苏氨酸蛋白激酶;PKCζ:蛋白激酶Cζ;TLR:Toll样受体;7KCh:7-酮胆固醇;NLRP3:含吡咯结构域3的核苷酸结合域和富含亮氨酸重复序列的受体;MyD88:髓样分化因子;CEP:羧乙基吡咯;iNOS:诱导型一氧化氮合酶;TNF-α:肿瘤坏死因子α;ROS:活性氧;Aβ:β淀粉样蛋白;VEGF:血管内皮生长因子;CFI:补体因子I,C3b:补体成分C3-b;AGE:晚期糖基化终末产物;RAGE:AGE受体;Cyr61:含半胱氨酸蛋白61;PI3K:磷脂酰肌醇-3激酶;RPE:视网膜色素上皮细胞.↑:促进;┤:抑制
3.1 脂质过氧化物
视网膜特定的高氧分压,高光暴露和高水平的各种脂质化合物,使其极易受到氧自由基和脂类衍生物的损害。玻璃膜疣中存在高水平7-酮胆固醇(7-ketocholesterol,7KCh)。体内实验发现,7KCh主要沉积于RPE细胞,并诱导光感受器凋亡[33]。体外研究发现,7KCh通过Toll样受体4(Toll-like receptor 4,TLR4)激活α丝氨酸/苏氨酸蛋白激酶-蛋白激酶Cζ-NF-κB(alpha serine/threonine-protein kinase-protein kinase Cζ-NF-kappaB,Akt-PKCζ-NF-κB)炎性通路,诱导白细胞介素6(interleukin-6,IL-6)、IL-8和VEGF表达,导致视网膜炎症,促进CNV形成[34-35]。7KCh还可诱导视网膜小胶质细胞迁移到视网膜下间隙,并通过含吡咯结构域3的核苷酸结合域和富含亮氨酸重复序列的受体(the nucleotide-binding domain and leucine-rich repeat receptor containing a pyrin domain 3,NLRP3)途径被激活为M1促炎表型。激活的小胶质细胞高表达VEGF,下调脑源性神经营养因子、神经生长因子和睫状神经营养因子,启动CNV并导致视网膜变性[36]。
玻璃膜疣中还发现了二十二碳六烯酸氧化产物羧乙基吡咯(carboxyethylpyrrole,CEP)修饰的蛋白。用CEP免疫小鼠,观察到小鼠玻璃膜疣周围的巨噬细胞中含胱天蛋白酶和NLRP3活化,BrM补体沉积,RPE细胞受损等与干性AMD相关的病理特征[37-38]。体外实验结果表明,CEP可引起RPE细胞线粒体电位损失、上调衰老相关的β-半乳糖苷酶表达,诱导RPE细胞功能障碍[39]。巨噬细胞经CEP蛋白加合物刺激后,诱导诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、IL-1β、肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)和IL-12等M1标志基因表达上调[40]。此外,CEP修饰二肽还可通过TLR2和髓样分化因子(myeloid differentiation factor 88,MyD88)信号通路,而非VEGF途径促进CNV形成[41-42]。
3.2 β淀粉样蛋白
Aβ的合成发生于RPE细胞中,并在玻璃膜疣中积聚[43]。neprilysin基因干扰小鼠Aβ降解受阻,表现出典型的AMD特征[44]。研究发现,小鼠视网膜下注射Aβ1-40,可在短期内诱导AMD表型,Aβ1-40能通过诱导内源性miR-191-5p表达导致C/eBPβ基因上调,进而促进NLRP3转录,上调下游胱天蛋白酶1和IL-1β,介导RPE细胞损伤;激活细胞内衰老相关基因,导致RPE细胞死亡[45-47]。Wang等[48]研究表明,Aβ能结合并抑制CFI,阻碍C3b灭活,引起补体系统持续低水平局部激活,诱导慢性炎症。此外,Aβ还增加巨噬细胞和小胶质细胞产生IL-1β和TNF-α,上调RPE细胞中CFB表达激活补体替代途径[49],增加线粒体活性氧(reactive oxygen species,ROS),诱导NLRP3激活,促进VEGF表达参与CNV的形成[50-51]。
3.3 晚期糖基化终末产物
在AMD中,晚期糖基化终末产物(advanced glycation end products,AGE)在RPE细胞、BrM、玻璃疣和中央凹新生血管中积聚显著[52]。AGE与其受体结合触发炎症信号级联,诱导急性炎症向慢性炎症的转化,并可能诱导CNV。研究表明,沉积于BrM的AGE可引起ARPE-19细胞内脂褐素和ROS增加,上调VEGF表达,促进炎症因子IL-6和IL-8的分泌,募集巨噬细胞,诱导视网膜炎症反应[53]。在动物模型及体外模型中,AGE及其修饰蛋白可通过富含半胱氨酸蛋白61-磷脂酰肌醇-3激酶-丝氨酸/苏氨酸蛋白激酶(cysteine-rich protein 61-phosphoinositide 3-kinase-alpha serine/threonineprotein kinase,Cyr61-PI3K/Akt)促进RPE细胞分泌VEGF诱导CNV[54]。
4 现代生物组学技术在玻璃膜疣和AMD研究中的应用
近年来,高通量组学技术的出现使得许多疾病的候选生物标志物得以快速发现。基因组学、表观遗传学、转录组学、蛋白组学和代谢组学已经被广泛应用于AMD的研究。目前,利用全基因组关联分析[55](genome-wide association study,GWAS),已经确定了69个与AMD相关的单核苷酸多态性位点。Ratnapriy等[56]将GWAS和表达数量性状位点(expression quantitative trait loci,eQTL)技术相结合,确定了6个已报道AMD基因座上的可能靶点,并利用转录组学关联分析发现3个新的风险基因:视黄醛结合蛋白1、肿瘤高甲基化基因1和多聚(ADP-核糖)聚合酶家族成员12。
表观遗传学弥合了基因型和表型之间的差距,解释了相同基因型可导致不同的稳定和可遗传的表型。视网膜色素上皮细胞染色质可及性(chromatin accessibility)降低这一表观遗传功能障碍,被认为是驱动早期AMD的主要病理环节[57]。Porter等[58]对于人类供体眼睛中RPE细胞进行表观基因组范围的关联研究及靶向基因表达谱分析,发现AMD患者中SKI基因cg18934822位点、通用转录因子ⅡH亚基H4基因cg22508626位点甲基化存在差异。对人类RPE/脉络膜和视网膜的分析显示,AMD患者中谷胱甘肽硫转移酶M1和谷胱甘肽硫转移酶M5基因高甲基化,与其表达降低一致[59]。AMD患者视网膜及全血中,丝氨酸蛋白酶50启动子区域也存在高甲基化[60]。在AMD患者外周血单核细胞DNA中观察到IL-17RC甲基化差异,但该结果在重复时存在争议[61-62]。此外,线粒体DNA的J单倍群与AMD的高风险相关,可能与其对表观遗传酶包括组蛋白乙酰转移酶1、组蛋白脱乙酰基酶1、DNA甲基转移酶1和核基因CFH、EFEMP1、VEGFA和NF-κB的调控,进而影响RPE细胞中全基因组DNA甲基化水平有关[63]。
转录组学技术的最新进展极大地促进了对人类视网膜基因表达谱的理解,为更好地从GWAS中鉴定AMD相关基因以及其功能研究提供了关键一步。Menon等[64-65]利用单细胞转录组测序建立了人类视网膜主要细胞类型的转录组,并将其与GWAS结果进行关联分析,发现大多数AMD基因在RPE细胞中表达,其次为Müller胶质细胞和星形胶质细胞、血管细胞和视锥细胞。Orozco等[65]利用单核RNA测序技术建立了人类视网膜黄斑区域及周边区域转录组,并基于GWAS和eQTL共定位技术确定了15个可能的AMD风险基因,包括RPE细胞高表达的转化受体电位阳离子通道亚家族M成员 1(transient receptor potential cation channel subfamily M member 1,TRPM1)和4次穿膜蛋白(tetraspanin,TSPAN10)和已发现的溶酶体相关细胞器生物合成复合体1亚基1和跨膜蛋白199(transmembrane protein 199,TMEM199)。Voigt等[66-67]采用磁分离技术和二次单细胞测序发现脉络膜毛细血管特异性表达细胞周期调节器(regulator of cell cycle,RGCC),该基因响应补体激活并诱导内皮细胞凋亡。
蛋白质组学在AMD中被广泛用于玻璃膜疣中蛋白的鉴定,对于AMD病理环节的理解意义重大。通过蛋白质组学技术从人类玻璃膜疣中分离得到超过129种蛋白质[5],从食蟹猴中分离得到超过245种蛋白质[68],主要涉及补体途径、脂质代谢途径和炎症反应相关蛋白等。一项基于房水中蛋白组学分析结果显示,载脂蛋白A1、补体因子H受体2、簇蛋白、人激肽释放酶结合蛋白、光蛋白聚糖(lumican,Lum)和角膜蛋白聚糖(keratocan,KERA)蛋白与干性AMD相关,并且与细胞外基质相关的Lum和KERA蛋白在软性玻璃膜疣中上调[69]。Arya等[70]将CFH基因型与HAP小球结合蛋白相关联研究,发现CNV患者血浆中H因子相关蛋白1(factor H-related protein 1,FHR1)、FHR3、APOC4和妊娠带蛋白(pregnancy zone protein,PZP)与视网膜HAP小球相关。
对于AMD差异代谢物的研究便于早期筛查时发现疾病并进行干预,以防止视力的严重丧失。代谢物是基因转录和翻译过程的下游,也是基因与环境相互作用的下游,被认为与表型密切相关。Laíns等[71-72]使用超高效液相色谱-质谱联用技术发现AMD患者血浆中87种代谢物发生改变,主要涉及甘油磷脂代谢,嘌呤代谢和牛磺酸与次牛磺酸代谢。Acar等[73]使用高通量质子核磁共振代谢组学平台,定量了60种与AMD显著相关的代谢物,发现高密度脂蛋白和极高密度脂蛋白亚型增加、氨基酸和柠檬酸水平降低。
5 针对玻璃膜疣的抗AMD现代医学防治策略
使用激光光凝消融玻璃膜疣是第一批旨在减轻AMD病理中玻璃膜疣损伤的研究。此外,研究人员还对玻璃膜疣形成过程中脉络膜血流减少、Aβ沉积以及补体途径激活进行了积极干预,以期达到延缓AMD的作用(图2)。
5.1 激光疗法
激光光凝可以诱导玻璃膜疣消失预防晚期CNV的发生[74]。连续波激光对玻璃膜疣的消融是高度非特异性的,在消融玻璃膜疣的同时会导致健康组织损伤。阈下纳秒激光在诱导碎片清除的同时最小程度损伤邻近组织[75],每6个月游泳1次,超过36个月可以延缓AMD向晚期进展的速度[76]。此外,飞秒激光在靶向消融玻璃膜疣样沉积的同时能够保持RPE细胞层的完整性[77],展示出了良好的延缓AMD进展的前景。
5.2 脉络膜血流增强剂
MC-1101是一种局部抗高血压药物,通过刺激一氧化氮的产生扩张脉络膜血管,增加脉络膜血液循环。Ⅰ期临床试验表明,局部滴注MC-1101是安全的,耐受性良好,并且可以到达黄斑,增加脉络膜血液循环,其临床安全性研究尚在进行中[78]。
5.3 抗 β淀粉样蛋白抗体
RN6G是一种人源化的单克隆抗体,与Aβ1-40和Aβ1-42具有较高的亲和力,可以消除Aβ在黄斑中的积累。在AMD小鼠模型中,注射Aβ1-40和Aβ1-42抗体可以剂量依赖地消除视网膜电图缺陷,降低视网膜Aβ及补体活化水平,保护RPE结构完整性[79]。然而该项针对AMD中地图样萎缩(geographic atrophy,GA)的Ⅱ期临床疗效、安全性和耐受性研究已提前终止。GSK93377687是一种人源化抗Aβ蛋白N端氨基酸的IgG抗体,静脉注射后GA发展速度,在视觉功能测试中与安慰剂相比无临床差异[80]。
5.4 补体系统抑制剂
兰帕利珠单抗(lampalizumab)为CFD的人源化IgG Fab片段,在Ⅲ期试验中未能减少GA面积,且最佳矫正视力的变化也不显著[81]。靶向C3的pegcetacoplan(APL-2)Ⅱ期临床试验结果显示,与安慰剂组相比,玻璃体内注射APL-2能使GA发展速度降低29%,但增加了CNV的发生概率[82]。依库利珠单抗(eculizumab)为C5的人源化单克隆抗体,与安慰剂组相比,在玻璃膜疣体积增长及GA病变速度上均无明显降低[83-84]。Avacincaptad pegol(ARC1905,C5补体抑制剂)的Ⅰ/Ⅱ期临床试验结果显示,给药12个月内能够显著降低GA的速度,Ⅱ/Ⅲ期试验正在进行中[85]。此外,小鼠视网膜下注射表达CD59的重组腺病毒(AAVCAGsCD59)可降低MAC沉积和细胞溶解,抑制MAC的形成,提示其可能用于治疗 GA[86]。
6 传统中医药对于玻璃膜疣相关疾病的认识与防治策略
古代中医书籍中无直接关于AMD的记载,根据疾病临床表现可将其划为“视直为曲”,“视瞻昏渺”,“暴盲”的范畴。祖国医学认为,AMD早期黄斑玻璃膜疣的出现为虚证,多以脾虚湿困为主,兼有肝血虚、肾阴虚,治法以健脾益气为主,兼补肝肾;随着疾病向纵深发展,痰湿积聚造成RPE层脱离,总体上仍以虚证为主,应以益气养血、补益肝肾为主;出现脉络膜新生血管渗出、出血等,为虚证发展为本虚标实证,渗出则可按痰湿辨证,出血系因气血虚弱,血脉不通,治则应以宁血活血,化痰祛瘀为主[87-88](图 2)。

图2 现代医学与传统医学对于玻璃膜疣的认识及治疗措施.APL-2:pegcetacoplan;ARC1905:avacincaptad pegol;RPE-BrM-CC:视网膜色素上皮细胞-Bruch膜-脉络膜毛细血管;HAP:羟基磷灰石.
6.1 玻璃膜疣形成的病机
中医学认为AMD主要与年老体弱和脏器虚衰有关,其中脾气虚为早期AMD的主要病机。关国华等[89]认为,脾主运化,脾气虚则运化无力,气血津液化生不足,而后发展为肾气虚,肾气虚则鼓动无力,主水与藏精功能失职,导致水湿或痰湿潴留,即为本病早期所表现的玻璃膜疣[89]。陈达夫认为,黄斑色黄,居中,属足太阳脾经。脾虚失运,不能将水谷精微向上输于头目,目失濡养,因虚致瘀,气血津液失其常道,不能上承于目,可见眼底黄白色渗出及玻璃膜疣[90]。王明芳认为AMD初期,多因脾胃虚弱,精气生化乏源,气血不能上承于目,黄斑失养,故而出现黄斑色素紊乱;脾虚运化功能失常则水湿痰浊之邪内生,上犯目窍则为黄斑玻璃膜疣[91]。庄曾渊等将AMD的临床辨证论治与现代医学体系中疾病发展进程相关联,认为在AMD早期肝血不足,目失濡养,肾阴亏虚,精不上承,故而视物模糊;至中期脾虚失运,则湿浊停滞,表现为眼底玻璃膜疣的形成[92]。
6.2 玻璃膜疣不同期的治法
关国华等[93]认为,早期AMD应以健脾益气为主,兼补肝肾。并将玻璃膜疣期按临床症状分为2型治疗:一为气血失调型,以理气血、利湿化浊为治则,基本方在逍遥散的基础上随证加减;二为气虚痰浊内停型,以补气健脾、利湿化浊为治则,基本方在聪明益气汤的基础上化裁而成。王明芳认为,玻璃膜疣期可分为脾虚湿困和痰瘀互结2种证型,脾虚湿困者以三仁汤加减;痰瘀互结者,以二陈汤加减[91]。庄曾渊将AMD早期分为3种类型:①肝阴虚型,治则为养血补肝,基本方为补肝散加味;②肾阴虚型,肾精亏虚型,治则以补肾益精为主,基本方为六味地黄丸和七宝美髯丹;③脾气虚型,治则以益气健脾,基本方为参苓白术散加味[92]。陆绵绵认为,干性AMD视网膜色素异常期,病变较轻且病位局限,系因肝肾亏虚,治疗应以滋养肝肾,平补气血为主,可给予五子补肾丸、驻景丸、杞菊地黄丸加减以补肝肾;以逍遥散、归脾汤、人参荣养汤之类方药加减以补气血[90]。当疾病进展到中期,出现密集的软玻璃膜疣时,给予半夏、昆布、胆南星、浙贝母和生牡蛎等软坚散结的药物。
白英群等[94]给早期AMD患者服用杞菊地黄口服液6个月,共21例32只眼。用药后1年,在视力提高、中心视野改善和玻璃膜疣转化等方面均明显优于口服维生素E对照组。谭峻英[95]用滋阴明目丸和血塞通片治疗早期AMD患者22例,效果好于维生素E组。吕海江等[96-97]采用益气复明汤治疗32例渗出性AMD,总有效率83.8%;并以活络散结汤治疗痰瘀互结型AMD患者,共29例39只眼。结果显示,活络散结汤在提高视力、减少玻璃膜疣方面有效率较口服维生素E组有显著提高。
7 问题与展望
针对玻璃膜疣形成过程的治疗方案中,脉络膜血流增强剂、Aβ抗体和补体途径抑制剂的研发均未达到满意的临床效果。玻璃膜疣成分诱导NLRP3炎症小体激活作为AMD病理的重要环节,目前尚无靶向药物进入临床研究,这可能与NLRP3在AMD病理中的双重作用有关,研究表明抑制NLRP3可以降低视网膜炎症反应,保护RPE细胞,延缓GA进展,但在CNV中,激活NLRP3可以上调IL-18抑制视网膜新生血管[38]。以上研究提示,多种病理因素参与了玻璃膜疣的形成,只针对其中一条病理环节进行干预似乎并不能阻止AMD的进展;同时提示思考玻璃膜疣作为AMD的早期特征性病理表现,对晚期AMD病理形成的参与程度。延缓与衰老相关的视网膜组织生理的改变,以纠正异常的视网膜代谢,阻止关键产物如羟基磷灰石小球的形成和抑制炎症反应综合考虑似乎是阻止玻璃膜疣进展的合理方向。
玻璃膜疣作为早期AMD的特征性病理标志,参与晚期AMD的形成,具有很高的临床治疗价值。国内外学者就如何控制早期AMD进展,改善患者视力方面均做出了大量探索性工作及临床实践。近年来,高通量组学技术的出现使得AMD的候选生物标志物得以快速发现,但由于AMD病理状态的复杂性,各种组学技术仍然存在重复性和较高的假阳性率等问题。现代医学对于消除玻璃膜疣以达到延缓AMD进程的治疗方案中,纳秒激光及飞秒激光显示出良好的前景,但玻璃膜疣消融的同时是否会引起其他眼底并发症状还有待观察。祖国医学通过辨证论治,在控制玻璃膜疣时期向晚期转化方面展示出了良好的治疗效果,但临床研究案例有限,缺乏大数据统计分析。提示我们在临床实践中应充分发挥中西医在治疗AMD方面的各自特色,吸收现代医学的精准治疗,结合中医辨证论治,统一临床评价指标,辨病与辨证相结合,以最终达到预防疾病发生或延缓疾病进展的目的。

