手性等离激元纳米结构制备及其应用
陈佳琪,钟 婷,卢 茜,孙丰云,吴晓春
(1.成都大学 机械工程学院,四川 成都 610106;2.四川省粉末冶金工程技术研究中心,四川 成都 610106;3.国家纳米科学中心,北京 100190)
0 引 言
手性是非对称结构的分支,手性结构无法通过平移、旋转等空间运动与它的镜像重合(如图1(a)所示),具有与之镜像结构相同的结构,称为其手性对映体.手性在自然界物质普遍存在(如图1(b)所示),小到纳米级的氨基酸分子、糖类,微米级的DNA、蛋白质,植物、动物(贝壳、蜗牛、甚至是人的双手),大到宇宙中的某些星系都体现出手性现象.手性几乎是生命物质的基本特征[1],人们正是发现了DNA的双螺旋手性结构才解开了生命遗传信息复制和传递的秘密.因此,理解分子的手性及手性对映体的选择性,对于理解生命生化反应有着重要的意义.
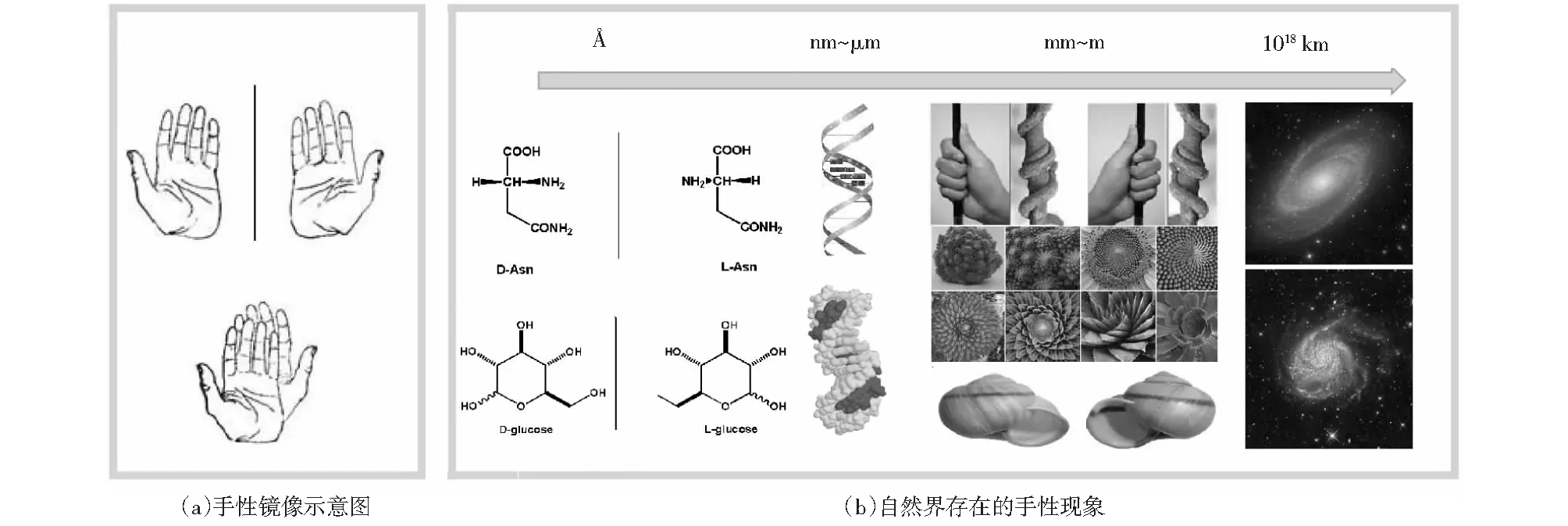
图1 手性的概念
手性等离激元纳米结构会产生表面等离激元共振相关的偶极增强,从而产生强烈的等离激元圆二色(Plasmonic Circular Dichroism,PCD)信号.多个纳米粒子的组装结构也可能相互耦合共振,从而产生扩展到整个组装体的集体PCD模式.手性等离激元纳米结构的应用也非常丰富[2-3].目前,由于合成方法和检测手段的局限,手性等离激元光子学的快速发展还面临不少挑战,因此,对手性无机纳米结构的普遍构筑方法进行总结,对目前研究中存在的不足进行分析,并讨论可能的解决方案是很重要的.
1 手性基本概念
检测手性光学活性的原理如图2所示.
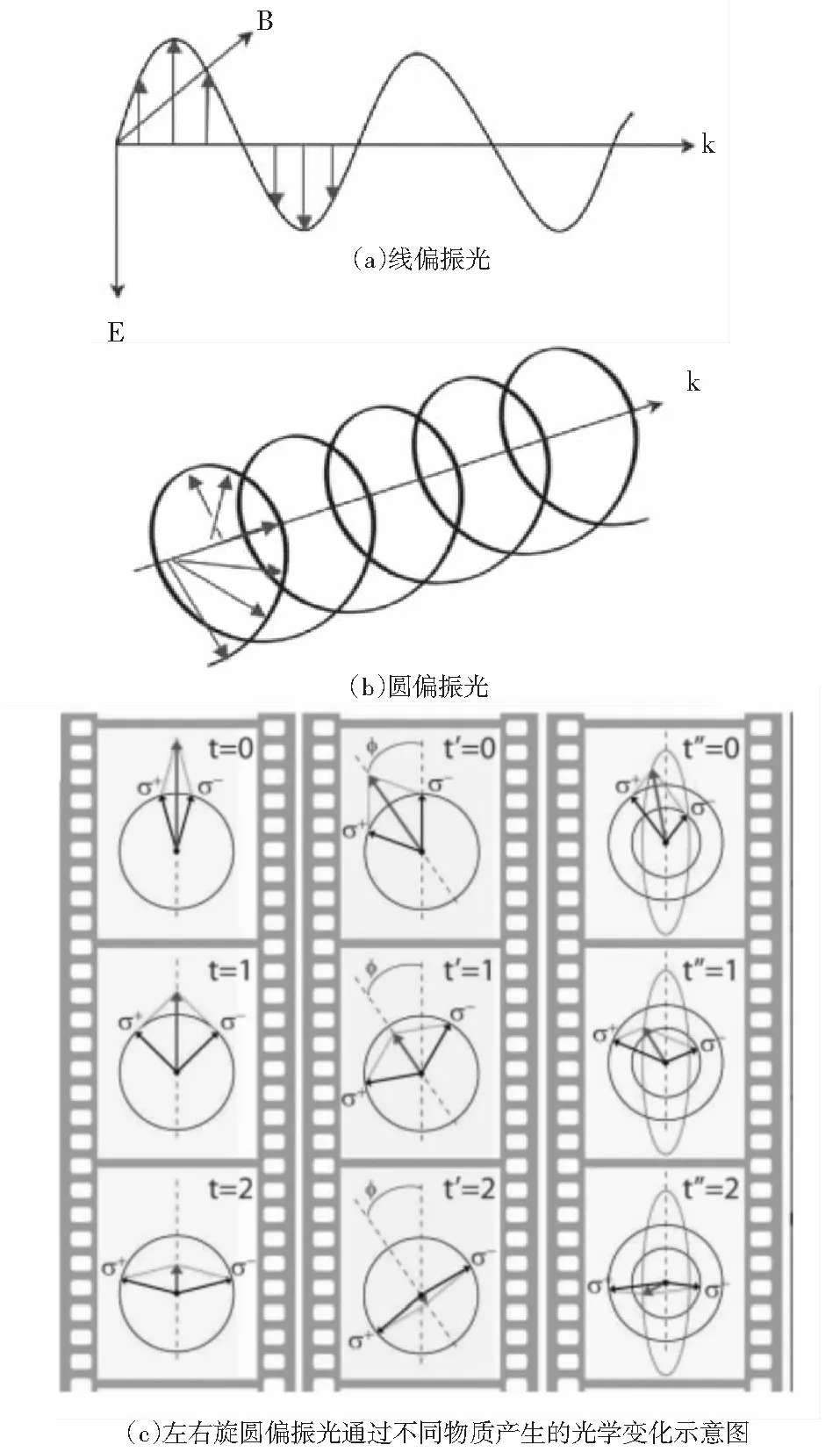
图2 检测手性光学活性的原理示意图
光是一种电磁波,由相互垂直的电场和磁场周期振动传播构成.自然光中包括了各个方向上振动的光,如图2(a)所示,把一束光通过一个偏振片后,可以滤掉其他方向上振动的多余光波,得到在一个方向上振动的光,即线偏振光,由于其光矢量都在一个平面内又被称为平面偏振光.线偏振光的电磁场振幅不变,振动的方向也不随传播的距离发生变化.而圆偏振光是在振幅不变的情况下,振动方向随着时间发生旋转,最大振幅轨道呈现圆形,如图2(b)所示.迎着圆偏振光来的方向,电矢量顺时针旋转的圆偏振光叫右旋圆偏振光,相反为左旋圆偏振光.图2(c)中的波矢量代表线偏振光,可以看作是两个振幅相同的左右旋圆偏振光的叠加,波矢量箭头方向代表叠加线偏振光的振动方向.检测到叠加的线偏振光不仅在方向上发生变化,而且在不同的振动方向上振幅不同,最大振幅轨迹呈现椭圆状,这种性质被称作物质的圆二色性(circular dichroism,CD).
用椭圆偏振光的椭圆度θ表示物质的圆二色性,如图3所示.θ和左右旋圆偏振光的振幅EL和ER之间的关系可以用公式(1)表示,

图3 右和左旋圆偏振光对椭圆偏振光的不均匀贡献
(1)
式中,I表示检测到的光强,当IL和IR相等时,θ为0,叠加是线偏振光;如果IL或IR其中任何一个为0,则θ最大为45°,为单一的圆偏振光.通常得到的IL和IR的差别很小,因此θ很小,单位用毫度(mdge)表示.根据左右旋光吸光度的差值△A=AR-AL,由公式(2)可近似求θ,
θ(mdeg)=32 982△A
(2)
另外,Kuhn定义了一个无量纲的量,不对称因子(g因子),其不受样品的浓度和光程影响,可用于不同系统间光学活性的定量比较,并可根据测量的吸光值和CD值计算.
(3)
2 手性等离激元纳米结构的分类
近年来,手性等离激元光子学发展迅速[4-5].具有光学活性的等离激元纳米结构主要分为3种:1)具有手性形状等离激元纳米结构;2)非手性的等离激元纳米结构组装的手性纳米结构;3)非手性的等离激元纳米结构与手性分子偶极—偶极相互作用.对于这些手性等离激元纳米结构,其光学活性主要表现在局域等离激元共振相关的圆二色信号,即等离激元圆二色性(PCD),具体如图4所示.

图4 3种可能产生PCD的等离激元纳米结构
2.1 诱导的等离激元圆二色性
理论和实验结果都表明,手性分子吸附到等离激元纳米结构上会产生诱导的PCD信号,从实验观察到,在玻璃平面上的金纳米半球表面吸附手性分子后,能在600 nm左右产生PCD信号[9],更重要的是,该PCD信号随着金纳米球表面的非手性隔层厚度的增加,手性分子和金纳米球之间的距离加大而逐渐减弱直到消失.
2.2 手性形状的等离激元纳米结构
有理论计算预测,即使有很小的螺旋凹槽或凸起出现在金纳米球上,都会在金纳米球的局域等离激元共振峰附近出现CD,即PCD信号[7-8].然而,实验上很难证实,因为很难从形貌上判别这种微弱手性形状的生成[9].
很长一段时间内,制备具有手性形状的等离激元纳米结构的方法是直接采用“自上而下”的加工方式[8],如采用聚焦离子束、电子束光刻、掠射角沉积、多光子激光直接写技术以及全息光刻来构筑具有手性形状的纳米结构,如图5所示.图5采用“自上而下”的加工方法构筑的手性形状的等离激元纳

图5 手性形状的等离激元纳米颗粒类型
米结构,表现出了很强的手性光学活性,一般分为以下3种:1)平面的手性结构[10],如螺旋桨形状的和卍字形结构;2)三维的手性结构[8,11],如螺旋柱状结构,两种或多种非手性的结构螺旋堆叠的结构等;3)手性等离激元阵列[12],相对于前两种结构,这种结构的构筑过程最简单.
2.3 手性组装体的等离激元纳米结构
目前,最常见的策略就是采用一个大的手性模板,将非手性的等离激元纳米结构组装成一个手性超结构,等离激元纳米结构之间耦合而产生PCD响应,具体如图6所示.利用各种各样的手性模板,借助共价或非共价相互作用,将等离激元纳米结构吸附到模板上形成手性排列.第一个观察到PCD响应的手性组装结构是双链的DNA模板上吸附银纳米颗粒的结构[13],随后,DNA就被广泛用作手性组装的模板[14-15].在D-和L-二苯基丙氨酸肽吸附的纳米管上吸附的等离激元纳米粒子团簇,也显示出了镜像对称的PCD信号[16].在进一步的发展中,Guerrero-Martínez 等[17]将蒽醌基草酰酰胺制成的手性超分子纤维用于组装各向异性的金纳米棒,得到了不那么完美的螺旋组装结构,却产生了很强的PCD信号;此后,许多其他类型的模板,包括氨基酸[18]、磷脂[19]、纳米晶[20]都被用于了组装.最近,Oda等[21]将手性二氧化硅用于组装纳米颗粒,通过改变模板的螺距和螺旋度以及纳米颗粒的大小,实现了PCD信号的调制.Kumacr等[22]用蛋白纤维作为模板的等离激元纳米结构组装结构,可用于检测帕金森氏病和朊病毒病.
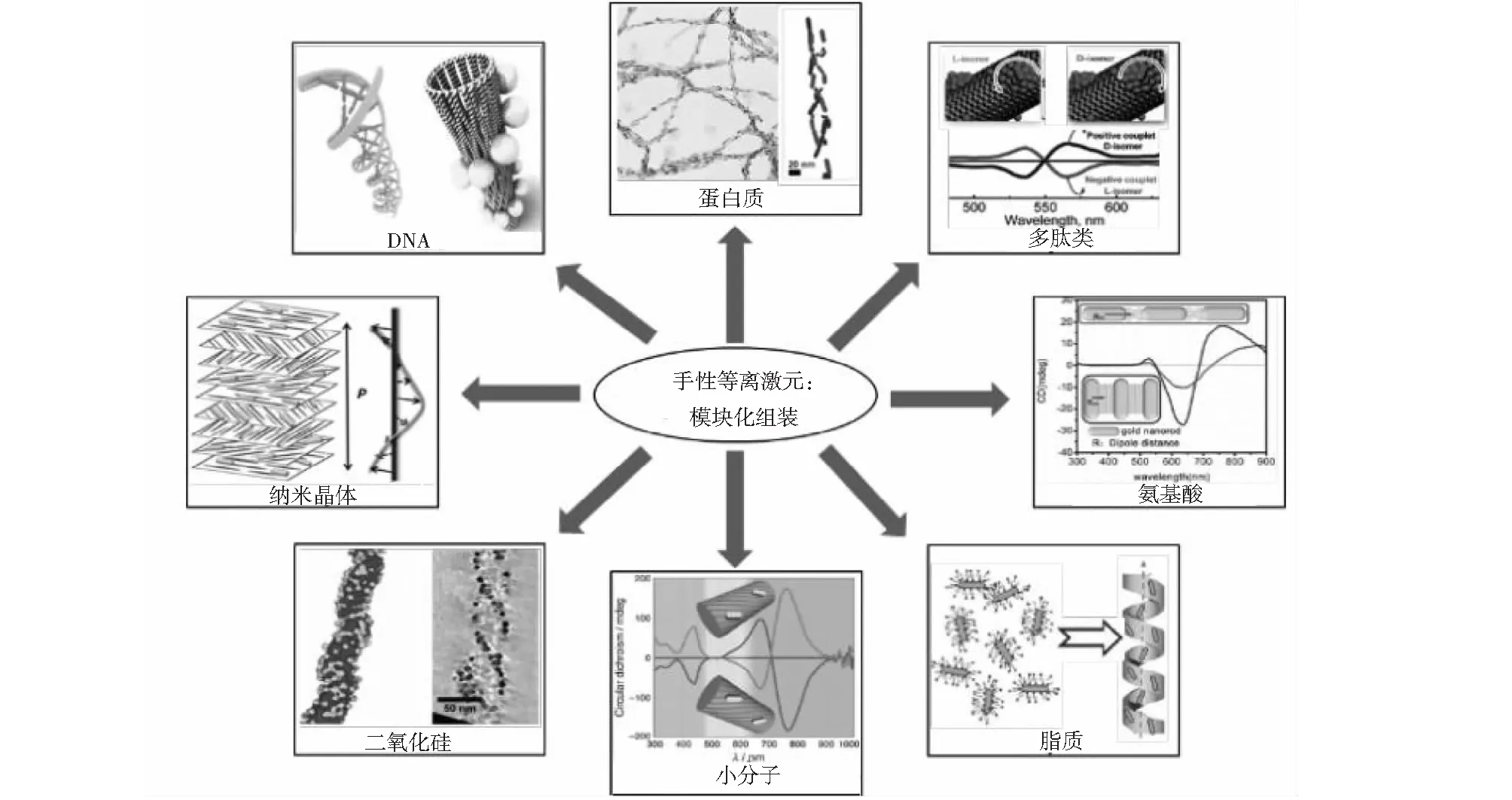
图6 组装的手性空间结构的模板种类[20-28]
可以看出,目前使用的模板很大一部分是由生物分子构成的,因此这种技术可以在生物检测、传感和治疗中得到广泛的应用[2].
3 应用前景
近年来,手性等离激元纳米结构的合成和机理研究取得了一定的进展,研究人员正致力于寻找这些材料的合理应用.尽管手性等离激元纳米结构在许多领域都有潜在应用,但仍面临诸多挑战.
3.1 手性检测
手性等离激元纳米结构具有较强的旋光性,可用于某些疾病的检测和治疗.通过组装纳米结构,可以进一步增强光学响应,从而提高潜在检测平台的灵敏度.在这个方向上,胥传来等已经将手性等离激元纳米结构用于DNA[24]、microRNA[25]、癌症生物标志物[26]和某些糖蛋白的检测[27].
Kumar等[22]将金纳米棒的手性组装结构应用到了帕金森病的淀粉样原纤维检测中.基于金纳米棒与稳定的单体蛋白和感染的纤维蛋白之间存在不同的相互作用,金纳米棒组装体的PCD信号可以用来区分单体的和纤维状态的蛋白质如图7所示.此传感技术还应用于人类大脑匀浆的检测,显示在可见和近红外光谱范围内的PCD信号,为区分帕金森患者和健康大脑样本提供了可能,证实了其作为检测平台应用于神经退化性疾病的广泛潜力.
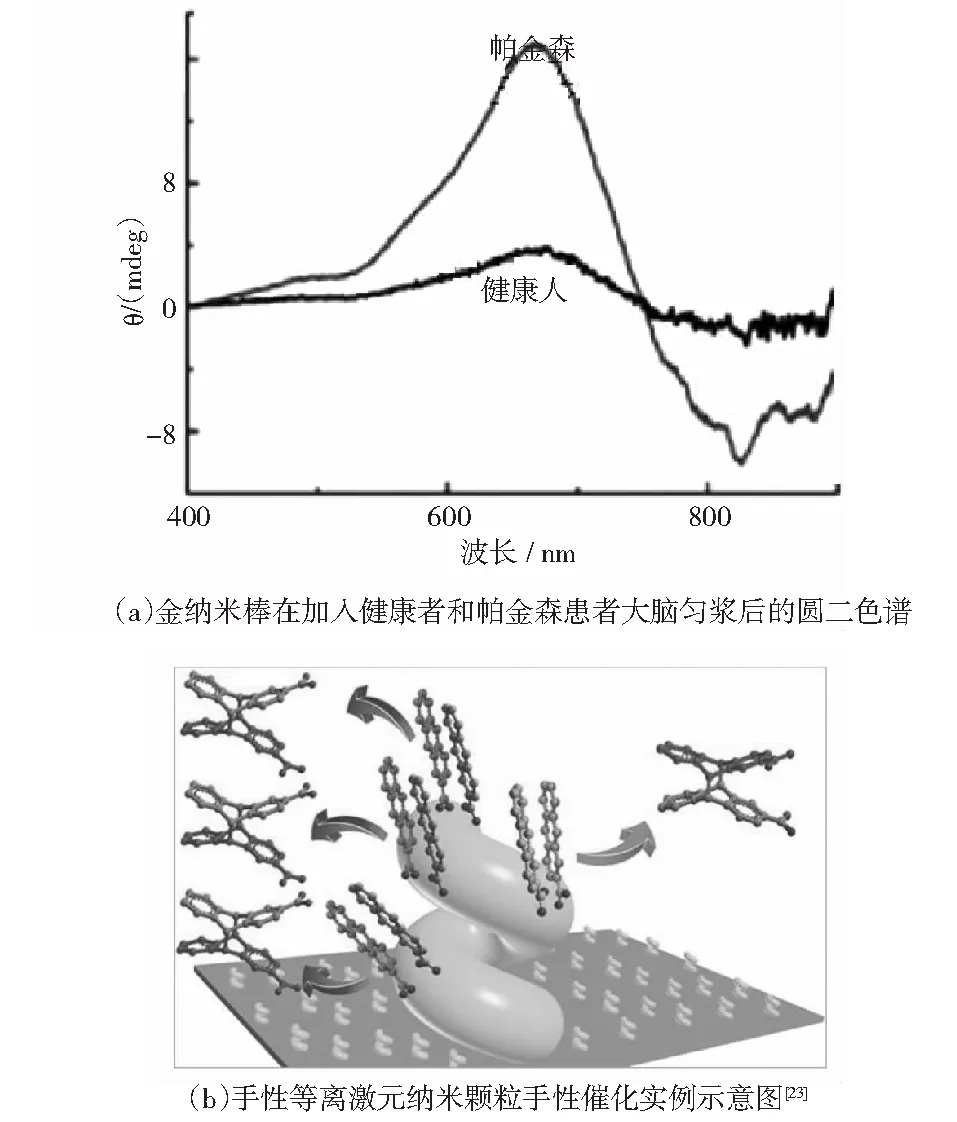
图7 手性纳米结构在疾病检测以及催化方面的应用
3.2 手性催化
实际上,手性对映异构化合物的富集和纯化是通过同手性催化剂介导的对映体分化或拆分反应来实现的[28-29],包括小的同手性分子,以及高分子和超分子手性催化剂.另一方面,手性无机晶体表面为区分不同的对映异构体提供了途径[30].最近,四川大学杨成团队,南方科技大学王阳刚团队和香港浸会大学黄陟峰团队合作,首次通过分步传递的方式,将宏观旋转诱导的螺旋信息转化为分子手性偏向,实现了2-蒽羧酸(AC)的选择性手性光化学环二聚(光手性)反应,如图7(b)所示[23].
3.3 生物医学方面
手性等离激元纳米材料另一个备受关注的应用领域是生物医学.
纳米粒子细胞内化的监测新技术是若干研究小组正在进行的一个活跃的研究课题.胥传来和Kotov等利用DNA桥接的纳米颗粒二聚体的手性信号(PCD信号),可以跟踪哺乳动物细胞内纳米粒子的内化过程[31].当二聚体从组织液进入细胞质中时,纳米粒子之间的静电斥力会发生很大的变化.这些组合平衡构象的改变会导致连接纳米粒子的DNA自发扭转,最终导致PCD信号的反转,PCD信号在跨膜转运过程中由负向正的反转被用来识别内化.如图8所示.
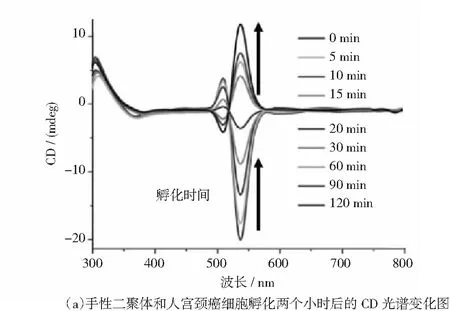

图8 手性等离激光纳米材料在生物医学方面的应用
光动力疗法(PDT)是一种有效、无创、定点选择性的光学疗法,用于肿瘤细胞的局部消融.Gao等[32]制造了以DNA为基础的纳米颗粒组装体作为手性光敏剂,如图9所示.此等离激元纳米结构通过在金纳米颗粒表面偶联半胱氨酸分子,在可见光区域内表现出较强的手性信号,在右旋圆偏振光照射下,手性纳米组装体在单线态氧产生方面表现出了较高的效率,其产率为1.09.相对低剂量的此手性光敏剂即可达到PDT细胞内活性氧阈值,与传统药物相比,在体外表现出超凡的效率.
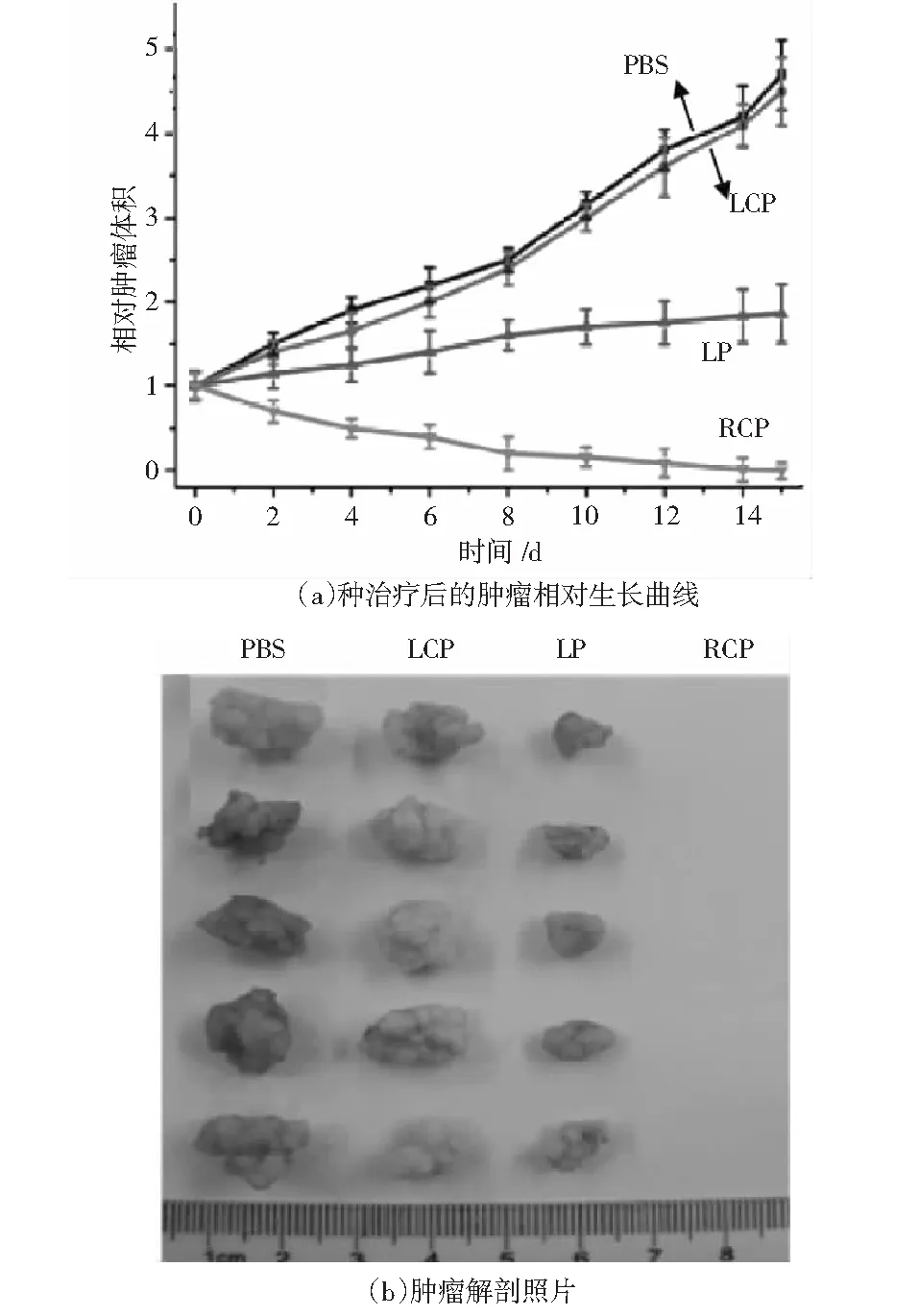
图9 采用卫星手性等离激元结构动力学治疗方案示意图
4 结论和展望
综述了3种不同类型的手性等离激元纳米结构在近年来的制备方法和光学特性.第1类是诱导的手性等离激元体系,手性分子可以在非手性等离激元纳米颗粒的等离激元共振吸收峰附近诱导产生手性等离激元圆二色信号,但这种信号一般比较弱.第2类是具有手性形状的等离激元纳米结构,一方面,先进的纳米微加工技术使得这种手性形状(螺旋、罗盘状)的纳米颗粒得以制备,这种纳米颗粒具有较强的手性光学响应,可以通过操纵它们的形状来调节其光学响应大小和区域;另一方面,利用手性小分子调控具有手性形状的等离激元纳米颗粒“自下而上”的生长方法,一直是科学工作者探索的方向,目前为止,仅有几个先导性的工作实现了此类结构的湿化学可控合成,由于检测方法的局限,从分子和原子相互作用层面上,理解这些纳米颗粒的手性生长起源仍然是个难题.第3类是将非手性的等离激元纳米颗粒组装而成的手性空间结构,一种合成方法是将金属颗粒附着在手性主体上,如多肽、纤维素、表面活性剂混合物等手性模板,但此类方法受限于模板,从而对结构几何形状的控制有限,还需进行更多的努力来获得良好控制的结构形态;另一方面,利用DNA自组装技术可实现金属纳米颗粒在手性框架中的精确定位,提供了一种对手性结构几何形状精确控制的组装方法,特别是利用这种结构可通过对大量刺激物触发几何重构,为动态传感提供了新途径.手性等离激元纳米结构具有独特的物理、化学和生物特性,未来在手性光学器件、多种疾病生物标志物的超灵敏检测、对映体选择性催化以及跨膜转运和细胞内代谢的光学监测中都具有巨大应用潜力.

