基于MAPK信号通路Nell-1蛋白对人牙髓干细胞神经向诱导分化的作用
闫雪萍 吴杉杉 王利婷 史璐
牙髓神经是存在于牙髓组织内的神经感受器,主要发挥感觉功能,并参与调控牙髓微环境和牙本质再生,通过提高牙髓神经的再生功能,对于损伤牙齿正常功能的修复、减少牙髓治疗相关并发症有重要意义[1-2]。神经细胞本身缺乏再生能力,损伤后难以自我修复,因此如何促进神经细胞修复成为研究热点。人牙髓干细胞(human dental pulp stem cells,hDPSCs)是由神经嵴发育而来、位于牙髓组织中的成体干细胞,具有与骨髓间充质干细胞相似免疫表型,可自我更新和多向分化,有较强的克隆能力,且有易获得、培养条件简单的优点,为牙髓神经细胞的再生修复提供了新的研究途径[3]。尼尔样-1型分子(nel-like molecule-1,Nell-1)是一种具有高度保守性的分泌型蛋白,对于成骨细胞分化、新生骨形成等方面有正向调节作用[4]。研究[5]证实,Nell-1能与其位于成骨谱系细胞表面的受体Integrinβ1结合,启动丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号级联,影响细胞的粘附、增殖与分化。目前关于Nell-1促进成骨向分化的相关研究较多,在神经向分化方面的相关研究较少。本研究通过体外分离hDPSCs,研究Nell-1蛋白基于MAPK信号通路对hDPSCs神经向诱导分化的调控作用及机制,为牙髓疾病的治疗提供依据。
1 材料与方法
1.1 材料
1.1.1 细胞取材 取材于口腔颌面外科门诊18~25 岁志愿者,因正畸或阻生齿新鲜拔除健康完整恒牙,从中分离hDPSCs。研究实施前向志愿者讲述牙齿用途,均知情同意,并获得医院伦理委员会批准。
1.1.2 药物、主要试剂和仪器 人重组Nell-1蛋白[(R&D systems,lic.Minneapolis,MN55413,USA);300 μg/mL Nell-1蛋白存储液配制:50 μg Nell-1蛋白溶解于167 μL无菌PBS中,以200 μL每EP管分装,保存于-40 ℃];p38MAPK激酶抑制剂SB203580、E-Gel Imager凝胶成像仪(Invivogen公司,美国);β-微管蛋白3(β-tubulin class III,β-tubulin-II)单抗、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)单抗、p38丝裂原活化蛋白激酶(p38MAPK)单抗、cAMP应答元件结合蛋白1(cAMP responsive element binding protein-1,cREB-1)、磷酸化(phosphorylated,p)-p38MAPK单抗(Abcam,英国);p-cREB-1、GAPDH单抗(上海信帆生物科技有限公司);异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、辣根过氧化物酶标记标记的羊抗鼠IgG抗体(广州健仑生物科技有限公司);ELx 800酶标仪(BioTek公司,美国);FACSCanto II流式细胞仪(BD公司,美国);EVOS M7000倒置荧光显微镜(赛默飞世尔,美国)。
1.2 方法
1.2.1 hDPSCs的分离培养及鉴定 牙体清洁后劈开取出牙髓,根据参考文献[6],以组织块酶消化法分离hDPSCs,加入含15%胎牛血清的α-MEM培养液后置于培养瓶中,于37 ℃、5%CO2培养箱中培养。细胞贴壁后以0.25%胰酶37 ℃消化40 min,4 ℃ 1 000 r/min离心5 min,离心半径10 cm,弃上清,传代培养,取第3代细胞以流式细胞技术鉴定细胞免疫表型。
1.2.2 hDPSCs向神经样细胞诱导分化 第3代hDPSCs细胞以2×105个/孔密度接种于24孔板,每组5 个复孔,分为对照组、Nell-1组和Nell-1+MAPK抑制剂组,细胞贴壁达80%弃原培养液,加入预诱导液(MEM、20%胎牛血清、10 μg/L碱性成纤维细胞生长因子)培养24 h后更换神经诱导液(1 μmol/L氢化可的松、2%二甲基亚砜、200 μmol/L丁羟基茴醚、10 μmol/L forskolin、0.1 mmol/L β-巯基乙醇继续培养,每3 d更换神经诱导液。其中Nell-1组神经诱导液加入含100 ng/mL的Nell-1,Nell-1+MAPK抑制剂组神经诱导液加入含100 ng/mL的Nell-1与10 μmol/L SB203580。倒置显微镜下观察细胞形态学变化。
1.2.3 免疫荧光检测hDPSCs神经元早期标志物表达 诱导分化后第12天,制作各组细胞爬片,PBS洗涤3次,4%甲醛室温固定20 min,通透20 min,5% BSA封闭30 min,加入一抗β-tubulin-III、GFAP,FITC标记的IgG二抗,封片后荧光显微镜下观察并检测荧光强度。
1.2.4 Western blot检测p38MAPK、p-p38MAPK、cREB-1、p-cREB-1蛋白相对表达量 取各组诱导分化第12天细胞,加入RIPA裂解液,BCA法蛋白定量,SDS-PAGE电泳,转移至PVDF膜,室温下摇床封闭2 h,加入一抗、二抗,37 ℃孵育1 h,Image J软件分析条带灰度值,以目的蛋白条带灰度值与内参GAPDH灰度值比值表示蛋白相对表达量。
1.3 统计学分析

2 结 果
2.1 hDPSCs分离培养鉴定
hDPSCs培养7~10 d镜下观察可见牙髓细胞从组织块边缘爬出,围绕组织块向四周生长,呈放射状。原代hDPSCs传至第3代可见外形均匀,多数为梭形,成集落状生长,可用于后续实验(图 1)。流式细胞仪检测hDPSCs表面抗原显示,CD34、CD45表达阴性,CD105、CD90表达阳性,阳性细胞比率分别为98.52%、99.23%,符合hDPSCs的表面抗原(图 2)。
2.2 hDPSCs神经诱导分化细胞形态变化
hDPSCs诱导前细胞梭形为主、部分为卵圆形或多角形,体积小、轮廓清晰;诱导分化后12 d Nell-1组可见细胞形态为神经元样生长,成网状突起,相互链接,核大而圆位于细胞中央;对照组与Nell-1+MAPK抑制剂组可见细胞体积收缩,为神经球样生长(图 3)。

图 2 流式细胞仪检测hDPSCs表面抗原表达

图 3 hDPSCs神经诱导分化前后细胞形态变化
2.3 免疫荧光检测各组神经元早期标志物表达情况
诱导分化12 d对照组、Nell-1组、Nell-1+MAPK抑制剂组均有β-tubulin-III、GFAP阳性表达(图 4)。对β-tubulin-III、GFAP相对荧光强度值组间比较,差异有统计学意义(P<0.001);Nell-1组的β-tubulin-III、GFAP相对荧光强度值高于对照组和Nell-1+MAPK抑制剂组(P<0.05)(表 1)。
2.4 各组细胞p-p38MAPK/p38MAPK、p-cREB-1/cREB-1表达比较
Nell-1组p-p38MAPK/p38MAPK、p-cREB-1/cREB-1均高于对照组和Nell-1+MAPK抑制剂组(P<0.001)(图 5、表 2)。
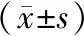
表 1 β-tubulin-III、GFAP蛋白荧光定量比较

图 4 各组hDPSCs神经诱导分化12 d后β-tubulin-III、GFAP免疫荧光图(×200) 图 5 各组hDPSCs p-p38MAPK、p38MAPK、p-cREB-1、cREB-1蛋白的Western blot检测
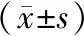
表 2 p-p38MAPK/p38MAPK、p-cREB-1/cREB-1表达的组间比较
3 讨 论
近年来,随着干细胞疗法和组织工程学的不断发展,利用干细胞移植促进损伤神经的修复和再生相关研究不断涌现。hDPSCs因组织来源和生物学特征均与神经干细胞相似,具有来源丰富、无伦理争议、副作用小的特点,被大量应用于口腔疾病、阿尔兹海默病、帕金森病、脊髓损伤的治疗等神经损伤修复和再生研究中[7-8]。Nell-1是与人类颅缝早闭症相关的分泌型蛋白,在颅骨和神经组织中优先表达,被证实能诱导牙髓细胞向成牙本质细胞样细胞及神经样细胞分化,但关于诱导分化机制尚未明确[9]。故本研究通过探讨Nell-1蛋白对hDPSCs神经向分化的调控作用及机制,以期为临床牙髓损伤的修复提供理论指导。
本研究中酶消组织块法培养hDPSCs后经鉴定培养成功,可用于后续实验。hDPSCs神经样诱导分化后12 d Nell-1组可见细胞成神经元样;免疫荧光检测各组均β-tubulin-III、GFAP阳性表达,且Nell-1组的β-tubulin-III、GFAP相对荧光强度值高于对照组和Nell-1+MAPK抑制剂组,说明Nell-1可定向诱导hDPSCs神经样分化。Nell-1蛋白最早从颅缝早闭患儿颅骨中分离得到,能诱导病理性成骨的形成,是新型促成骨因子,对成骨细胞分化、矿化及骨的形成和再生有诱导作用[10]。因牙髓组织与骨组织来源于颅神经嵴细胞,二者在组织来源方面具有同源性,故被用于神经向分化的研究中[11]。β-tubulin-III具有神经元特异性,是原始神经上皮中表达最早的神经标志物之一[12]。GFAP主要分布于中枢神经系统的星形胶质细胞,参与细胞骨架的构成并维持其张力强度,是神经胶质细胞标记物[13]。韩琦[14]研究中,以Nell-1蛋白促进hDPSCs神经向分化,结果Nell-1干预组诱导后的hDPSCs细胞有神经表面标记物GFAP、Nestin mRNA及蛋白的表达,证实Nell-1能定向诱导hDPSCs神经向分化,与本研究观点一致。
MAPK信号通路是介导细胞对胞外信号反应的重要通路,由一组以级联方式活化的丝/苏氨酸蛋白激酶组成,参与细胞因子、生长因子、激素及应激等刺激引起的各种反应及细胞的增殖、分化和凋亡等生理活动[15]。P38激酶是MAPK家族主要成员,p38MAPK信号通路能被多种刺激性信号激活,激活的p38MAPK通过磷酸化核转录因子、细胞骨架蛋白及酶类等参与细胞的增殖、分化及凋亡等生理活动的调节[16]。cREB-1是p38MAPK下游蛋白,p38MAPK被激活后可活化CREB等转录因子,调节细胞的增殖、分化等活动[17]。陈双庆等[18]研究显示,MAPK信号通路是介导脑源性神经营养因子促进诱导多能干细胞分化为神经干细胞的关键通路。王志华[19]研究发现,LPS刺激hDPSCs增殖定向分化能力主要与MAPK信号通路蛋白的活化有关。上述研究均说明MAPK在多能干细胞分化过程中起重要调节作用。本研究结果中Nell-1组的p-p38MAPK/p38MAPK、cREB-1/cREB-1高于对照组,说明Nell-1蛋白可能通过激活MAPK信号通路蛋白活化发挥促进hDPSCs神经向分化过程,加入MAPK抑制剂后,hDPSCs神经向分化过程被抑制,进一步证实MAPK信号通路蛋白活化促进hDPSCs的神经向分化的研究结论。
综上所述,Nell-1蛋白可影响对hDPSCs的神经向分化,MAPK通路中p38MAPK、cREB-1蛋白磷酸化参与Nell-1调控hDPSCs的神经向分化过程,可为牙髓损伤修复机制的研究提供机制。

