酵母培养物替代鱼粉对大口黑鲈生长性能、血清生化指标和肠道形态结构的影响
卞宇豪 许晓莹 段志鹏 孙中超 刘江英 李小勤 冷向军*
(1.上海海洋大学水产与生命学院水产科学国家级教学示范中心,上海 201306;2.上海海洋大学水产与生命学院农业部鱼类营养与环境生态研究中心,上海 201306;3.上海海洋大学水产与生命学院水产动物遗传育种中心上海市协同创新中心,上海 201306;4.上海源耀生物股份有限公司,上海 200000)
鱼粉粗蛋白质含量高、氨基酸平衡、适口性好、未知促生长因子含量丰富,是肉食性鱼类饲料中主要的蛋白质源。但是,由于水产养殖业的迅速发展,不良气候的自然影响和过度捕捞的人为影响等因素,全球水产饲料对鱼粉的需求量急剧增加,鱼粉价格持续上涨,严重制约了水产养殖业的进一步发展。因此,节约鱼粉的使用量并寻找合适的新型替代物成为饲料工业急需解决的问题。
酵母培养物是指在特定工艺条件控制下,由酵母菌在特定培养基经充分厌氧发酵后得到的微生物制品,主要由酵母细胞外代谢产物、经过发酵后变异的培养基和少量已无活性的酵母细胞所构成[1]。目前,有关酵母培养物在水产饲料中的应用研究,在异育银鲫(Carassiusauratusgibelio)[2]、草鱼(Ctenopharyngodonidellus)[3]、团头鲂(Megalobramaamblycephala)[4]和凡纳滨对虾(Litopenaeusvannamei)[5-6]均有报道。酵母培养物在增强动物生长性能、提高动物机体免疫力、提高动物抗病力和对动物肠道健康具有积极作用[7]。
大口黑鲈(Micropterussalmoides)是一种具有很高经济价值的肉食性鱼类,其肉质鲜美,无肌间刺,营养价值高,在中国已广泛养殖。2019年全国大口黑鲈产量已达到47.8万t[8]。大口黑鲈对饲料中蛋白质的营养需求较高,商业饲料中的鱼粉含量一般高达40%~50%,因此,研究寻找适宜的新型蛋白质源替代鱼粉具有极其重要的意义。目前,在大口黑鲈饲料中已报道过的替代鱼粉的蛋白质源有豆粕[9]、发酵豆粕[10-11]、血粉[12]和羽毛粉[13]等,但尚未见酵母培养物在大口黑鲈饲料中的应用报道。故本试验以大口黑鲈为研究对象,以酵母培养物替代不同比例鱼粉,考察其对大口黑鲈生长性能、血清生化指标及肠道组织结构的影响,为开发大口黑鲈高效绿色环保饲料和酵母培养物在水产饲料中的合理应用提供理论支持。
1 材料与方法
1.1 试验设计与试验饲料
根据大口黑鲈的营养需求[14],配制鱼粉含量为35%的基础饲料(对照组),用酵母培养物等蛋白质替代对照组饲料中5%、10%、15%的鱼粉,共配制成4种等氮等脂的试验饲料,其鱼粉含量分别为35%、30%、25%和20%,记为FM-35(对照)、FM-30、FM-25和FM-20。饲料配制过程采用人工添加配料,饲料原料经超微粉碎机(800Y,永康市铂欧五金制品有限公司)粉碎后,过60目筛。按饲料配方称重,逐级混匀,加入适量的水,混匀后过10目筛,经制粒机(SLP-45,中国水产科学研究院渔业机械仪器研究所研制)制成直径为2 mm的颗粒,50 ℃烘干至水分含量低于10%,密封后-20 ℃保存。试验饲料组成及营养水平见表1。
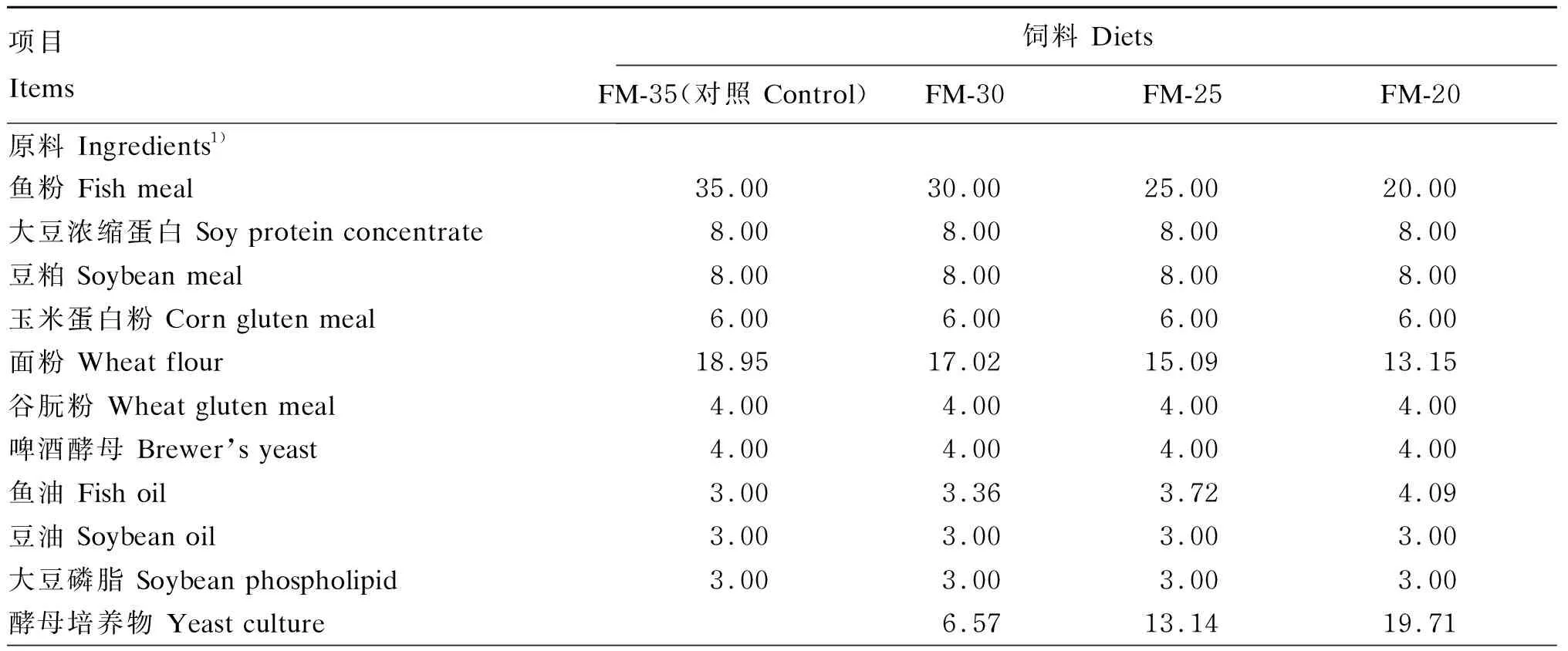
表1 试验饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets (air-dry basis) %
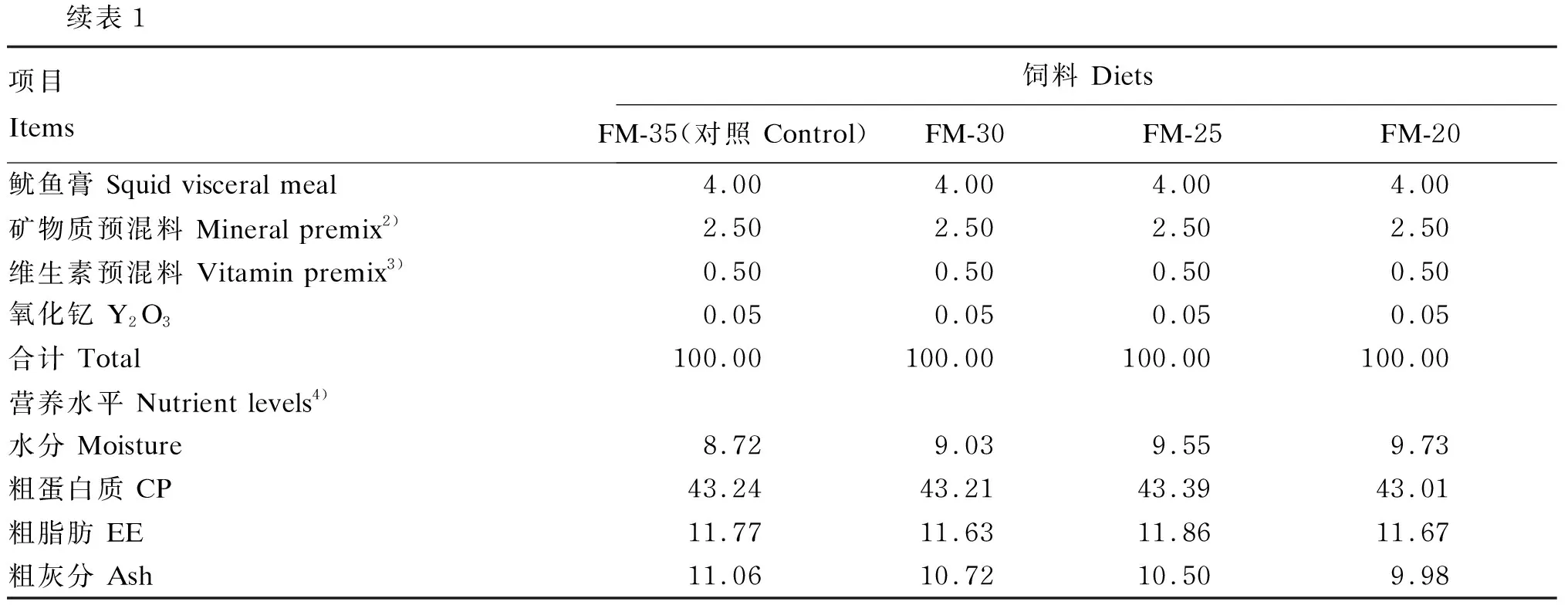
续表1项目 Items饲料 DietsFM-35(对照 Control)FM-30FM-25FM-20鱿鱼膏 Squid visceral meal4.004.004.004.00矿物质预混料 Mineral premix2)2.502.502.502.50维生素预混料 Vitamin premix3)0.500.500.500.50氧化钇 Y2O30.050.050.050.05合计 Total100.00 100.00 100.00 100.00 营养水平 Nutrient levels4)水分 Moisture8.729.039.559.73粗蛋白质 CP43.2443.2143.3943.01粗脂肪 EE11.7711.6311.8611.67粗灰分 Ash11.0610.7210.509.98
所用酵母培养物由上海某生物股份有限公司生产,是以优质豆粕、葡萄糖、谷朊粉等为培养基底物,接种酿酒酵母菌(Saccharomycescerevisiae),经深度发酵、升温自溶、低温干燥、超微粉碎所得到的发酵产品。其中,深度发酵的条件:53%发酵水分(w/w)发酵48 h,酵母接种后初始发酵菌总数:5×108CFU/g。升温自溶后酵母破壁率90%以上。低温干燥条件:物料温度60~70 ℃,10 min。超微粉碎后物料细度:90%通过60目筛,100%通过40目筛。酵母培养物的粗蛋白质含量55.7%,粗脂肪含量1.6%,粗灰分含量6.5%,粗纤维含量4.6%,甘露聚糖含量2.2%,核苷酸含量2 014 μg/g,酵母接种量5×108CFU/g。
测定饲料氨基酸组成时,饲料样品在110 ℃条件下用6 mol/L盐酸水解24 h。用氨基酸自动分析仪(S-433D,德国)测定氨基酸含量。饲料及酵母培养物氨基酸组成见表2。
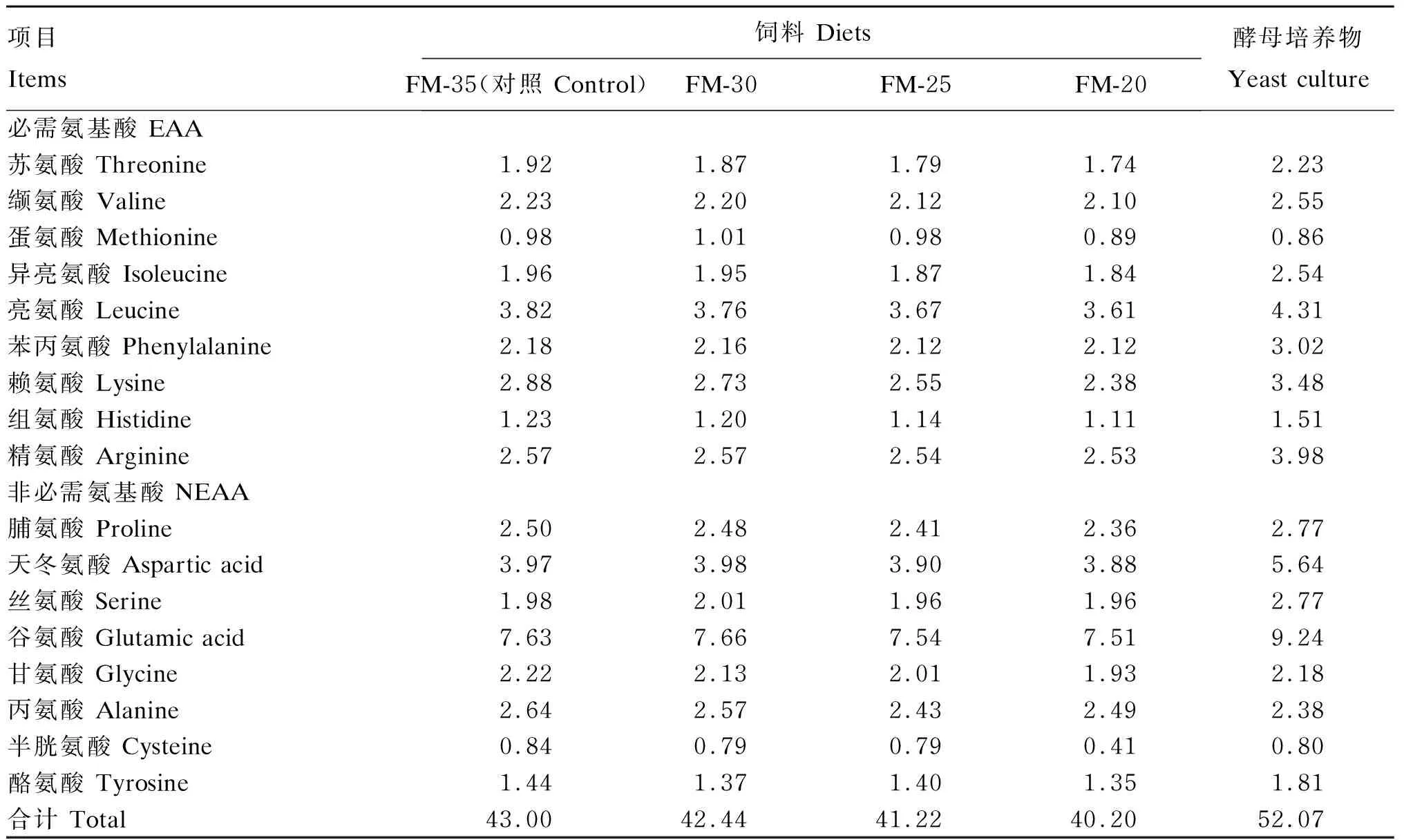
表2 饲料及酵母培养物氨基酸组成(干物质基础)Table 2 Amino acid composition of diets and yeast culture (DM basis) %
1.2 试验鱼及饲养管理
试验用大口黑鲈采购自浙江湖州鲈鱼养殖场,以基础饲料暂养驯化4周后,挑选体质优良、规格均匀、平均体质量为(21.2±0.1) g的大口黑鲈300尾进行养殖试验,养殖条件为室内养殖,试验共设置4个组,每组3个平行(桶),每个塑料桶(直径1.0 m,高1.0 m,水体体积550 L)随机放置鲈鱼25尾。养殖用水为循环水,每个桶每分钟流量为10 L。养殖期间,采用近饱食投喂方式喂食,每天投喂饲料2次(08:00、16:00),日投饲率为鱼体重的2.0%~4.0%,并根据进食情况和天气情况及时调整,各桶投饲量保持基本一致。昼夜充气,采用虹吸方式吸走桶底粪便,每天吸污1~2次(养殖前期1次,后期2次),每周换水2次,换水量为循环系统的1/3~1/4。养殖在自然光下进行,水源为曝气处理后溶氧充足的自来水,水温22~30 ℃,溶氧含量≥5.0 mg/L,pH 6.8~7.5,氨氮含量≤0.1 mg/L,亚硝酸盐含量≤0.1 mg/L。养殖试验于上海海洋大学滨海基地进行,养殖试验共56 d。
1.3 样品采集
养殖试验开始时,取10尾鲈鱼作为初始全鱼样本。养殖试验结束后,停止投喂,鱼体饥饿24 h,记录每桶鱼的数量和总重,统计采食量,计算初均重(IBW)、末均重(FBW)、存活率(SR)、增重率(WGR)、平均日采食量(ADFI)、饲料系数(FCR)。各桶随机取3尾鱼,用于全鱼常规营养成分分析。另每桶随机取6尾麻醉后的大口黑鲈测量体长、体重,用1 mL一次性注射器从尾静脉抽血,3 000 r/min离心10 min,取上清液,保存于-80 ℃冰箱备用,用于检测血清生化指标。抽完血后,立即将鲈鱼解剖,称量内脏重和肝脏重,计算肥满度(CF)、脏体比(VSI)、肝体比(HSI)。从3尾抽过血的鲈鱼中取肠道,按照文献[16]的方法进行肠道分段,取其前肠,放入波恩试液中,用于制作肠道组织切片。
粪便收集从养殖试验的第4周开始。每次喂食后1~2 h,用虹吸方法收集粪便,取包膜完整的粪便于-20 ℃冰箱中保存。待收集到足量粪便后,于105 ℃烘干,用于营养物质消化率分析。
1.4 测定指标与方法
1.4.1 生长指标与形体指标
相关计算公式如下:
SR(%)=100×末尾数/初尾数;
WGR(%)=100×[末均重(g)-初均重(g)]/
初均重(g);
FCR=投喂量/[末均重(g)-初均重(g)];
摄食量(FR,g)=[摄入饲料总重(g)×100]/
末尾数;
HSI(%)=100×肝脏重(g)/体重(g);
VSI(%)=100×内脏重(g)/体重(g);
CF(g/cm3)=100×体重(g)/
体长3(cm);
ADFI(g)=总摄食量(g)/
[末尾数×试验天数(d)]。
1.4.2 饲料、粪便、全鱼组成和营养物质消化率、沉积率
鲈鱼及饲料样品常规分析参考AOAC(2000)。其中,水分含量通过烘箱在105 ℃下烘干至恒重测定;粗蛋白质含量采用自动凯氏定氮仪(2 300-Auto-analyzer,Foss Tecator,瑞典)测定;粗脂肪含量采用氯仿甲醇法测定;粗灰分含量是在550 ℃马福炉中灼烧12 h后测得。饲料和粪便中钇元素的分析采用等离子体原子发射光谱法(ICP)(Vista MPX,美国)。在此基础上,分别计算干物质表观消化率(ADDM)、粗蛋白质表观消化率(ADCP)、蛋白质效率(PER)、蛋白质沉积率(PRR)、脂肪沉积率(LRR),计算公式如下:
ADDM(%)=100×[1-饲料钇含量(%)/
粪便钇含量(%)];
ADCP(%)=100×{1-[饲料钇含量(%)×
粪便粗蛋白质含量(%)]/[粪便钇含量(%)×
饲料粗蛋白质含量(%)]};
PER=[末均重(g)-初均重(g)]/
摄食蛋白质量;
PRR(%)=100×[末均重(g)×末全鱼粗蛋白质
含量(%)-初均重(g)×初全鱼粗蛋白质
含量(%)]/[投喂量(g)×饲料粗蛋白质
含量(%)];
LRR(%)=100×[末均重(g)×末全鱼粗脂肪
含量(%)-初均重(g)×初全鱼粗脂肪含量
(%)]/[投喂量(g)×饲料粗脂肪含
量(%)]。
1.4.3 血清生化指标
血清白蛋白(ALB)、总蛋白(TP)含量及谷草转氨酶(AST)、谷丙转氨酶(ALT)活性等血清生化指标使用上海哈灵生物科技有限公司生产的相应试剂盒,并通过自动生化分析仪(Chemray800,雷杜Rayto)测定。血清超氧化物歧化酶(SOD)活性测定采用黄嘌呤氧化酶法;过氧化氢酶(CAT)活性测定采用钼酸铵法;总抗氧化能力(T-AOC)测定采用比色法;溶菌酶(LZM)活性测定采用比浊法。上述指标测定所用试剂盒均由南京建成生物工程研究所提供。
1.5 肠道组织切片
前肠组织放入Bouin氏固定液中,24 h后,乙醇脱水,二甲苯透明,石蜡包埋,切片(厚度为7 μm)(Leica RM2235 切片机,德国),苏木精-伊红(HE)染色,光镜下观察肠绒毛形态特征并拍照(Nikon YS100显微摄影系统),用显微测微尺测量绒毛高度、宽度和肌层厚度。
1.6 攻毒试验
攻毒试验采用嗜水气单胞菌,由上海海洋大学国家水生动物病原库提供。将原菌液加入液体LB培养基中过夜复性培养,再将复性后的菌种接种到脱脂奶蔗糖胰蛋白胨琼脂平板(用于致病性嗜水气单胞菌的鉴别培养),长出单菌落后,挑单一菌落到液体LB培养基培养12 h以上,放入离心机4 000 r/min离心5 min,弃上清,用灭菌生理盐水稀释成菌悬液。制备好的菌液用一次性注射器通过腹腔注射进鱼体,从刚死的鲈鱼肝脏取新菌,加至液体LB培养基,重复活化步骤,得到菌悬液。再通过7 d的预试验,确定半致死浓度为1.6×108CFU/mL。养殖试验结束后,每个桶随机选10尾大小均匀的鱼进行正式攻毒试验,按照半致死浓度通过腹腔注射菌液0.2 mL/尾。试验期间,每隔一段时间(攻毒后1、24、48、72、96 h)观察鱼的死亡情况并记录累计死亡率(CM)。
CM(%)=100×累计死亡尾数/初始总尾数。
1.7 数据处理
数据以平均值±标准差(SD)表示,采用SPSS 24.0分析软件进行ANOVA单因子方差分析和Duncan氏多重检验,以P<0.05作为差异显著性判断标准。
2 结 果
2.1 生长性能和形体指标
由表3可知,经56 d养殖后,各试验组鲈鱼生长良好,SR均为100%。FM-30和FM-25组的FBW、WGR、FCR、ADFI与对照组相比无显著差异(P>0.05),但FM-20组的FBW和WGR较其他3组显著降低(P<0.05),FCR显著提高(P<0.05)。各组之间CF没有显著差异(P>0.05)。随着鱼粉替代水平的提高,HSI和VSI呈现下降趋势,其中FM-25、FM-20组的HSI和FM-20组的VSI显著低于对照组(P<0.05)。
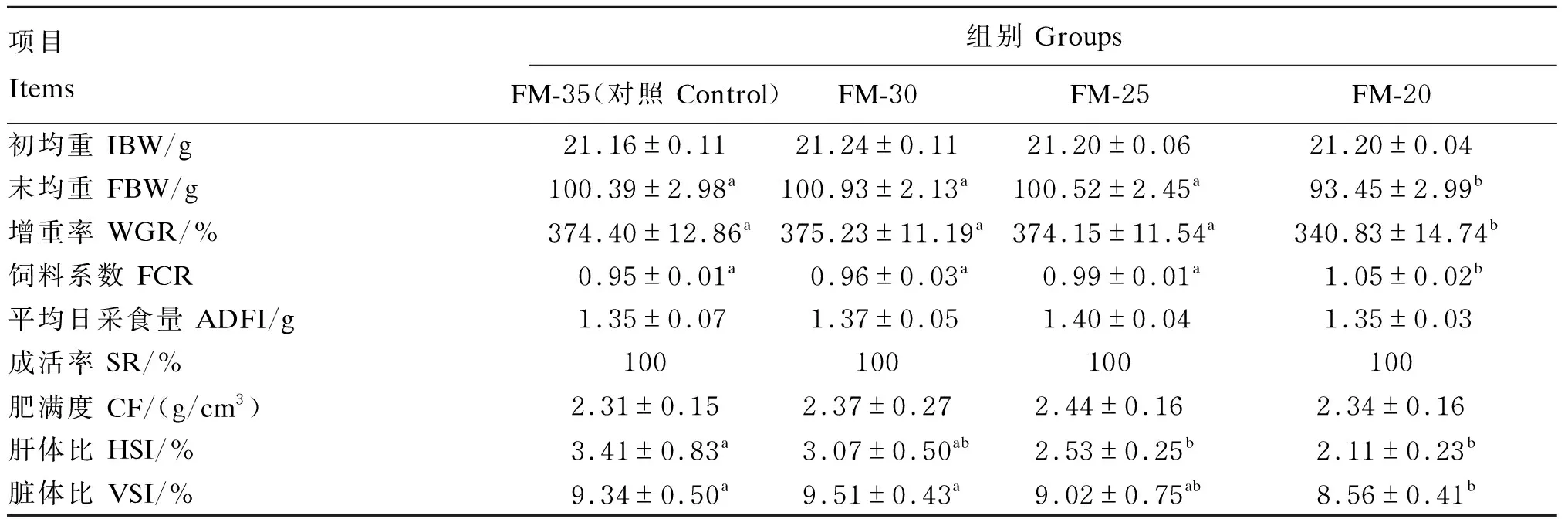
表3 酵母培养物对大口黑鲈生长性能和形体指标的影响Table 3 Effects of yeast culture on growth performance and physical indexes of largemouth bass
2.2 全鱼成分
由表4可知,各组间全鱼水分、粗蛋白质、粗脂肪、粗灰分含量均无显著差异(P>0.05)。
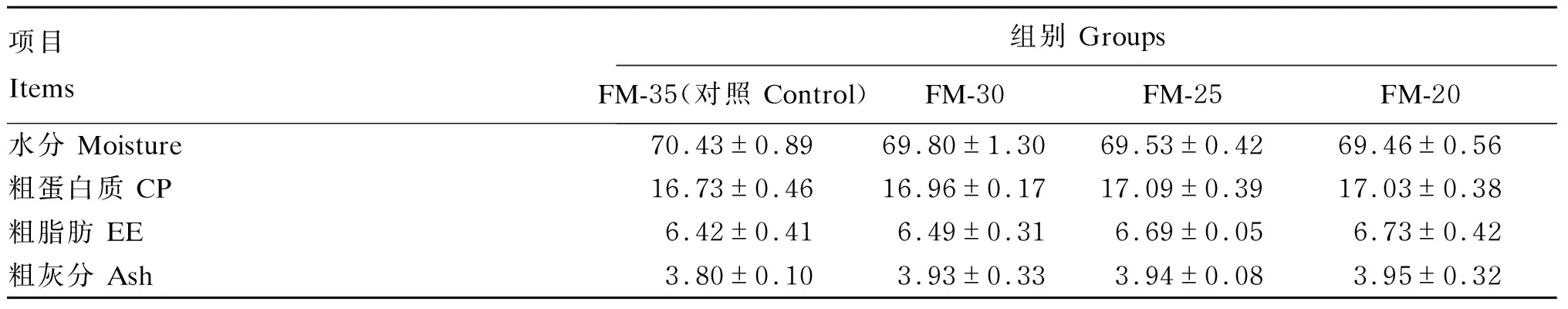
表4 酵母培养物对大口黑鲈全鱼成分的影响Table 4 Effects of yeast culture on whole-body composition of largemouth bass %
2.3 营养物质利用率
由表5可知,FM-30组的PER、PRR、LRR、ADDM和ADCP与对照组相比无显著差异(P>0.05);FM-25组的PER、ADDM和ADCP较对照组显著降低(P<0.05),FM-20组的PER、PRR、LRR、ADDM和ADCP显著低于对照组(P<0.05)。
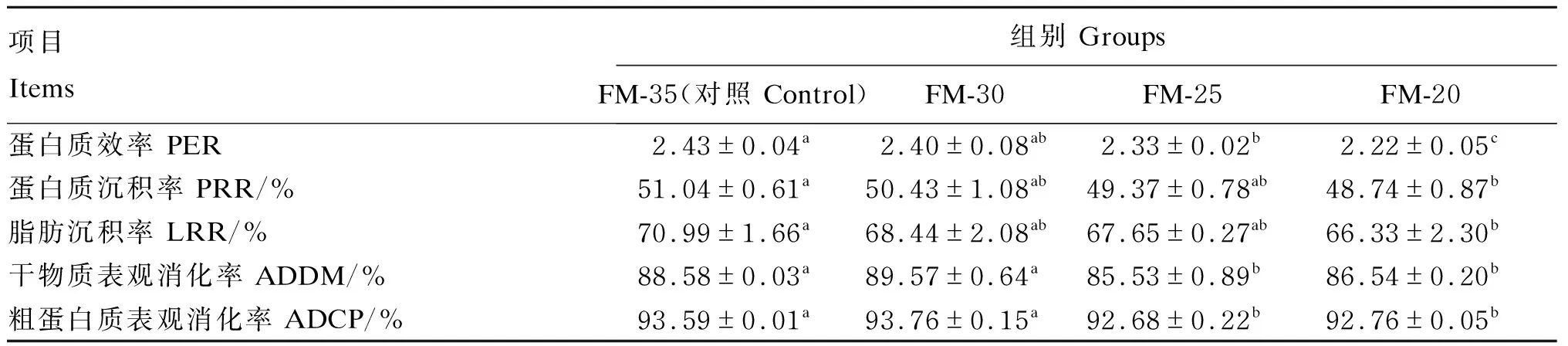
表5 酵母培养物对大口黑鲈营养物质沉积率和表观消化率的影响Table 5 Effects of yeast culture on retention and apparent digestibility ratios of nutrients of largemouth bass
2.4 血清生化指标
由表6可知,酵母培养物替代不同比例鱼粉对鲈鱼血清TP、ALB、GLO含量的影响不显著(P>0.05)。血清ALT和AST活性出现先升高后降低的趋势,ALT活性在FM-25组达到最大,显著高于对照组(P<0.05)。各替代组血清中T-AOC、SOD及CAT活性与对照组相比差异不显著(P>0.05)。血清LZM活性随着鱼粉替代水平的提高总体呈现上升趋势,FM-20组的血清LZM活性较对照组显著提高(P<0.05)。
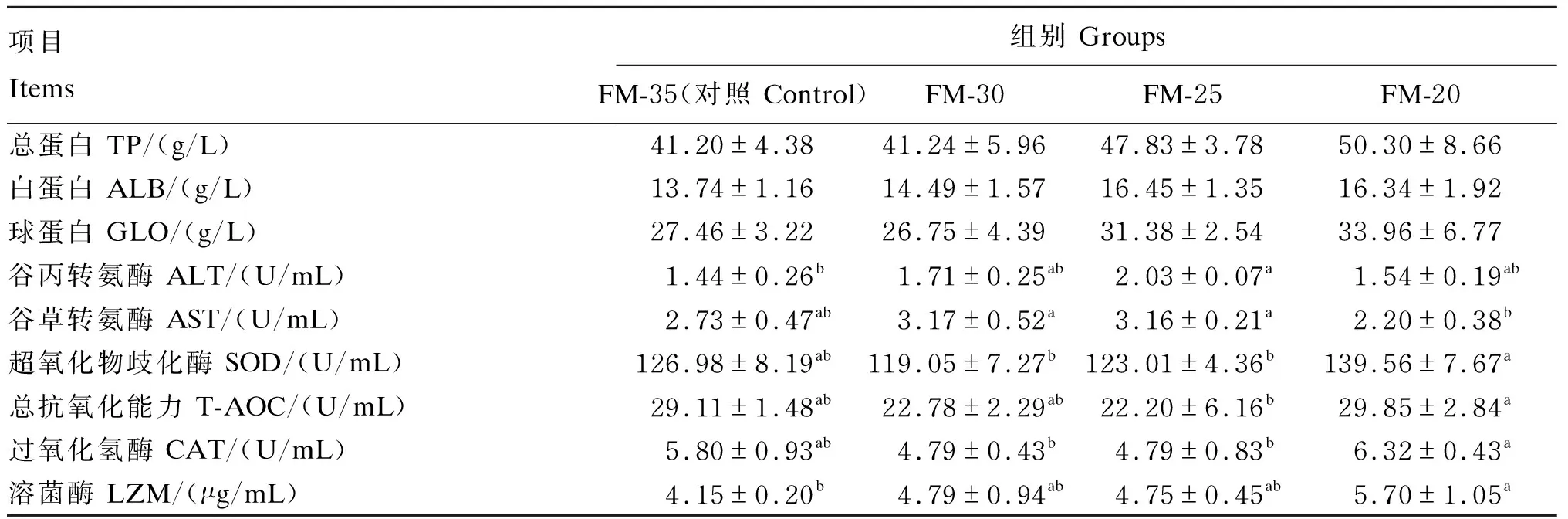
表6 酵母培养物对大口黑鲈血清生化指标的影响Table 6 Effects of yeast culture on biochemical indices in serum of largemouth bass
2.5 肠道形态结构
由表7可知,各酵母培养物组的绒毛宽度显著低于对照组(P<0.05),FM-25组与FM-30组的绒毛高度显著高于对照组(P<0.05)。随着鱼粉替代水平的提高,肌层厚度呈现先上升后降低的趋势,其中FM-25组的肌层厚度最大,且显著高于对照组(P<0.05)。各组的前肠组织切片见图1。
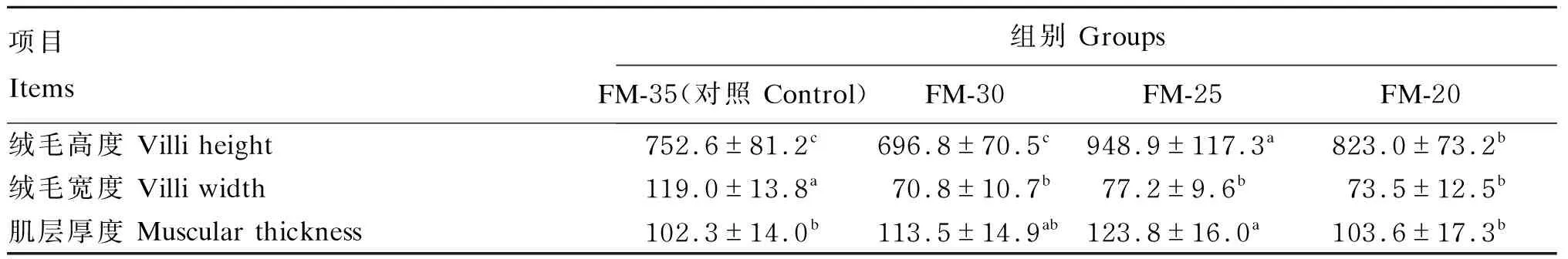
表7 酵母培养物对大口黑鲈肠道形态结构的影响Table 7 Effects of yeast culture on intestinal morphology of largemouth bass μm
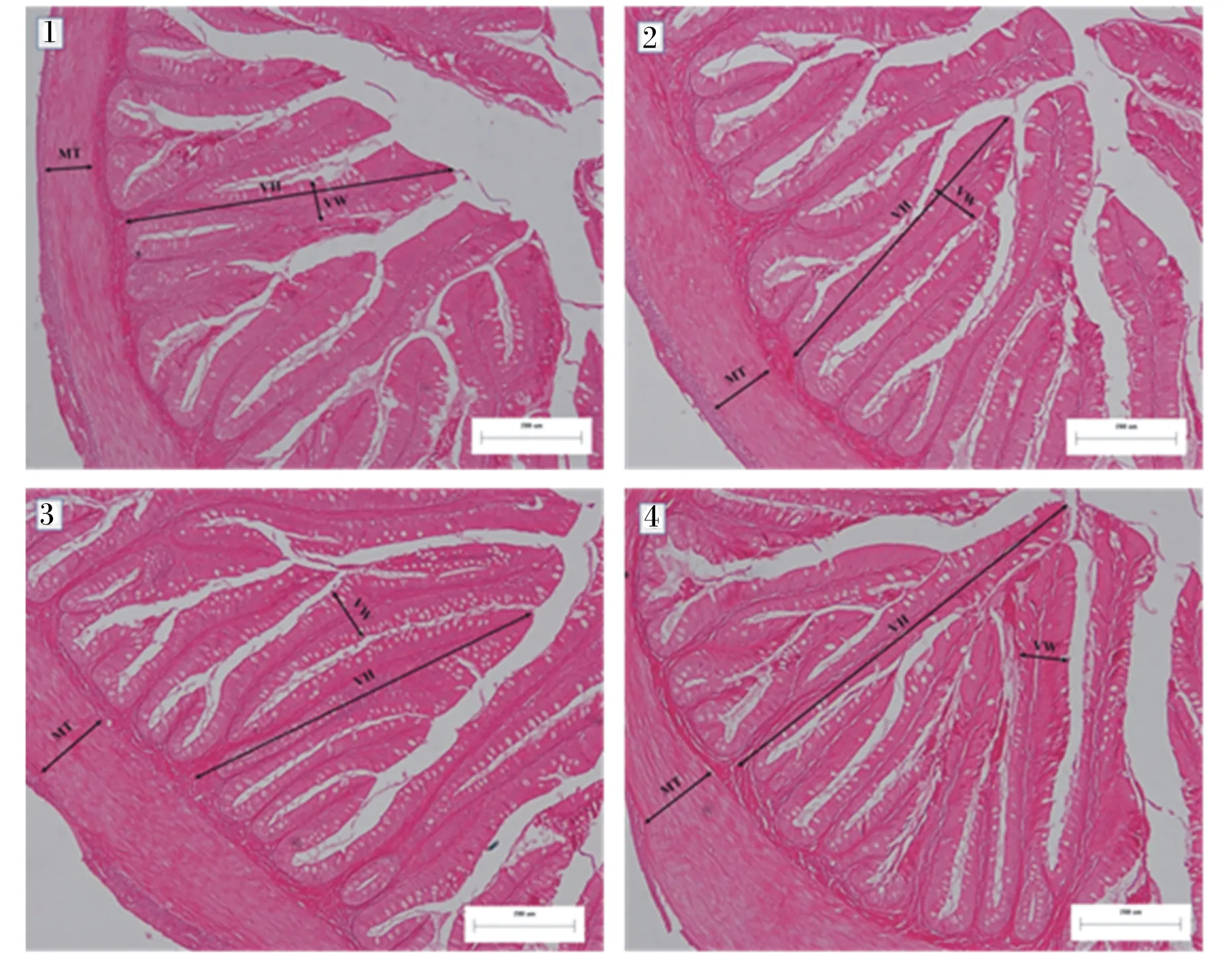
1~4:对照(FM-35)、FM-30、FM-25和FM-20组的前肠组织;MT:肌层厚度;VH:绒毛高度;VW:绒毛宽度。
3 讨 论
3.1 酵母培养物对大口黑鲈生长性能和营养物质利用的影响
酵母培养物是在豆粕等培养基中,加入酵母菌等微生物,在特定工艺条件下发酵后干燥而得的混合物,富含蛋白质、小肽、氨基酸、维生素、寡糖、消化酶和芳香类物质,具有良好的适口性和促生长作用,可提高养殖动物的采食量和改善生产性能。酵母培养物还含有许多未知生长因子,可提高动物生产性能[15]。
李军涛等[3]将酒糟酵母培养物按8%~16%的比例加入基础饲料(占混合物的比例为8%~16%),显著提升了草鱼的生长速度。在桂良超等[17]的研究中,用酵母培养物替代基础饲料中的鱼粉(含量25%),当替代比例小于20%时,不会影响凡纳滨对虾的生长性能。在本试验中,基础饲料含鱼粉35%,用酵母培养物替代10%的鱼粉(鱼粉降为25%),对体增重和饲料系数没有产生显著影响,但当酵母培养物替代15%的鱼粉时,大口黑鲈的增重率显著降低,饲料系数显著增加。从氨基酸的组成来看,酵母培养物中的赖氨酸等必需氨基酸的含量较低,随着鱼粉替代比例的增加,必需氨基酸的缺乏则表现得较为明显;但在替代鱼粉比例较低的时候,其中有机酸、核苷酸等活性成分的诱食、促消化及促生长作用弥补了必需氨基酸的不足,故对生长没有产生显著影响。
在本试验中,酵母培养物替代5%的鱼粉时,对干物质和粗蛋白质表观消化率没有产生显著影响,但当酵母培养物替代更高比例的鱼粉时,干物质和粗蛋白质表观消化率显著降低。这可能与酵母培养物中的主要原料是豆粕等植物性原料有关。尽管经过了高度发酵,与鱼粉相比,其消化率仍较低。今后,需要进一步解决植物性蛋白质原料营养物质利用率低的问题。
3.2 酵母培养物对大口黑鲈血清生化指标的影响
血液生化指标能反映鱼类的生理和健康状况[18]。血清TP是反映机体蛋白质代谢状况的重要指标,血清TP含量的增加可以促进机体蛋白质沉积,促进生长。血清ALB主要反映机体营养能力,血清GLO主要与机体免疫能力有关。血清ALT和AST是动物机体分布最广泛,也是最重要的转氨酶,主要反映肝脏的健康状况。当血清中ALT和AST活性大幅升高时,反映出肝脏受到损伤[18]。在本试验中,各替代组鲈鱼血清中TP、ALB及 GLO含量均呈现升高趋势,FM-25组血清ALT活性显著高于对照组。由于本试验中没有发现明显的绿肝、花肝等现象,FM-25组的生长性能良好,其血清ALT活性的升高是否意味着肝脏的损伤,或者意味着代谢的增加,需要进一步的研究。 LZM具有溶菌活性,作为非特异性生物防御因子能对某些细菌发挥抵抗作用,可诱导其他免疫因子的合成和分泌[19]。在本试验中,随着酵母培养物替代鱼粉比例的上升,血清中 LZM活性呈现升高趋势,其中FM-20组显著高于对照组。这说明在饲料中适量添加酵母培养物可以提高水产动物的机体免疫力,类似结果在桂良超等[17]对凡纳滨对虾的研究和程鑫等[20]对黄颡鱼(Pelteobagrusfulvidraco)的研究中也有报道。
鱼类机体新陈代谢产生的过量氧自由基,能通过其体内的酶系和非酶系抗氧化系统进行清除,维持机体内稳态[21]。SOD是生物体内清除氧自由基的首要物质;CAT清除过氧化氢,使细胞免于遭受过氧化氢的毒害;血清T-AOC则与机体的健康状况密切相关。在本试验中,各替代组血清中SOD活性、T-AOC、CAT活性与对照组相比,均差异不显著。这说明饲料蛋白质源的变化并未造成大口黑鲈机体的氧化损伤。
酵母培养物中富含β-葡聚糖、甘露聚糖、功能性多肽、核苷酸等,均有提高动物免疫水平的作用。β-葡聚糖能刺激动物体产生对机体免疫功能起关键作用的巨嗜细胞,可清除体内损伤、衰亡的细胞和侵入体内的病原微生物。甘露聚糖通过提高免疫球蛋白含量,改善巨噬细胞活性等提高机体免疫力[22]。在不同的酵母培养物中,上述活性成分的种类和含量存在较大差异。酵母培养物对机体抗氧化能力和非特异性免疫的影响,在很大程度上取决于酵母培养物的用量和种类。
3.3 酵母培养物对大口黑鲈肠道形态结构的影响
肠道是鱼类机体消化和吸收营养物质的主要器官,其健康状况影响着鱼类的正常生长发育。在草鱼饲料中添加50 mg/kg的酵母培养物(水解物)能够显著促进草鱼肠道的发育,增加其绒毛高度[23]。邱燕等[24]发现,在饲料中添加1 000 mg/kg酵母培养物能够通过改善草鱼肠道黏膜形态,促进草鱼对饲料的吸收利用,从而促进草鱼生长。这2种酵母培养物实际上是酵母水解物及其代谢物,而本试验所用的酵母培养物是在豆粕等培养基中加入酵母菌发酵而成,在功能性成分方面,可能具有类似的组成。本试验结果表明,各替代组鲈鱼的绒毛宽度均显著低于对照组,随着酵母培养物替代鱼粉比例的上升,肠道绒毛高度及肌层厚度呈现先上升后下降的趋势,且均在FM-25组达到最高,这表明酵母培养物可以在一定程度上改善鲈鱼肠道形态结构,这可能与酵母培养物中含有甘露寡糖和核苷酸有关。甘露寡糖能通过促进黏液的分泌,保护肠道绒毛免受破坏,从而提高肠道绒毛的整齐度、完整性及高度。甘露寡糖还能够促进极性脂质的再酰化和合成,脂质的利用率提高后,用于生长和细胞膜合成的能量增多,这也是甘露寡糖提高肠道绒毛完整性的原因之一[25]。这在金头鳟(Sparusaurata)[26]、欧洲鲈鱼(Dicentrarchuslabrax)[27]和异育银鲫[28]的研究中得以证明。另外,在团头鲂[29]和大西洋鲑(Salmosalar)[30]的研究中,核苷酸可以改善肠道绒毛结构,从而促进肠道健康。这可能源于核酸经消化酶的作用后,逐步分解成小分子核苷、碱基等,使肠道黏膜核酸和蛋白质含量增加,从而促进肠绒毛的生长和肠壁厚度的增加,并有利于肠道微生物菌群的快速繁殖[31]。
4 结 论
本试验研究结果表明,在鱼粉含量为350 g/kg的大口黑鲈饲料中,可用酵母培养物替代100 g/kg的鱼粉用量,不会对大口黑鲈的生长性能、饲料利用、肠道健康、抗氧化能力和非特异性免疫产生不利影响。

