基于网络药理学和分子对接分析三七-红花药对抗心肌缺血再灌注损伤的作用机制
王路瑶,杜廷海,靳新悦,李俊楠,张露苗
急性心肌梗死是一种严重的心血管疾病,最终会导致心肌的缺血性坏死,目前最有效的治疗措施是及时进行心肌血流灌注,以显著减少心肌梗死面积,改善临床预后。但有时缺血后再灌注不仅不能使组织器官功能恢复,反而会出现心肌能量代谢障碍、超微结构的变化和血管无复流等现象,加重功能障碍和结构损伤,这种现象称为心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)[1]。迄今为止,MIRI仍是临床上难以解决的问题。中医学中活血化瘀类中药对心血管疾病疗效显著,研究活血化瘀类中药对MIRI的相关机制及作用靶点为治疗此类疾病开辟了新的思路。三七为五加科植物三七 Panax notoginseng(Burk.)F.H.Chen的干燥根,味甘、微苦,性温,归肝、胃经,具有化瘀止血、活血定痛之效,可用于人体内各种出血,尤以有瘀滞者为宜;现代研究发现三七具有抗血小板聚集、溶栓、抗心律失常等作用[2]。红花为菊科植物红花 Carthamus tinctorius L.的篱状花冠,味辛,性温,归心、肝经,具有活血通经、祛瘀止痛之效,可用于胸痹心痛、血瘀腹痛、症瘕积聚等证;现代研究发现红花具有增加冠状动脉流量、改善心肌缺血、缩小心肌梗死范围、抗心律失常等作用[2]。网络药理学是以系统生物学为基础,在疾病-基因-靶点-药物相互作用网络的基础上通过网络分析,系统综合地揭示多分子药物协同作用于人体的机制,进而指导药物研发及药理作用研究。分子对接技术是通过化学计量学方法模拟分子的几何匹配和能量匹配,来寻找小分子(配体)与生物大分子(受体)之间最佳结合模式的过程,分子对接在中药活性成分的虚拟筛选和确定作用靶标等方面已展现出独特的优势[3]。本研究采用网络药理学方法从系统、整体水平探究三七-红花药对抗MIRI“多因、多效、多靶点”的作用机制,并通过分子对接技术对药物活性成分和疾病核心靶点进行分子对接,以期为深入开展三七-红花药对抗MIRI的基础实验研究及临床合理应用提供研究思路。
1 资料与方法
1.1 药物活性成分及作用靶点的筛选 中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php)是一个融合了药物化学、药代动力学、药物-靶标-疾病网络的药理学平台,包含了499味草药以及29 384种化合物成分、3 311种作用靶点和837种相关疾病[4]。Uniprot数据库是国际上序列数据最完整、注释信息最丰富的非冗余蛋白质序列数据库。通过检索TCMSP数据库得到三七和红花的所有化合物成分,通过页面的过滤器图标自定义筛选结果,选择化合物分子的筛选条件为口服生物利用度(OB)≥30%、类药性(DL)≥0.18,筛选出活性成分较高的化合物,利用TCMSP平台得到有效成分的靶点蛋白,并在Uniprot数据库(https://www.uniprot.org/)将预测出的靶点蛋白名转换为基因名。
1.2 MIRI相关靶点获取 人类基因数据库(GeneCards,https://www.Genecards.org/)是一个全面提供所有有关人类基因注释和预测信息的基因数据库,在线人类孟德尔遗传(Online Mendelian Inheritance in Man,OMIM,https://www.omim.org/)是涵盖关于人类遗传病和基因等信息的数据库。通过检索GeneCard数据库、OMIM 数据库收集与MIRI相关的所有靶点,数据库以关键词“myocardial ischemia reperfusion injury”进行搜索,收集整合与MIRI相关的靶点基因。
1.3 药物-疾病靶点网络构建及可视化分析 为明确“三七-红花”与MIRI潜在靶点间的相互作用,利用Venn在线软件将药物与疾病靶点取交集,通过Venn图的形式展现药物靶点与疾病靶点间的潜在靶点基因,运用Cytoscape 3.7.2软件进行可视化分析并绘制网络图。
1.4 靶点蛋白交互作用(protein protein interaction,PPI)网络的构建 基于String数据库获取高置信度的交集PPI信息,运用Cytoscape 3.7.2软件构建PPI网络,利用Network Analyzer工具进行拓扑学分析。根据介度(betweenness centrality,BC)、紧密度(closeness centrality,CC)及连接度(Degree)的中位数来筛选化合物-靶点网络核心节点。
1.5 成分-靶点分子对接验证 分别从三七和红花的有效成分中选取度值排名前5位成分(1个成分重复)与度值排名前10位的核心靶点进行分子对接,从RCSB数据库(https://www.rcsb.org/)下载相关蛋白的结构,使用Pymol软件去除溶剂分子与配体,使用AutoDock软件进行加氢、加电子等操作。从ChemicalBook数据库(https://www.chemicalbook.com/)中下载化合物结构,并使用AutoDock软件进行加氢、加电子、加ROOT等操作,得到结果中每个蛋白结合能最低的两组,使用Pymol软件对得到的最佳结果进行绘图。
1.6 基因本体(GO)富集分析和京都基因与基因组百科全书(KEGG)通路分析 以人类为研究对象,利用Bioconductor R软件包对不同模块的靶点进行GO富集分析和KEGG通路分析,分析不同模块靶点基因的生物学意义,从而分析药物治疗疾病的可能机制。
2 结 果
2.1 “三七-红花”的有效成分及作用靶点 TCMSP数据库中共筛选出30个候选化合物,其中三七8个、红花22个,去除重复项,共得到27个候选化合物,详见表1。利用TCMSP数据库获得有效成分的相应靶点蛋白,并在Uniprot数据库将预测出的靶点蛋白名转换为基因名,去除重复项并删除非人源靶点后,最终得到三七-红花药对有效成分相应靶点基因203个。

表1 三七-红花的有效活性成分
2.2 MIRI靶点的筛选 通过GeneCards数据库得到MIRI相关靶点1 223个,通过筛选设置relevance score≥6,最终获得472个相关靶点。从OMIM数据库得到与MIRI相关靶点52个,筛重后共获得疾病相关靶点511个。
2.3 化合物-靶点的网络构建及可视化分析 利用Venny在线分析软件将“三七-红花”的活性化合物对应的203个药物靶点与MIRI的511个疾病靶点取交集,通过Venn图(见图1)的形式得到81个共同靶点。将81个共同靶点通过Cytoscape 3.7.2软件构建三七和红花“化合物-靶点”的可视化网络图(见图2)。由图2可见,节点分别表示三七-红花的活性成分与疾病作用靶标,而图中多个靶标可对应相同的活性成分,一个靶标也可与不同的活性成分相对应,说明三七-红花药对抗MIRI具有多成分、多靶标的特点。
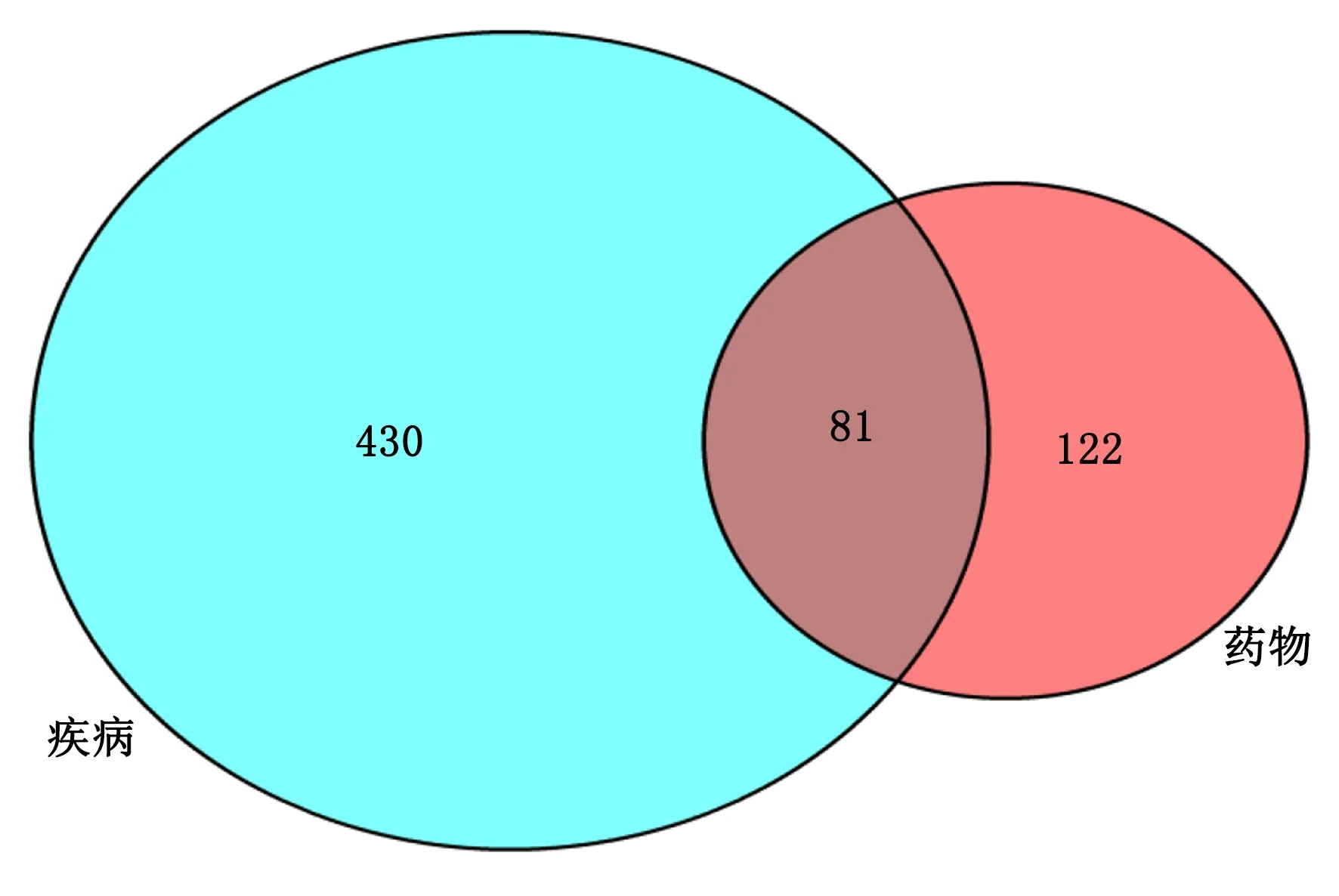
图1 三七-红花有效成分靶点和MIRI相关靶点关系的Venn图

图2 化合物-靶点可视化网络图
2.4 靶点蛋白PPI网络的构建及核心靶点的筛选 利用String数据库和Cytoscape 3.7.2软件构建的高置信度交集靶点蛋白PPI网络见图3,网络共有81个节点和1 425条边。拓扑学分析结果显示,网络Degree中位数为35,BC中位数为0.002 888 82,CC中位数为0.640 000 00,满足上述参数卡值的靶点分别为趋化因子CC基元配体(CCL2)、白细胞介素6(IL-6)、丝氨酸/苏氨酸激酶1(AKT1)、基质金属肽酶9(MMP9)等39个靶点可作为治疗作用的核心靶点,在治疗作用中可能发挥了重要作用。详见表2。

图3 三七-红花药对抗MIRI相关靶点的PPI网络
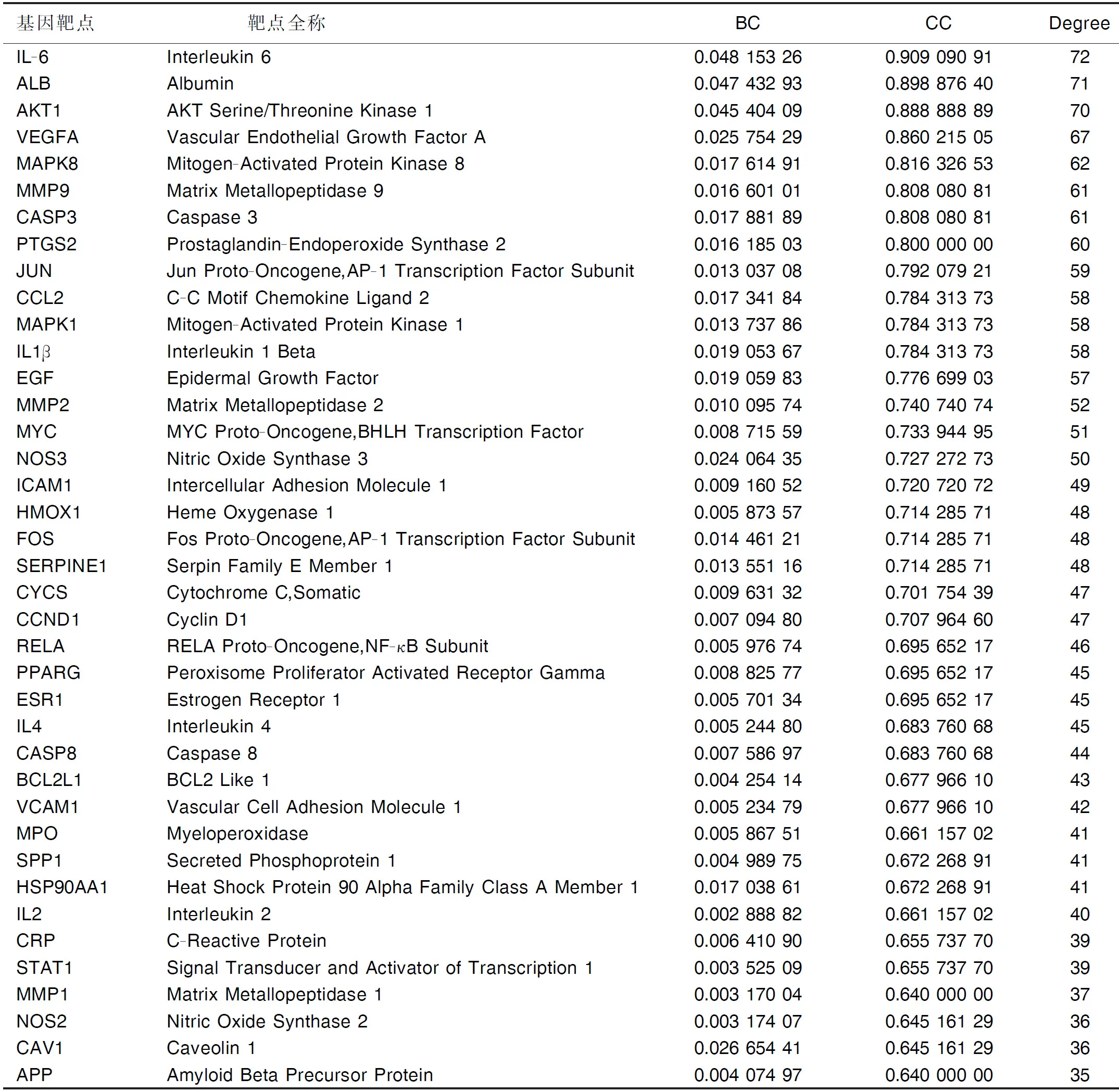
表2 三七-红花药对抗MIRI相关靶点蛋白PPI网络中核心靶点拓扑学分析结果
2.5 分子对接结果 筛选的度值排名前10位的核心靶点与9个关键药效成分对接结果见图4,表3中详细列出9个关键药效成分的基本信息。其中,胡萝卜素(beta-carotene)因分子量太大,无法与大分子蛋白对接。其中横坐标为靶蛋白,纵坐标为化合物,颜色的深浅代表最低结合能的大小。所有分子与标靶蛋白的最低结合能都小于0,说明配体与受体可以自发结合,最低结合能越小说明分子与靶点蛋白结合越好。对接结果显示,IL-6、AKT1、MMP9、CCL2最低结合能小于-5.0 kJ/mol,说明以上9个核心活性成分与以上靶点蛋白结合较好。对三七-红花与上述核心靶点蛋白对接结果进行可视化,三七-红花9个关键药效成分中baicalein和靶点IL-6、木犀草素(luteolin)和靶点MMP9、甘草素(Liquiritigenin)与靶点CCL2分别形成氢键的数目为3个、5个、2个,而豆甾醇(Stigmasterol)和靶点AKT1之间没有氢键相互作用。详见图5。
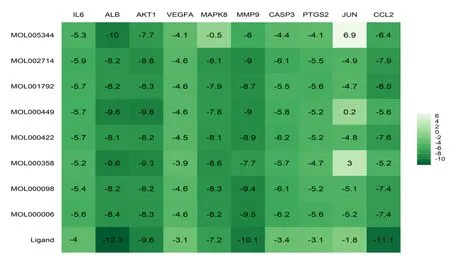
图4 靶点-活性成分最低结合热图
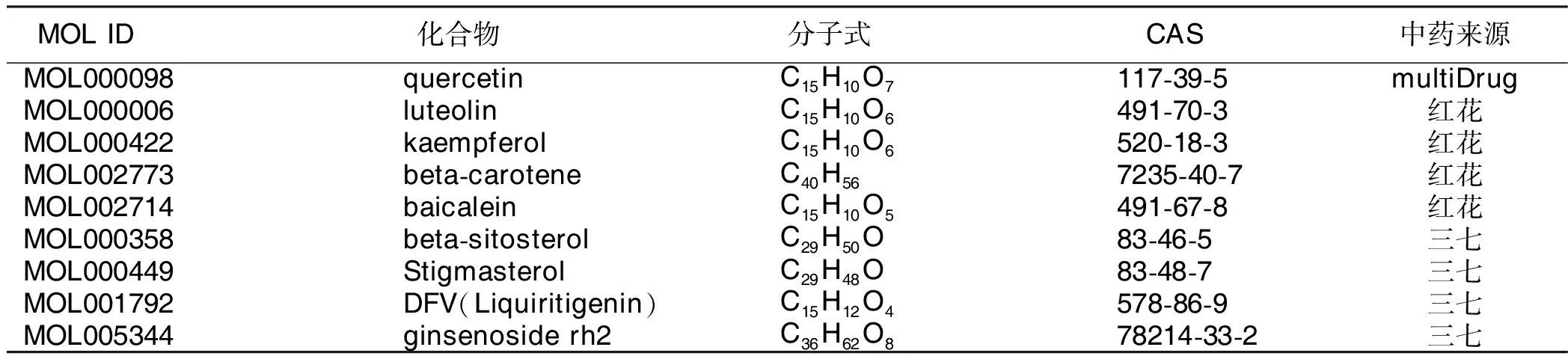
表3 三七-红花9个核心成分基本信息

图5 4个核心蛋白分子与9个核心成分对接结果可视化
2.6 三七-红花药对抗MIRI的GO功能和KEGG通路富集分析
2.6.1 GO功能富集分析 利用Bioconductor R软件包对81个靶点进行GO富集分析,以P<0.01为筛选标准,得出1 284个生物学过程(biological process,BP),主要包括对氧含量的反应、对脂多糖的反应、氧化应激反应、凋亡信号通路的调控、循环系统中的血管过程、凝血、止血等;32个细胞组成(cellular component,CC),包括局灶性粘连、细胞-基质黏附连接、RNA聚合酶Ⅱ转录因子复合物、转录因子复合物、线粒体外膜等;67个分子功能(molecular function,MF),包括细胞因子受体结合、泛素样蛋白连接酶结合、支架蛋白结合、半胱氨酸型内肽酶活性与细胞凋亡的关系、受体配体活性、DNA结合转录激活活性、RNA聚合酶Ⅱ特异性、内肽酶活性等,各类别前20位的通路见图6,表明三七-红花药对可以通过参与调控多种生物学过程而发挥抗MIRI作用。


2.6.2 KEGG通路富集分析 利用Bioconductor R软件包对81个靶点进行KEGG通路富集分析,以P<0.01为筛选标准,共富集125条通路,排名前20位的通路见图7。主要富集的通路为流体剪切应力与动脉粥样硬化、白细胞介素-17(IL-17)信号通路、磷脂酰肌醇3激酶(PI3K)-蛋白激酶B(Akt)信号通路、有丝分裂原激活的蛋白激酶(MAPK)信号通路、核苷酸结合寡聚化结构域(NOD)样受体信号通路、肿瘤坏死因子信号途径、细胞凋亡、C型凝集素受体信号通路、Toll样受体信号通路、Janus激酶2/信号转导及转录激活因子3(JAK2/STAT3)信号通路,并与胰腺癌、膀胱癌、前列腺癌、小细胞肺癌等癌症通路有相关性。将筛选出来的前20个KEGG信号通路和靶点基因导入Cytoscape 3.7.2软件构建“靶点-通路”的可视化网络图,详见图8。以上研究结果表明,三七-红花药对的活性成分靶点分布于不同的路径,可通过各通路协调发挥抗MIRI作用。
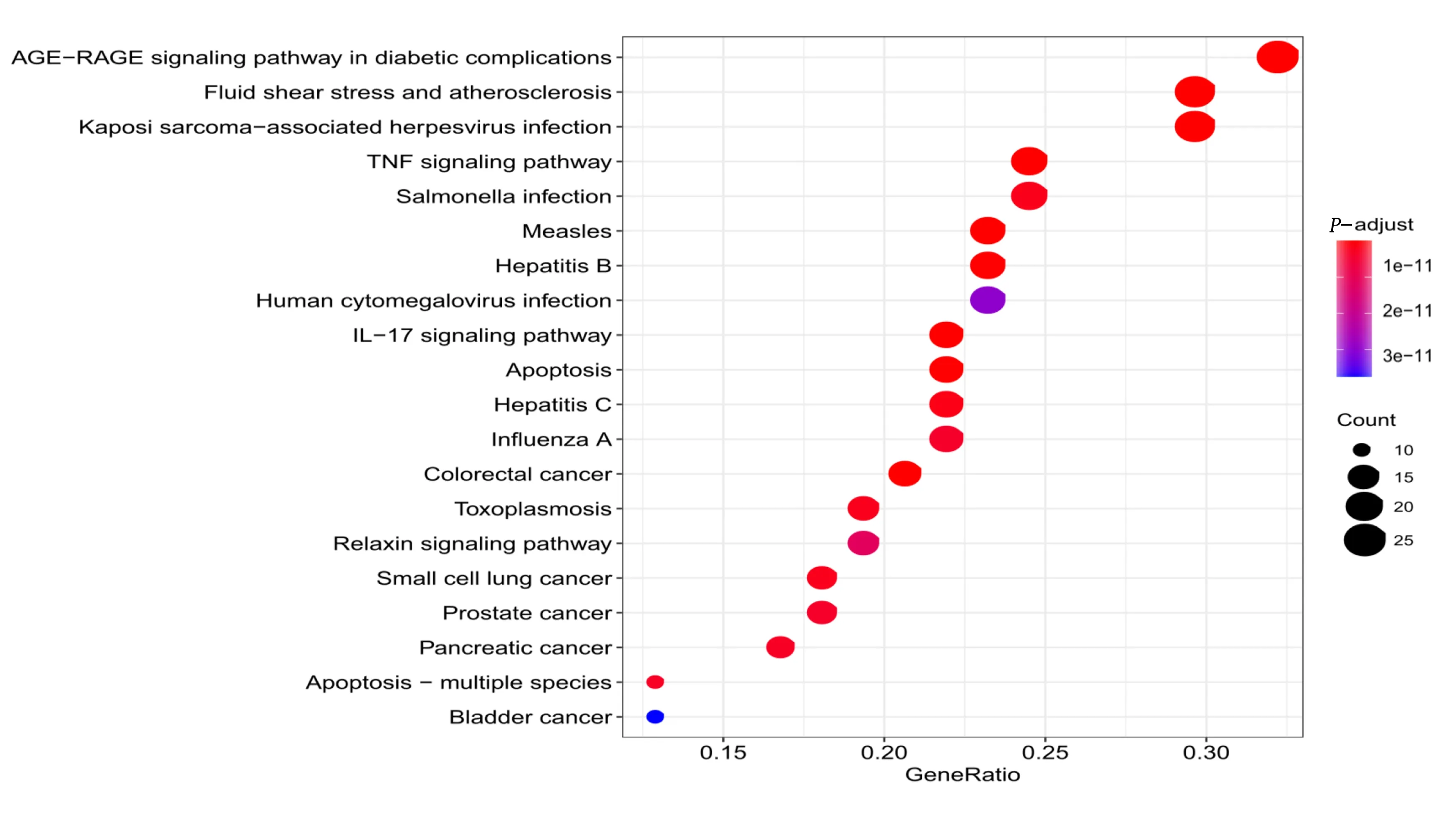
图7 三七-红花作用靶点KEGG富集分析的前20条通路
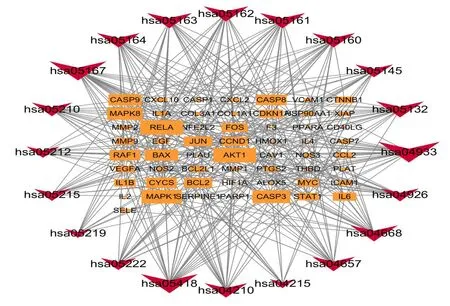
图8 关键靶基因KEGG通路富集分析
3 讨 论
中医学没有MIRI的相关描述,根据其病位和临床表现可以归属于“胸痹”“心悸”“真心痛”等范畴。MIRI的中医病机属于各种病因所致的心脉痹阻,常虚实夹杂[5],但以气虚为本,贯穿整个MIRI的病理过程,血瘀、痰饮为标,其中血瘀为重,痰饮为轻[6],故治疗上应以补虚为主,兼以活血化瘀、豁痰宣痹,其中活血化瘀治法有重要作用,三七-红花为此治法的有效药对之一。三七功善化瘀止血、活血定痛之效;红花功善活血通经、祛瘀止痛;二药相合,共增活血化瘀之功效。现代临床研究发现三七-红花有效组分复方通过抗炎和抗凋亡发挥对心肌梗死大鼠的保护作用[7],可提高对人肝微粒体中UDP-葡萄糖醛酸转移酶的3种主要同工型的抑制能力[8]。但是对于三七-红花药对抗MIRI的所有潜在靶标、相关机制及分子层面的研究仍有欠缺。本研究基于多成分、多靶点作用的研究思路,应用网络药理学技术和分子对接技术,分析和验证三七-红花药对抗MIRI的作用机制。
本研究共收集“三七-红花”主要活性成分27个,包括皂苷类、木脂素、黄芩素、黄芩苷、槲皮素、山奈酚、木犀草素等。相关研究表明人参皂苷Rh2可改善高脂大鼠氧化应激与炎症水平,增加大鼠心肌缺血再灌注后外周血内皮祖细胞数量,从而保护受损心肌[9];槲皮素可降低MIRI大鼠的乳酸脱氢酶水平、心室期前收缩、心动过速、心室颤动的数量和持续时间以及心律不齐的严重程度,说明槲皮素在MIRI过程中具有抗心律失常作用[10]。实验研究发现木脂素可能通过抑制中性粒细胞浸润或影响血脂代谢而对高脂血症大鼠MIRI有一定的保护作用[11]。黄芩素具有很强的抗氧化作用,黄芩素联合棕榈酰乙醇酰胺治疗可减少心肌组织损伤、中性粒细胞浸润、肥大细胞活化表达的标志物(糜酶和类胰蛋白酶)和促炎性细胞因子的产生[肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)],降低应激氧化并调节核因子-κB(NF-κB)和细胞凋亡途径[12]。黄芩苷通过促进PI3K释放一氧化氮来保护MIRI大鼠的心肌微血管内皮细胞[13]。山奈酚通过降低晚期糖基化产物(AGE)-晚期糖基化终末产物受体(RAGE)/MAPK诱导的氧化应激和炎症反应减轻糖尿病大鼠的MIRI[14]。木犀草素可通过内皮一氧化氮合酶相关的抗氧化反应减轻糖尿病心脏的缺血/再灌注损伤[15]。本研究基于String交互作用网络数据库构建三七-红花药对抗MIRI靶点交互作用网络,筛选出39个核心靶点,分析发现IL-6、白蛋白(ALB)、AKT1、血管内皮生长因子A(VEGFA)、MAPK8、MMP9、半胱氨酸蛋白酶3基因(CASP3)等是网络关键核心靶点,可能在三七-红花药对抗MIRI中发挥重要作用。结合分子对接结果,发现9个关键药效成分与IL-6、AKT1、MMP9、CCL2对接结合能都小于-5.0 kJ/mol,说明9个关键药效成分与以上靶点蛋白结合较好,推测三七-红花药对有效成分可能通过这些靶点发挥作用。IL-6是重要的炎性因子,心肌缺血再灌注时IL-6及其受体表达明显增加,并且IL-6具有双重作用,既能诱导中性粒细胞、心肌细胞表达黏附因子CD11b/CD18和细胞间黏附分子1(ICAM-1)而损伤心肌,又能通过Janus激酶激活信号传导转录激活因子STAT1和STAT3,激活细胞信号过程,抑制再灌注心肌细胞凋亡,减少梗死面积[16]。AKT1是在心肌组织中高表达的1个亚型,研究表明AKT1介导的糖原合成酶激酶-3(GSK-3)活性抑制对于MIRI后的心脏保护至关重要[17]。基质金属蛋白酶(matrix metallo proteinases,MMPs)是一组依赖于锌离子且以降解细胞外基质成分作为底物的蛋白水解酶,研究发现MMPs快速参与缺血再灌注损伤等氧化应激反应,同时发现其抑制剂能有效抑制MIRI的发生。MMP9是MMPs家族中的主要成员,研究发现血清中MMP9浓度的增加与冠状动脉事件发生的危险程度呈正相关[18]。CC趋化因子受体2(CCR2)缺乏可减轻小鼠MIRI引起的氧化应激,缩小梗死面积[19]。在三七-红花药对抗MIRI的GO分析中,得出1 284个生物学过程,其中对氧含量的反应、对脂多糖的反应、氧化应激反应、凋亡信号通路的调控、循环系统中的血管过程等生物过程大部分都与MIRI相关。KEGG通路富集分析结果显示,三七-红花药对抗MIRI主要涉及IL-17信号通路、PI3K-Akt信号通路、MAPK信号通路、NOD样受体信号通路、Toll样受体信号通路、JAK2/STAT3信号通路等。在MIRI过程中,白细胞介素-23(IL-23)、IL-17炎性因子表达明显增高,而且阻断IL-23、IL-17都能明显减轻MIRI,说明IL-17信号通路与MIRI的发生及发展密切相关[20]。PI3K/Akt信号通路在细胞内发挥着抑制凋亡、促进增殖的关键作用,近年来,研究发现该信号通路与多种心血管疾病的发生与转归有着密切的关系。多项实验证明中药复方可通过激活PI3K/Akt途径保护心肌细胞免受缺血/再灌注损伤[21-22]。研究表明Toll样受体信号转导通路介导的先天免疫和炎症反应在加重心肌缺血的损伤中起关键作用,其通过激活下游NF-κB、PI3K等信号通路,促进炎性因子释放,从而介导心肌细胞损伤[23]。JAK2/STAT3信号通路是炎症反应中的经典通路,可通过对下游众多靶点发挥调控作用,如GSK-3、NF-κB、雷帕霉素靶蛋白、内皮型一氧化氮合酶(eNOS)及TNF-α等。多项实验证明中药成分及中药复方可通过调控JAK-STAT3信号通路保护MIRI[24-26]。因此,推测三七-红花药对活性成分可能通过作用于这些信号通路中的关键因子达到抗MIRI的目的。
综上所述,本研究应用网络药理学方法研究了三七-红花药对抗MIRI的主要作用靶点,构建了三七-红花药对抗MIRI的靶点交互作用网络,运用分子对接方法对关键靶点进行验证,通过对三七-红花活性成分抗MIRI作用靶点的生物过程及通路富集,阐述了三七-红花药对通过多靶点、多通路作用发挥抗MIRI的作用,为进一步深入探讨其临床作用机制提供了先导信息和基础。

