颅内外血管搭桥术在颅内大型和巨大型血栓性动脉瘤中的应用
韩庆东 黄亚波
随着显微神经外科以动脉瘤夹闭术为主要代表的技术进步以及支架、弹簧圈、血流导向装置等介入材料的发展,颅内动脉瘤的治疗取得显著进步,但颅内大型和巨大型血栓性动脉瘤的治疗仍是神经外科棘手的技术难题[1⁃3]。此种类型动脉瘤瘤体占位效应明显而操作困难、瘤腔内血栓累及重要分支、血栓导致术中和术后缺血性脑损伤、影像学表现不典型而易误诊,甚至永久性病残率和病死率高达7%和6%,给外科手术治疗带来严重挑战[4⁃5]。苏州大学附属第一医院近7年采用以颅内外血管搭桥术为主的外科手术治疗15例颅内大型和巨大型血栓性动脉瘤患者,回顾总结此种类型动脉瘤的临床和影像学特点、手术疗效和安全性,以为这一复杂脑血管病的诊断与治疗提供参考。
资料与方法
一、临床资料
1.纳入标准(1)经DSA证实为颅内动脉瘤。(2)术前横断面CT或MRI显示的动脉瘤直径与DSA所示不一致,提示瘤腔内血栓形成[4]。(3)动脉瘤直径>1.50 cm为大型动脉瘤,直径>2.50 cm为巨大型动脉瘤。(4)均行颅内外血管搭桥术。(5)所有患者及其家属均对手术方案知情并签署知情同意书。
2.排除标准(1)动脉瘤外壁破裂致蛛网膜下腔新发血栓。(2)术前DSA、CT或MRI显示动脉瘤腔完全闭塞的血栓性动脉瘤。(3)感染性动脉瘤、夹层动脉瘤或外伤性假性动脉瘤。
3.一般资料选择2013年3月至2020年7月在苏州大学附属第一医院神经外科住院治疗的颅内大型和巨大型血栓性动脉瘤患者共15例,其中,男性6例,女性9例;年龄27~76岁,平均(52.33±8.61)岁;临床主要表现为头痛占6/15,肢体乏力占4/15,视物模糊占3/15,面部麻木占2/15,上睑下垂占2/15,体检发现占1/15(例7)。15例术前均行头部CT检查,11例可见动脉瘤内含程度不同的钙化,呈典型“靶征”;9例行MRI检查,可见高低信号的动脉瘤及瘤内流空信号影;15例均行DSA检查,14例明确诊断、1例结合CT、MRI或CTA怀疑血栓性动脉瘤或颅内占位性病变,术中证实诊断。术前DSA或CTA测量动脉瘤最大径1.50~2.50 cm(大型)9例,>2.50 cm(巨大型)6例;动脉瘤分别位于颈内动脉(ICA)床突旁段7例和床突上段3例,大脑中动脉(MCA)3例,颈内动脉分叉部2例;均动脉瘤破裂致蛛网膜下腔出血(SAH),Hunt⁃Hess分级Ⅰ级12例、Ⅱ级2例、Ⅲ级1例。
二、研究方法
1.术前评估术前均行经颅多普勒超声(TCD)和球囊闭塞试验(BOT)评估侧支代偿,CT灌注成像(CTP)评估动脉瘤区脑灌注情况,需取桡动脉(RA)行高流量血管搭桥术的患者行Allen试验分析桡动脉管径特点并于体表标记其长度。
2.手术方法15例患者均行开颅手术治疗。(1)颞浅动脉⁃大脑中动脉(STA⁃MCA)低流量搭桥术联合动脉瘤夹闭术:6例颈内动脉床突旁动脉瘤患者采取该术式。术前BOT试验耐受性较好、CTP提示轻度脑低灌注,前交通动脉(ACoA)和后交通动脉(PCoA)开放,且动脉瘤未累及重要分支;TCD定位术侧颞浅动脉的体表投影。术中分离颞浅动脉额支和顶支,常规经翼点入路,将颞浅动脉与大脑中动脉M4段端侧吻合,血管吻合后经吲哚菁绿荧光血管造影术(ICGA)和TCD监测证实桥血管通畅,再同期行动脉瘤夹闭术(图1~3)。(2)STA⁃MCA低流量搭桥术联合动脉瘤切除术:2例大脑中动脉M2段巨大型动脉瘤患者采取该术式,动脉瘤直径分别为2.70和2.90 cm,均为偏心型血栓性动脉瘤。术前BOT试验耐受性较好、CTP提示轻度脑低灌注,且动脉瘤未累及重要分支。术中将颞浅动脉与大脑中动脉M4段端侧吻合后行ICGA和TCD监测证实桥血管通畅,再同期行动脉瘤切除术。(3)STA⁃MCA低流量搭桥术联合颈内动脉结扎术:1例颈内动脉床突上段巨大动脉瘤且夹闭或切除均困难的患者采取该术式。术前BOT试验耐受性较好、CTP提示轻度脑低灌注,且动脉瘤未累及重要分支。术中将颞浅动脉与大脑中动脉M4段端侧吻合后行ICGA和TCD监测证实桥血管通畅,然后同期行颈内动脉颅外段结扎术。(4)颈外动脉⁃桡动脉⁃大脑中动脉(ECA⁃RA⁃MCA)高流量搭桥术联合动脉瘤孤立术:有2例颈内动脉床突上段动脉瘤、1例颈内动脉床突旁动脉瘤和1例颈内动脉分叉部动脉瘤且同侧大脑前动脉(ACA)A1段纤细患者采取该术式。术前BOT试验耐受性较差、CTP提示轻度脑低灌注,同侧后交通动脉未开放;Allen试验阴性后于前臂体表标记桡动脉走行,分离切取桡动脉20 cm备用。切开患侧颈部皮肤,显露颈外动脉,常规经翼点入路,经侧裂显露大脑中动脉M2段,将桡动脉一端与颈外动脉端侧吻合、另一端与大脑中动脉M2段端侧吻合,血管吻合后经ICGA和TCD监测证实桥血管通畅,进一步以动脉瘤夹分别近端和远端夹闭载瘤动脉,孤立动脉瘤。(5)ECA⁃RA⁃MCA高流量搭桥术联合动脉瘤切除术:有1例大脑中动脉巨大型动脉瘤和1例颈内动脉分叉部巨大型动脉瘤患者采取该术式,动脉瘤直径分别为2.70和2.80 cm,压迫同侧视神经导致视力明显下降。术前BOT试验耐受性较差、CTP提示脑低灌注,前交通动脉和后交通动脉均未开放。术中桡动脉一端与颈外动脉端侧吻合、另一端与大脑中动脉M2段端侧吻合后,ICGA和TCD监测证实桥血管通畅,再同期行动脉瘤切除术。所有患者均于术后1周复查DSA或者CTA和CTP。
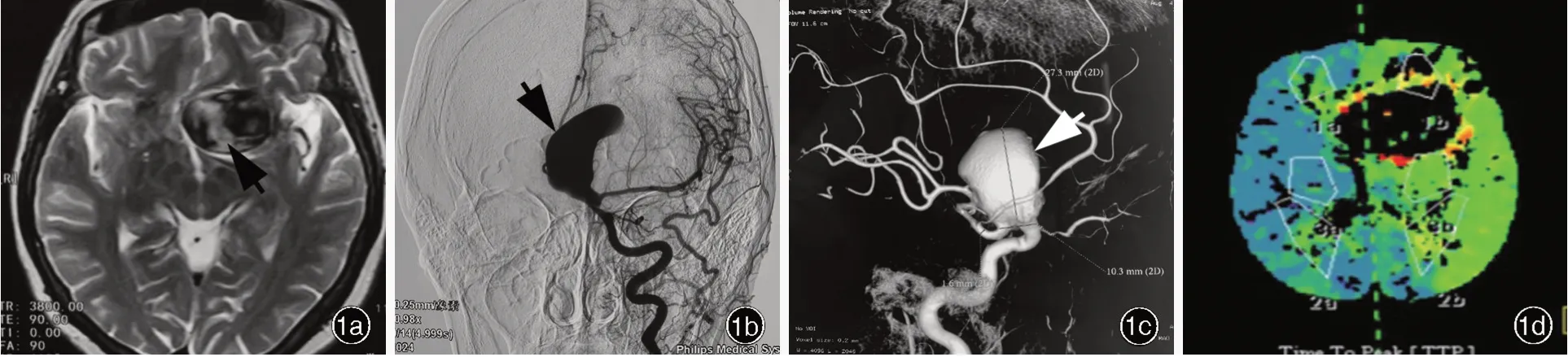
图1 男性患者,54岁,临床诊断为左颈内动脉床突旁段巨大型血栓性动脉瘤,行左STA⁃MCA低流量搭桥术联合动脉瘤夹闭术。术前影像学检查所见1a横断面T2WI显示,左颈内动脉床突旁巨大不规则血管流空影(箭头所示)1b,1c DSA显示左颈内动脉床突旁段巨大动脉瘤(箭头所示)1d CTP之TTP图显示左侧大脑半球灌注时间延迟(绿色区域所示)Figure 1 A 54⁃year⁃old male was diagnosed with giant thrombotic left paraclinoid ICA aneurysm and underwent left STA⁃MCA bypass combined with clipping of aneurysm.Preoperative imaging findings Axial T2WI showed left paraclinoid giant mass with void signal(arrow indicates,Panel 1a).DSA showed giant thrombotic left paraclinoid ICA aneurysm(arrows indicate;Panel 1b,1c).CTP of TTP showed the perfusion of the left cerebral hemisphere under mildly abnormal condition(green areas indicate,Panel 1d).
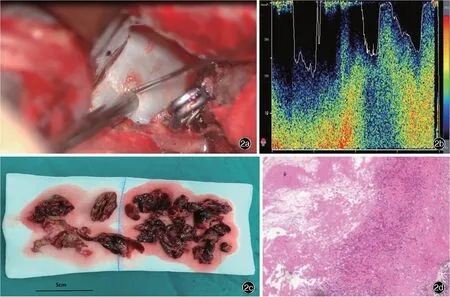
图2 该例患者术中和病理学检查所见2a术中临时阻断动脉瘤,穿刺抽吸动脉瘤2b TCD微型探头血管超声监测左大脑前动脉A1段血流速度正常2c大体标本可见术中切除的动脉瘤壁和血栓2d组织病理学提示血栓性动脉瘤HE染色低倍放大Figure 2 Intraoperative and pathological findings of the patient Puncturing and aspiration of aneurysm following temporary clipping(Panel 2a).TCD microvascular Doppler monitoring the blood flow of left ACA A1 segment(Panel 2b).The pathological aneurysmal sac and thrombus obtained intraoperatively(Panel 2c).Pathological findings showed thrombotic aneurysm(Panel 2d).HE staining low power magnified
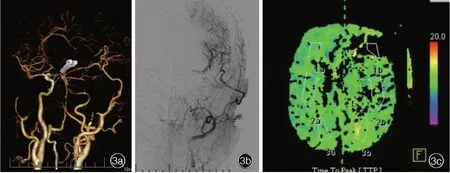
图3 该例患者术后复查影像学所见3a CTA显示左颈内动脉床突旁段动脉瘤消失3b正位DSA显示,左颞浅动脉桥血管供血左大脑中动脉3c CTP之TTP图显示,与术前TTP图比较,左侧脑低灌注明显改善Figure 3 Postoperative imaging findings of the patient CTA showed the disappearance of the left paraclinoid ICA aneurysm(Panel 3a).Anteroposterior DSA showed that the graft patency of the left STA supplied the left MCA(Panel 3b).CTP of TTP showing the perfusion of the left cerebral hemisphere was improved compaired with TTP before operation(Panel 3c).
3.预后评价术后采用再次入院、门诊和电话随访相结合的方式进行随访,影像学随访为门诊复查CTA和再次入院复查DSA,观察夹闭、孤立或切除后动脉瘤是否消失以及桥血管通畅情况。于术后6个月采用Glasgow预后分级(GOS)评价手术预后,GOS评分4~5为预后良好,≤3为预后欠佳。
结 果
本组15例患者术前TCD和BOT试验评估侧支代偿良好9例,较差6例;CTP显示动脉瘤区轻度低脑灌注13例,重度低灌注2例。15例颅内大型和巨大型血栓性动脉瘤患者的临床资料参见表1。
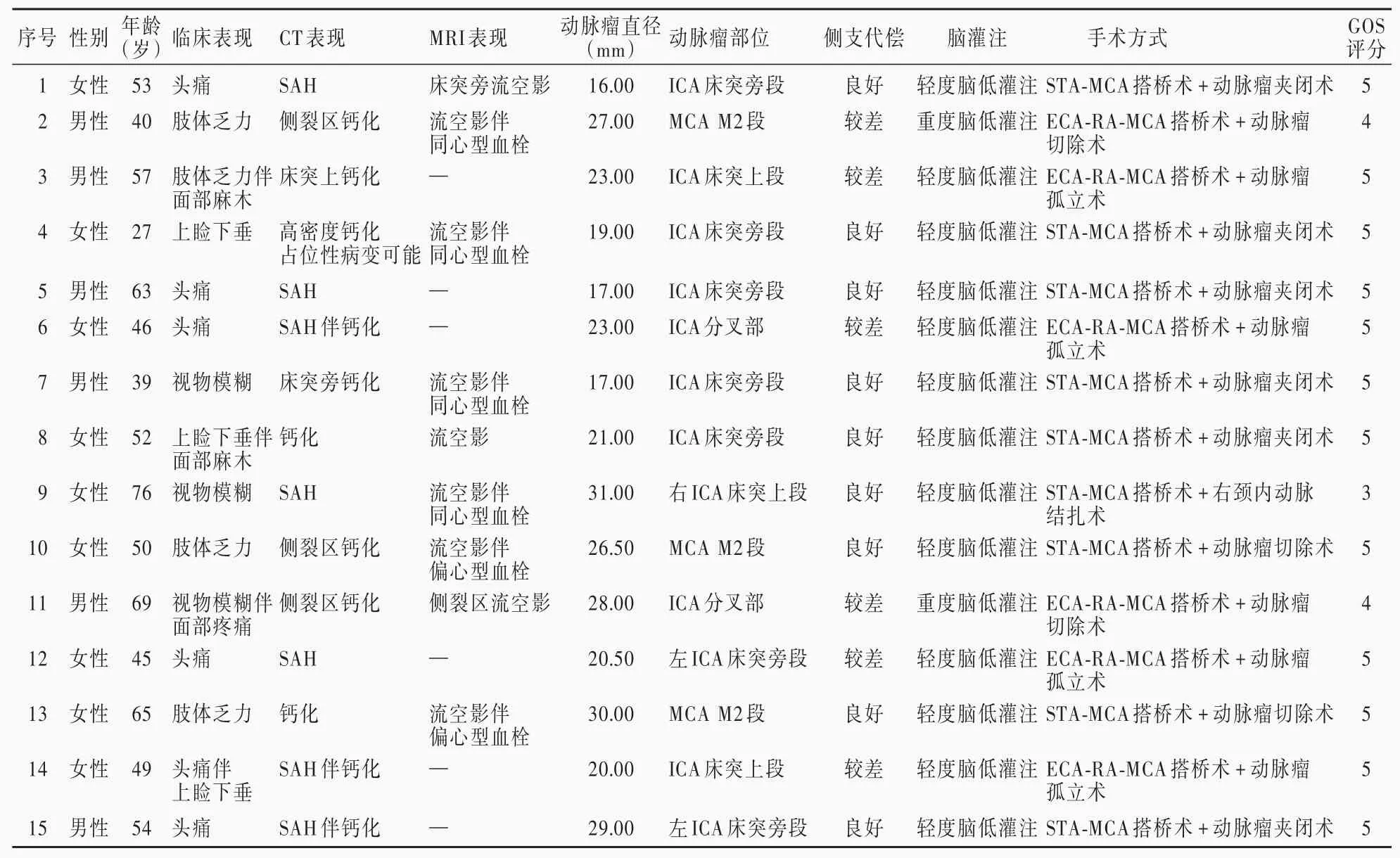
表1 15例颅内大型和巨大型血栓性动脉瘤患者的临床资料Table 1.Clinical characteristics of 15 patients with large and giant intracranial thrombotic aneurysms
本研究15例患者均顺利完成手术,有6例行STA⁃MCA低流量搭桥术联合动脉瘤夹闭术,2例行STA⁃MCA低流量搭桥术联合动脉瘤切除术,1例行STA⁃MCA低流量搭桥术联合颈内动脉结扎术,4例行ECA⁃RA⁃MCA高流量搭桥术联合动脉瘤孤立术,2例行ECA⁃RA⁃MCA高流量搭桥术联合动脉瘤切除术。术后复查DSA或CTA均显示动脉瘤消失,桥血管通畅。13例患者术后临床症状明显改善;1例(例9)右颈内动脉床突上段巨大型血栓性动脉瘤患者,右STA⁃MCA搭桥术联合颈内动脉结扎术后7 d突发右侧额颞部急性硬膜下血肿,行去骨瓣减压血肿清除术后呈浅昏迷,予气管切开和神经重症监护病房(NICU)支持治疗,术后6个月仍为浅昏迷;1例(例12)左颈内动脉床突旁段巨大型动脉瘤患者,术前四肢肌力5级,采用左ECA⁃RA⁃MCA高流量搭桥术联合动脉瘤孤立术,术后第1天其对侧肢体肌力降至3级,急诊行CT检查提示左侧基底节区梗死,经康复治疗,随访15个月后肌力恢复至5级。
本组患者出院后随访6~36个月,平均12.70个月。术后6个月14例预后良好(GOS评分4~5),有1例(例9)预后欠佳(GOS评分≤3)。
讨 论
由于血流动力学特点,颅内大型和巨大型动脉瘤可表现为血栓性动脉瘤[6],成为外科手术的难点,需个体化分析动脉瘤和载瘤动脉的特点,方可选择适宜的术式,包括开颅动脉瘤直接夹闭术,颅内外血管搭桥术联合动脉瘤夹闭术、切除术和孤立术,以及血管内介入栓塞治疗等。
术前CT、MRI、MRA和DSA可以对颅内血栓性动脉瘤大小、瘤内血栓、瘤壁钙化程度、瘤腔内血栓新鲜程度、载瘤动脉和瘤颈血栓连续性、瘤颈和瘤体涉及的穿支等进行全面评估[7],有助于选择适宜的术式并预测手术相关并发症。
颅内血栓性动脉瘤的治疗需首先分析动脉瘤类型。Lawton等[4]总结了68例颅内血栓性动脉瘤患者特点,并依据DSA等影像学结果分为6种类型:(1)同心型,为典型的血栓性动脉瘤。瘤体呈囊状,DSA显示瘤体体积较CT或MRI稍小,瘤内血栓呈“洋葱皮”样分层改变,提示不同时段血栓形成,瘤内血栓累及瘤颈。(2)偏心型,瘤内血栓附着于瘤顶或瘤壁一侧,不同于同心型,瘤内血栓未累及瘤颈。(3)分叶型,瘤颈可被瘤内血栓累及,DSA表现为单个囊状动脉瘤,术前难以检出呈多囊状的动脉瘤,与偏心型的CT或MRI表现相似,常需术中证实为多发分叶状动脉瘤。(4)完全血栓型,DSA显示载瘤动脉局部不规则,但瘤内对比剂不充盈,因CT或MRI表现类似颅内血管畸形或血肿,易误诊[5,8]。(5)管道型,DSA表现为梭形或者蛇形,并存在血栓沿瘤壁自载瘤动脉入口至出口呈现同心或偏心性延伸。(6)弹簧型,曾有动脉瘤弹簧圈栓塞治疗史,形成血栓,多为复发动脉瘤或者介入栓塞不完全的残留。本研究15例颅内大型和巨大型血栓性动脉瘤包括同心型4例,偏心型7例,分叶型1例,管道型2例,弹簧圈型1例,而未纳入新发血栓或完全血栓性动脉瘤。
颅内大型和巨大型血栓性动脉瘤的治疗应采取个体化原则[9]。Lawton等[4]认为,有41%同心型和64%偏心型动脉瘤直接夹闭或塑形夹闭,另有41%同心型和64%管道型动脉瘤需颅内外血管搭桥术联合动脉瘤孤立术。相较于直接夹闭,对于以下情况,颅内外血管搭桥术联合动脉瘤夹闭术、切除术和孤立术更是不可或缺的选择[6,10]:(1)瘤颈较宽、瘤颈或瘤壁钙化明显或者梭形动脉瘤,无法直接夹闭。(2)瘤体巨大,占位效应明显,伴随颅底神经受压。(3)载瘤动脉和瘤颈累及重要穿支,直接夹闭可能引发术后功能障碍。(4)介入栓塞术后复发动脉瘤,尤其是颈内动脉海绵窦段动脉瘤。同时亦不能忽视术中巨大型动脉瘤影响手术时,需要临时阻断载瘤动脉后动脉瘤穿刺抽吸减压、逆向抽吸载瘤动脉等辅助方式的重要作用。本研究15例患者分别采取STA⁃MCA低流量搭桥术联合动脉瘤夹闭术6例,STA⁃MCA低流量搭桥术联合动脉瘤切除术2例,STA⁃MCA低流量搭桥术联合颈内动脉结扎术1例,ECA⁃RA⁃MCA高流量搭桥术联合动脉瘤孤立术4例,ECA⁃RA⁃MCA高流量搭桥术联合动脉瘤切除术2例。
术前和术中充分评估血流动力学变化,有助于选择适宜的术式并减少术后并发症。颅内大型和巨大型血栓性动脉瘤涉及动脉瘤和载瘤动脉双重问题,处理动脉瘤的同时需确保载瘤动脉供血区的脑灌注。本组有9例患者术前TCD评估载瘤动脉及颞浅动脉额支或顶支血流,为STA⁃MCA低流量搭桥术提供了血流动力学指导;有6例患者术前行双侧前臂血管超声Allen试验,从而选择合适的桡动脉,行颅内外血管高流量搭桥术。15例患者术前均行BOT试验评估载瘤动脉阻断后的脑缺血耐受程度,如果同侧颈内动脉闭塞20分钟后出现头晕、肢体肌力下降等脑缺血症状,表明颈内动脉在孤立动脉瘤后可出现缺血性脑损伤,应行高流量血管搭桥术;如果未出现上述症状,进一步行CTP,脑血流量(CBF)≤30ml/100(g·min)则行低流量血管搭桥术,CBF>30 ml/100(g·min)则提示术后脑梗死可能性为低风险,则考虑直接夹闭动脉瘤。术前TCD Matas试验同样可以用于评估载瘤动脉侧支代偿,TCD监测患侧大脑中动脉血流,并压迫患侧颈内动脉颅外段,如果出现头晕和对侧肢体无力、麻木,提示侧支代偿较差[11]。术中ICGA以及颅内血管和颈部血管超声既可评估动脉瘤孤立术或切除术的可靠性,以印证术前评估效果,又可评估颅内外血管搭桥术后桥血管通畅性和载瘤动脉远端血流,从而尽可能提高术中脑血流动力学监测的安全性,减少术后手术相关缺血性卒中的发生。然而,术前BOT试验、CTP和TCD Matas试验并不能完全排除术后缺血性脑损伤的发生。本组有1例(例12)左颈内动脉床突旁段巨大型动脉瘤患者,术前四肢肌力5级,评价脑血流动力学后行左ECA⁃RA⁃MCA高流量搭桥术联合动脉瘤孤立术,其术后对侧肢体肌力降至3级,急诊CT提示左侧基底节区梗死,经康复治疗后肌力恢复至5级。
颅内血栓性动脉瘤患者的手术预后值得关注。Lawton等[4]总结68例颅内血栓性动脉瘤的疗效,86.76%(59/68)术后随访期间症状改善或无变化,79.41%(54/68)GOS评分达5或4。本组15例患者术后DSA均提示桥血管通畅和动脉瘤消失,13例术后临床症状明显改善;1例术后对侧肢体肌力下降,急诊行CT提示基底节区梗死,经康复治疗后肌力恢复至5级;1例术后7天突发急性硬膜下血肿,手术治疗后呈浅昏迷;无死亡病例。
血流导向装置、支架辅助弹簧圈栓塞可以辅助颅内大型和巨大型血栓性动脉瘤的外科手术[2,12],但也存在不足,因动脉瘤壁及瘤腔内血栓等特点,介入栓塞治疗易复发或再次破裂出血[13⁃14]。而单纯介入栓塞治疗并不能解除绝大多数血栓性动脉瘤的占位效应[3]以及对动眼神经和三叉神经等的压迫症状。本组有2例(例3、例14)表现为上睑下垂、面部麻木等颅底神经压迫症状,行颅内外血管搭桥术联合动脉瘤孤立术,切开动脉瘤并取出血栓后,上述症状消失。
综上所述,颅内外血管搭桥术可用于个体化治疗颅内大型和巨大型血栓性动脉瘤,术前脑血流动力学评估和动脉瘤分型可为治疗提供有利支持。
利益冲突无[1]Feng MT,Cao W,Li JN,Yang PF,Fang YB,Xu Y,Hong B,Huang QH,Liu JM.Effect analysis of embolization device for the treatment of large or giant intracranial aneurysms[J].Zhongguo Nao Xue Guan Bing Za Zhi,2017,14:32⁃36.[冯 明陶,曹伟,李嘉楠,杨鹏飞,方亦斌,许奕,洪波,黄清海,刘建民.血流导向装置治疗颅内大型和巨大型动脉瘤的效果分析[J].中国脑血管病杂志,2017,14:32⁃36.]

