苏氨酸的鱼类营养生理研究进展
王亚玲,王常安,刘红柏,张颖
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070)
苏氨酸作为必需氨基酸之一,在动物的正常生长和代谢中必不可少,发挥着重要的作用[1]。鱼类对蛋白质的需求实质是对氨基酸的需求。氨基酸作为蛋白质的组成单位,只能直接或间接从食物中获取。当饲料蛋白质中的一种或数种必须氨基酸过量或不足时,机体氨基酸不平衡,过量的氨基酸在体内分解供能,导致氨基酸损失;而当氨基酸不足时,鱼类利用饲料蛋白质的效率降低,生理功能受阻,影响正常的生长和发育[2]。尽管苏氨酸是最后发现的必需氨基酸,但是在维持动物生长中发挥着重要的作用。当饲料中苏氨酸补充不足造成氨基酸不平衡时,会阻碍动物进一步生长,即使按需要量添加蛋氨酸或赖氨酸或同时添加,也很难提高生长性能[3]。近十几年来,配合饲料中广泛使用合成赖氨酸和蛋氨酸,影响动物生长性能的主要限制性氨基酸成为苏氨酸,进一步研究苏氨酸已成为趋势[4]。目前,苏氨酸在家禽等陆生动物中的研究较为常见,对鱼类研究较少,所以详细了解鱼类对苏氨酸的需求以及苏氨酸对鱼类的影响及作用机理显得尤为重要。
1 苏氨酸营养生理研究进展
1.1 苏氨酸的结构和理化性质
1935 年,Rose 首次在纤维蛋白水解产物中分离出苏氨酸,是最后发现的必需氨基酸,因与苏糖有类似的结构故命名为苏氨酸(Threonine,Thr),化学名称为α-氨基-β-羟基丁酸,结构式为NH3-CH(COOH)-CHOH-CH3,分子式为C4H9NO3,相对分子质量为119.12。分子中含有两个不对称的原子,有D 及L 四种立体结构,其中具有生物活性的是L-型。它是一种含有极性侧链的氨基酸,D-氨基酸不能被动物吸收利用,对动物没有营养价值。构成蛋白质的氨基酸主要是L-苏氨酸,呈浅黄色或白色的粉末状,味微甜,无臭,不易溶于有机溶剂,如乙醇、乙醚、氯仿等,易溶于水,在碱性条件下易分解,熔点为255℃~257℃(分解)。无色或白色斜方晶粉末是D-氨基酸,物理性质与L-苏氨酸相似,不易溶于有机溶剂,易溶于水,遇碱易破坏,熔点为229℃~230℃。
1.2 苏氨酸在体内的主要营养代谢途径
动物不能合成苏氨酸,必需通过饲料补充来获取。苏氨酸在体内的代谢过程由苏氨酸脱氢酶(Threonine dehydrogenase,TDG)、苏氨酸脱水酶(Threonine dehydrase,TDH)和苏氨酸醛缩酶(Threo nine aldolases,TA)催化成其他物质,如丙酮酸、琥珀酰和甘氨酸来参与代谢,是唯一不发生转氨基和脱氨基作用的氨基酸[6]。苏氨酸的具体代谢途径见图1。Parimi 等[7]研究发现,苏氨酸在新生婴儿体内只能通过苏氨酸脱水酶进行降解,当食物中苏氨酸不平衡时,被标记的苏氨酸分子大部分转化为其他氨基酸。Darling 等[8]试验表明,在成人体内,苏氨酸脱氢酶占总氨酸分解代谢的7%~11%,是苏氨酸降解的次要代谢途径,主要通过苏氨酸脱水酶降解,取决于苏氨酸的摄入量,而不只是蛋白质水平。鱼类体内苏氨酸的代谢较少,有待进一步研究。
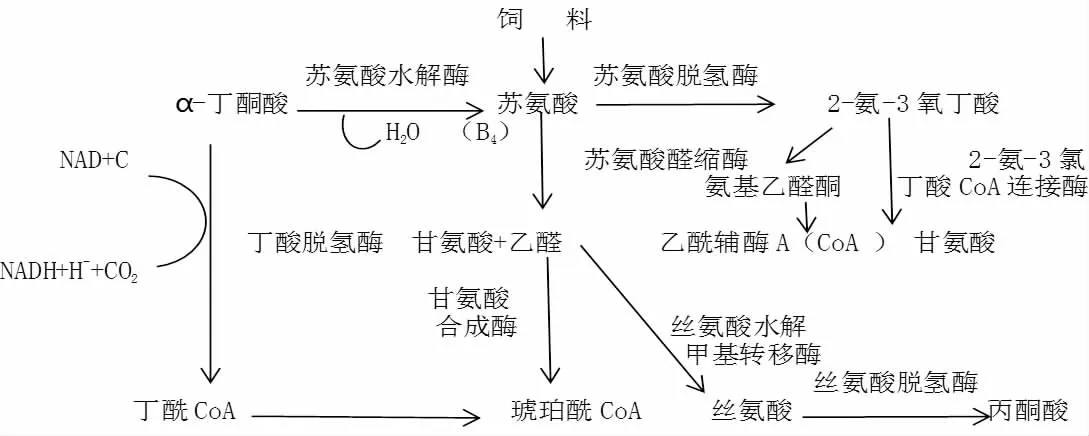
图1 苏氨酸代谢途径[5]Fig.1 The approach of threonine metabolism
1.3 苏氨酸的生理作用
1.3.1 参与体蛋白质的合成,促进生长
构成蛋白质的氨基酸有二十种,苏氨酸作为构成蛋白质的氨基酸之一,直接参与蛋白质的合成。饲料中添加适量的苏氨酸,不仅可以提高增重率和特定生长率等生长性能,还可以提高其他必需氨基酸的利用率,减少饲料蛋白的用量,减少氮的排放,有保护环境的作用。鲈Lateolabrax japonicus 幼鱼的增重率和氮累积率随饲料中苏氨酸含量的增加而显著增高,当苏氨酸的添加量达到最佳值1.67%时,随着饲料中苏氨酸含量进一步增加,增重率和氮累积率都有下降[9]。Bodin 等[10]对鳟Salmo playtcephalus和马苏大麻哈Oncorhynchus masou 的研究发现,饲料Thr 浓度和组氨酸成分之间存在折线关系,当苏氨酸的含量满足要求后不久两个断点均相继出现,可以看出组氨酸全身成分与Thr 含量或增长率之间似乎存在联系。在0~3 周龄和6~8 周龄肉仔鸡的饲料中添加苏氨酸可以提高氮沉积率[11];在饲料中添加适宜水平的苏氨酸可显著提高仔猪肝脏蛋白质的合成,氮的代谢也受饲料苏氨酸水平和比例的影响,进而导致动物体的蛋白沉积[12]。
1.3.2 苏氨酸在体内的免疫作用
苏氨酸作为免疫蛋白中的主要成分之一,与动物的免疫功能息息相关,能促进抗体的合成,影响免疫球蛋白的活性。免疫球蛋白中发挥重要作用的是γ-球蛋白,而禽类γ-球蛋白分子中数量最多的是苏氨酸,因此苏氨酸是禽类免疫球蛋白生成中的主要限制性氨基酸,在机体的免疫系统组织、器官中发挥重要的作用[13]。一般情况下,当抗原入侵机体后,使机体产生不同的免疫应答,体内如果缺乏苏氨酸,免疫球蛋白和T、B 淋巴细胞的产生受到抑制,抗体合成的速度会受到抑制,甚至影响抗体的合成,机体免疫系统不能发挥正常功能。苏氨酸还具有促进骨髓T 淋巴细胞前体分化和发育成为成熟淋巴细胞的作用,保护机体免受损伤。因此,饲料中添加适量苏氨酸可增强机体的免疫功能,减少死亡率。
苏氨酸是畜类免疫球蛋白分子中最主要的限制性氨基酸。Chen 等[14]研究表明,添加最佳浓度苏氨酸的肉仔鸡大肠杆菌Escherichia coli 和沙门氏菌Salmonella 数量减少,空肠免疫球蛋白A、免疫球蛋白M和分泌性免疫球蛋白A 的浓度均随着苏氨酸含量的增加而有所增加。灌服不同浓度的苏氨酸水溶液后,小鼠血清中的抗体随罐服量的增加显著高于对照组,淋巴细胞的转化能力也呈较强效应,表明苏氨酸能显著增强小鼠的体液免疫,与相关报道一致[15,16]。
2 鱼类对苏氨酸的营养需求研究进展
2.1 不同鱼类苏氨酸需求量的比较
目前已研究了大鳞大麻哈鱼Oncorhynchus tshawytscha、大西洋鲑Salmo salar、虹鳟Oncorhynchus mykiss、斑点叉尾Ictalurus punctatus、白鲟Acipenser transmontanus、大菱鲆Scophthalmus maximus、鲤Cyprinus carpio、尼罗罗非鱼Oreochromis niloticus、大吻鲈Dicentrarchus labrax、美国红鱼Sciaenops ocellatus 和印度鲮Cirrhinus mrigala 等鱼类对苏氨酸的需求(表1)。
一般用以下几种方法表示水产动物对氨基酸的需要量:1)日粮粗蛋白中氨基酸占的百分比(%);2)氨基酸在每兆焦代谢能中所含有的克数;3)每日1 kg 鱼对氨基酸的需求量,即g/(kg·d);4)饲料中氨基酸占的比例。可以看出方法3 是最准确的表示方法,但是不便于饲料制造商标示;饲料的投喂率在很大程度上取于饲料的营养水平和鱼类消化道的特点(容量)等;方法4 表示氨基酸需要量不是很准确。因此,为了方便比较,本文选择用方法1 将氨基酸的需要量数据表示为饲料蛋白的百分比。由表1可知,不同种类的鱼对苏氨酸的需求量不同,相比红海鲷的1.8%和澳洲银鲈的6.9%蛋白,需要量差异较大,因此,不同的研究者,即使相同种的鱼类,对氨基酸的需要量结果也不相同。

表1 不同鱼类对苏氨酸的需求量(/%饲料蛋白)Tab.1 Requirements of different fish species for threonine(/% dietary protein)
2.2 影响其需要的因素
2.2.1 鱼类的种类、规格和年龄
不同种类的鱼食性、生长环境和生态习性各不相同,对苏氨酸的需求量差异较大[41]。幼鱼和生长速度快的鱼类比生长与性成熟慢的鱼类需要更多的苏氨酸用于蛋白合成和沉积。Yue 等[42]研究表明,尼罗罗非鱼幼鱼最佳苏氨酸含量占饲料1.33%(饲料蛋白的4.44%);Sliva 等[43]研究表明,尼罗罗非鱼成鱼的最佳苏氨酸含量占饲料蛋白的5.50%。团头鲂Megalobrama amblycephala 饲料中限制性氨基酸含量在能量沉积和蛋白质采食间存在回归关系,可以推测出鱼的规格不同,所需氨基酸含量也不一样[44]。
2.2.2 蛋白源
蛋白源不同直接影响试验结果。在试验饲料配方中选择不同的蛋白源,所确定的苏氨酸需要量也不同。一般情况下,选择不同含量的苏基酸或者使用苏氨酸含量较低的植物蛋白源如小麦面筋、玉米蛋白、豆粕等添加到精致或半精致的饲料中来确定苏氨酸的需要量。对大多数鱼类而言,以蛋白质为氮源的生长率普遍高于以晶体氨基酸为氮源的生长率,而动物蛋白源又高于植物蛋白源[45,46]。当饲料蛋白源为蛋白质和动物蛋白时,鱼类对苏氨酸的需要量相对比较高。试验饲料配方中选择的氨基酸来源不同,确定的最佳苏氨酸需要量也不同。有研究发现,晶体氨基酸的溶失和与饲料中蛋白态氨基酸的吸收不同步都会影响鱼类对饲料中苏氨酸的利用率[47]。基础饲料中不同含量的鱼粉被新型蛋白源(大豆浓缩蛋白、脱酚棉籽蛋白、喷雾血球蛋白粉)代替时,星斑川蝶Platichthys stellatus 对苏氨酸的需要量发生了变化,精氨酸和组氨酸的需要量提高,而显著降低了其他必需氨基酸的需要量,因此蛋白源不同,对氨基酸需要量的影响不同[48]。
2.2.3 蛋白与脂肪水平
大部分鱼类利用蛋白来提供能量,鱼类对蛋白的需要量是陆生脊椎动物的2~3 倍,远超过陆生脊椎动物。在评判氨基酸的需要量时,蛋白的含量尤为重要。对宝石鲈Scortum barcoo 的研究发现,与对照组的23.64%相比,饲料中的蛋白水平为33.50%时,增重率最大,差异极显著[49]。
除了利用蛋白提供能量外,鱼类还可以利用脂肪作能量,因此,适当提高饲料中脂肪的含量,利用脂肪来提供能量消耗,使更多的蛋白质用于鱼类的生长。生物体内普遍存在的必需氨基酸组成比例被称为必需氨基酸比例模式。研究发现,不同蛋白与脂肪水平饲料显著影响鲑幼鱼肌肉的总必需氨基酸含量,饲料中添加55%的蛋白可以显著提高鱼体的蛋白含量和优化氨基酸比例模式[50]。
2.2.4 试验条件
影响苏氨酸需要量的试验条件主要为投喂率、试验周期和水温等。采用不同投喂率测定二龄大西洋鲑饲料的苏氨酸维持量时,发现饲料苏氨酸的需要量可能甚至高于Helland 测定的1.54%饲料需要量[51]。试验周期长短直接影响试验鱼的生长率和生理状态,因此,试验周期不同,鱼类对苏氨酸的需求存在差异。Gao 等[52]研究表明,草鱼Ctenopharyngodon idellus 幼鱼试验周期为10 周时,苏氨酸需要量占饲料1.37%;试验周期为60 d 时,草鱼幼鱼苏氨酸需要量为1.62%。试验温度影响鱼类的生长和生理状况和对苏氨酸的吸收和代谢,从而影响苏氨酸的需要量[53]。水温26~32℃时,鲈苏氨酸需要量为1.77%和1.88%,占饲料蛋白质的4.21%和4.47%[9]。试验温度为19~24.5℃时,鲈苏氨酸需要量占饲料蛋白的4.09%和4.18%[54]。投饵频率、养殖密度等试验条件也影响鱼类对苏氨酸的需求量,最终导致试验结果产生差异。
3 苏氨酸对鱼类生长性能的影响
苏氨酸作为必需氨基酸之一,饲料中缺乏或者过量时会严重影响家禽的生长速率和饲料利用率[55]。同样,缺乏苏氨酸也会导致鱼类的生长性能和饲料利用率降低,提高正常饮食水平下其他必需氨基酸和非必需氨基酸的氧化程度[56]。饲料中苏氨酸不平衡时,鼠的采食量在短时间内降低,引起Lepin、胰岛素水平改变影响动物的采食行为,使采食量在数小时内迅速降低,出现厌食现象,影响生长速率[57]。苏氨酸含量较低时,多种鱼类生长速率减慢,摄食减少,开始厌食,体重减轻,生长受阻;之后随着苏氨酸含量的增加至最佳水平,生长速率显著增高;高比例添加苏氨酸,超过最佳需要量时,生长性能下降[58,59]。当苏氨酸的添加量超过最佳需要量时,对鱼类的生长产生不利的影响,推测可能是因为排泄和脱氨作用额外消耗的能量,引起鱼类的应激反应,干扰其他氨基酸的吸收和利用[60]。苏氨酸不平衡鱼类生长缓慢的机制还需进一步研究。Yue 等[42]生长试验研究发现,当饲料中苏氨酸含量增加到1.13%时,尼罗罗非鱼幼鱼生长速率增加,增重率明显升高;当苏氨酸进一步增加时,鱼的增重率下降。随着饲料中苏氨酸水平的增加,鲈的特定生长率明显升高,在苏氨酸含量2.00%组中达最大值;苏氨酸含量进一步增加时,高比例添加组的特定生长率和蛋白质效率均下降[61]。饲料中苏氨酸含量过多会触发团头鲂幼鱼血浆中天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)的活性[62]。
4 苏氨酸对鱼类消化吸收能力的影响
养殖动物对饲料不同原料的可利用性不同。动物对饲料原料的可利用性和可利用能力常用吸收率和消化率作为综合指标来评价[63,64]。很多研究表明,不同饲料的蛋白质在同种动物中具有不同的蛋白质消化率。苏氨酸对鱼类消化吸收能力的影响研究较少,经常用肠道消化酶的活力大小反映鱼类对营养物质的消化能力[65,66],用肠道皱襞高度衡量水生动物吸收的能力。在饲料中添加苏氨酸显著提高了幼建鲤Cyorinus carpiovar jian 肠道蛋白酶和脂肪酶的活力;微囊苏氨酸组幼建鲤前肠和中肠的皱襞高度均显著高于晶体苏氨酸组。Na+,K+-ATP 酶分解ATP 产生的能量促进苏氨酸的吸收转运,而营养物质的吸收与碱性磷酸酶、谷氨酰转肽酶活性有关,活力间接反映小肠的吸收能力。试验发现,微囊苏氨酸组幼建鲤前中后肠的碱性磷酸酶、Na+,K+-ATP酶和中、后肠的谷氨酰转肽酶活力均显著高于晶体苏氨酸组[67]。Habte-Tsion 等[63]研究发现,随着饲料中苏氨酸水平的升高,团头鲂肠重量、肠壁体重和肠内蛋白质含量均升高,胰蛋白酶、淀粉酶也随着苏氨酸水平的升高而升高。Feng 等[68]研究发现,随着饲料中苏氨酸含量的增加,建鲤各肠段的γ-谷氨酰转肽酶和Na+,K+-ATP 酶,肝胰腺和肠段中的4E-BP2 基因表达都显著增强,表明饲料中增加苏氨酸对鱼类的消化吸收能力、肠细胞增殖和分化有很大的影响。Hong 等[69]研究发现,苏氨酸能显著增加草鱼鱼种肠内α-淀粉酶、脂肪酶、碱性磷酸酶、β-谷氨酰转肽酶和肌酸激酶的活性,表明增加饲料苏氨酸可以改善鱼类肠道的生长,增强消化吸收的能力。
5 苏氨酸对鱼类免疫系统的影响
免疫系统是指在种进化过程中逐渐建立起来的机体识别和清除“异物”的防卫系统[70,71]。无脊椎动物只有非特异性免疫,即吞噬细胞的吞噬作用和炎症反应的能力,而在低等脊椎动物中,只有淋巴细胞,但其分化程度仍很差[72,73]。
与其他高等脊椎动物一样,鱼类的免疫也分为细胞免疫和体液免疫。细胞免疫主要为吞噬细胞的吞噬率、杀菌能力和呼吸暴发等非特异性细胞免疫[74,75]。而体液免疫有特异性体液免疫和非特异性体液免疫。凝集素、溶菌酶、抗蛋白酶、C-反应蛋白、干扰素-1、转移因子以及补体等参与非特异性体液免疫[76,77]。有研究发现,鱼类替代补体活力水平远高于哺乳动物,说明在防止病害入侵时鱼类更依赖替代途径补体。大多数鱼类抗体仅有IgM,而特异性体液免疫主要涉及特异性抗体的产生,因此,非特异性免疫在鱼类受到外来病毒入侵时发挥重要的作用[78]。
饲料中添加苏氨酸可以提高鱼类的免疫功能,提高补体3(C3)、补体4(C4)和免疫球蛋白M(IgM)的含量,上调肝脏的mRNA 表达水平。通过提高抗氧化酶活性和相应的同种型mRNA 水平来减少氧化损伤,改善免疫器官细胞结构的完整性。Dong等[79]对草鱼幼鱼的研究发现,与最佳苏氨酸补充组相比,缺乏苏氨酸组用嗜水气单胞菌攻击14 d 后,抗肠炎的能力降低,肠溶菌酶活性、酸性磷酸酶活性、补体3(C3)和补体4(C4)以及IgM 含量都显著降低;并且下调了肝脏抗菌肽LEAP-2A、LEAP-2B、hepcidin、IgZ 和IgM转录的表达;上调了肠道促炎细胞因子TNF-α、IL-1β、IL-6、IL-8 和IL-17D 的mRNA 水平;下调了肠抗炎细胞因子转化生长因子TGF-β1 和TGF-β2。
6 研究展望
苏氨酸在鱼类的需求量、影响因素、对生长性能、消化吸收、免疫影响等已有较深入研究,但仍然有一些问题没有完全清楚,如:(1)许多养殖鱼类对苏氨酸的需求量尚未清楚;(2)苏氨酸在鱼类的具体合成途径和代谢途径尚未完全清楚;(3)苏氨酸对鱼类营养生理的分子机制和代谢过程仍有很多问题尚未完全清楚;(4)苏氨酸与其他氨基酸和维生素之间的相互作用对不同鱼类的有利和有害影响尚未完全清楚。

