非酒精性脂肪性肝病患者肝纤维化程度与慢性肾病的相关性
章雅南 刘奕婷
(中国医科大学附属第一医院 1病案管理中心,辽宁 沈阳 110001;2体检中心)
近年来,由于人们高脂肪、高热量等饮食结构的改变及久坐不动的生活方式,使得非酒精性脂肪性肝病(NAFLD)的患病率逐年递增,并跃居成为我国第一大慢性肝病〔1〕。其疾病谱包括单纯性脂肪肝、非酒精性脂肪性肝炎、肝纤维化、肝硬化和肝细胞癌,此外除了这些进展期肝病,NAFLD还会引起一些肝外并发症,如心血管系统疾病、慢性肾病(CKD)、内分泌系统疾病等〔2~4〕。有研究表明NAFLD严重程度与CKD进展情况相关,NAFLD 可能是CKD发生的独立影响因素〔5〕。CKD作为一种以进行性肾脏损伤为特征的慢性疾病,极易发展成为终末期肾病,具有较高的发病率、死亡率、临床和经济负担,已经成为21世纪全球重大的公共卫生问题。一项全国范围内的大型流行病学调研发现,我国的CKD患病率为10.8%,即大约有1.2亿人患有此类疾病,但是我国的CKD发现率仅为12.5%〔6,7〕。因此,及时发现和诊断肝脏炎症反应及纤维化程度,提早预测NAFLD合并慢性肾损伤的发病风险,对NAFLD的治疗和预后及延缓CKD的发生、发展具有重要的意义。鉴于肝脏组织活检的侵入性、有创性、患者接受度不高等特点,本研究采用纤维化-4指数(FIB)-4、NAFLD纤维化评分(NFS)、体重指数(BMI)、天冬氨酸氨基转移酶(AST)/丙氨酸氨基转移酶(ALT)、糖尿病评分(BARD)和AST血小板比率指数(APRI)4种血清学无创肝纤维化评分系统评估NAFLD进展期纤维化及NAFLD并发CKD的发生风险,从而筛选出识别早期CKD的最佳评分系统。
1 对象与方法
1.1研究对象 回顾性分析2019年1~12月在中国医科大学第一医院体检中心接受常规体检并经超声诊断为NAFLD人群的数据资料。经过严格的纳入和排除标准,发现NAFLD者12 309例,根据是否合并CKD,获得323例NAFLD合并CKD者和11 986例单纯NAFLD者,为了使两组资料均衡可比,采用倾向性得分匹配(PSM)分析的方法,以年龄、性别和BMI为协变量,按照1∶4的比例进行匹配。纳入标准为:①自愿参加此项研究并签署了知情同意书,同意对其结果进行研究的分析、利用;②相关数据资料真实、完整。排除标准为:①年龄<18周岁或>80周岁;②有过量饮酒史,其中男性折合乙醇摄入量超过20 g/d或女性超过10 g/d〔8〕;③其他可以导致脂肪肝的特定疾病;④NAFLD合并恶性肿瘤者;⑤妊娠或哺乳期妇女;⑥近期服用影响肝脏或肾脏代谢药物者。
1.2研究方法
1.2.1人口学资料及人体测量学指标 检前填写慢性病风险评估问卷,获得受检者的性别、年龄、疾病史、用药史、饮酒及生活习惯史等。身高、体重的测量采用人体成分分析仪,获得BMI。连续2次测量受检者静息状态下的血压,记录收缩压和舒张压的平均值。
1.2.2临床生化指标 受检者需禁食8 h以上,于次日清晨进行体检。抽取空腹状态下静脉血,送至医院医学检验中心,采用日立Cobas 8000全自动生化分析仪进行检测,指标包括血红蛋白、血小板、血清白蛋白、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FPG)、ALT、AST和γ-谷氨酰转移酶(GGT)、血尿酸、血尿素氮和血肌酐。
1.2.3NAFLD的诊断 参照中华医学会肝病学分会脂肪肝和酒精性肝病学组发布的非酒精性脂肪性肝病防治指南(2018更新版),NAFLD的诊断主要依据腹部超声结果〔8〕。彩超型号为西门子Acuson X300,探头频率3.5 MHz,经由经验丰富且受过专业培训的高年资超声医生完成。
1.2.4CKD的诊断 根据血清生化指标结果,采用CKD-EPI公式计算每名受试者的肾小球滤过率(eGFR)〔9〕。CKD的诊断采用国际通用的标准〔10〕,定义为eGFR<60 ml/(min·1.73 m2)和(或)尿蛋白+~和(或)血尿+~,其中伴有尿白细胞+~和尿红细胞弱阳性、疑似尿路感染者排除CKD的诊断。eGFR计算公式如下:①男性血肌酐≤80:eGFR=141×(血肌酐/0.9)-0.411×(0.993)年龄;②男性血肌酐>80:eGFR=141×(血肌酐/0.9)-1.209×(0.993)年龄;③女性血肌酐≤62:eGFR=144×(血肌酐/0.7)-0.329×(0.993)年龄;④女性血肌酐>62:eGFR=144×(血肌酐/0.7)-1.209×(0.993)年龄。其中血肌酐单位为μmol/L,除以88.4换算为mg/dl。
1.2.5肝纤维化评分 NAFLD患者肝纤维化的严重程度采用FIB-4、NFS、BARD和APRI评分系统进行评估。各评分系统的计算公式如下:①FIB-4〔11〕:〔年龄(岁)×AST(U/L)〕/〔血小板计数(109/L)×ALT(U/L)1/2〕;(2)NFS〔12〕:-1.675+0.037×年龄(岁)+0.094×BMI(kg/m2)+1.13×空腹血糖受损或糖尿病(是=1,否=0)+0.99×〔AST(U/L)/ALT(U/L)〕-0.013×血小板计数(109/L)-0.66×血清白蛋白(g/dl);(3)BARD〔13〕:BMI≥28 kg/m2(是=1,否=0)+〔AST(U/L)/ALT(U/L)〕≥0.8(是=2,否=0)+糖尿病(是=1,否=0);(4)APRI〔14〕:〔AST(U/L)/正常上限×100〕/血小板计数(109/L)。

2 结 果
2.1两组人群基线特征比较 经PSM分析后,共纳入1 307例受检者。其中NAFLD合并CKD组323例,单纯性NAFLD组984例;88例NAFLD合并CKD者未完全匹配到合适对照;男性832例(63.66%),女性475例(36.34%);平均年龄为65(59,73)岁。对两组资料进行基线特征比较,结果显示NAFLD合并CKD组的收缩压、舒张压、TG、TC、FPG、血尿酸、血尿素氮、血肌酐、GGT、FIB-4评分、NFS评分、BARD评分和APRI评分显著高于单纯性NAFLD组(P<0.05),血红蛋白浓度、血小板计数和HDL-C水平则显著低于单纯性NAFLD组(P<0.05),见表1。

表1 两组NAFLD人群的基线特征比较〔M(P25,P75)〕
2.2NAFLD合并CKD相关影响因素的多元Logistic回归分析 为了防止FIB-4、NFS、BARD和APRI这4个变量间的多重共线性影响,本研究以是否发生CKD为因变量,将这4个指标与其他单因素分析有意义的指标作为自变量分别构建了4个多元回归模型。多因素分析结果显示,FIB-4、NFS和BARD这3个肝纤维化评分指标均是NAFLD合并CKD发生的独立影响因素(P<0.05),而APRI尚未发现具有统计学意义,见表2。
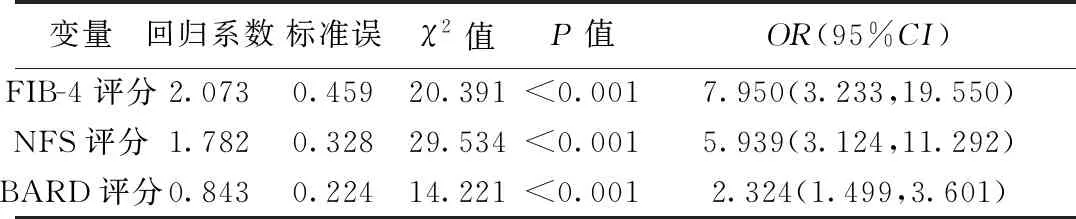
表2 肝纤维化评分指标预测NAFLD合并CKD的多元Logistic回归分析
2.34种评分指标对NAFLD合并CKD发病风险的预测价值 FIB-4、NFS、BARD和APRI这4种血清学无创肝纤维化评分指标预测NAFLD合并CKD的最佳临界值和ROC曲线下面积分别为0.942(0.883),-1.84(0.842),2(0.635)和0.28(0.566),提示FIB-4和NFS评分具有较高的预测价值,但是BARD和APRI评分则无临床意义,见表3。
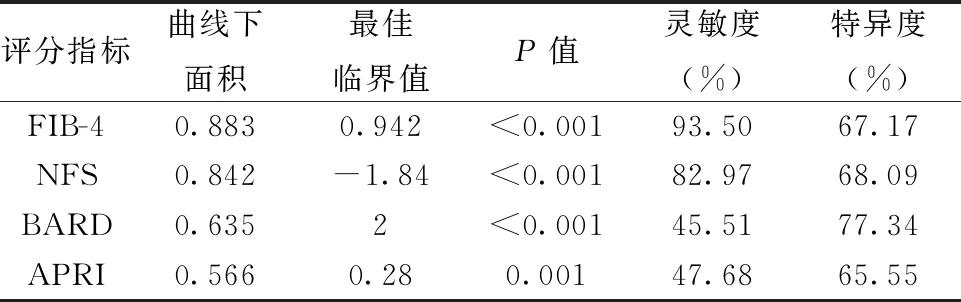
表3 4种评分指标对NAFLD合并CKD发生风险的临床诊断价值
3 讨 论
近年来,随着国内外学者对NAFLD的深入研究,越来越多的证据显示NAFLD可以增加CKD的发生风险。申振伟等〔15〕基于常规体检的10 775例体检者的回顾性纵向队列研究资料进行分析,在调整了多种危险因素的影响后,NAFLD仍然是CKD发病的独立危险因素(HR=1.20,95%CI:1.05~1.38,P=0.01)。此外,Musso等〔16〕的Meta分析报道NAFLD的纤维化程度与慢性肾脏损伤存在关联,但是纳入的研究均为小样本量的病例对照研究,且肝纤维化的分期主要是依据肝脏组织活检,而肝脏组织活检由于其侵入性、有创性、技术要求高、患者较难接受等特点,无法大范围开展。因此,本研究采用FIB-4、NFS、BARD和APRI四种血清学无创肝纤维化评分指标评估NAFLD进展期纤维化,并比较它们对CKD发病风险的预测价值,进而筛选出识别早期CKD的最佳评分系统,这在当前的研究中比较少见。
Sumida等〔17〕进行的一项纳入576例接受肝脏组织活检的NAFLD患者的研究发现,FIB-4评分系统对NAFLD患者中出现进展期肝纤维化的预测价值较高,优于其他无创评分组,应用此评分系统可使NAFLD患者免于肝脏组织活检。本研究发现FIB-4、NFS和BARD评分仍然是NAFLD并发CKD的独立危险因素,FIB-4和NFS评分对NAFLD合并CKD发病风险的预测价值较高。
目前,NAFLD促进CKD发生发展的作用机制尚不十分清楚。有几种学说用以解释NAFLD及其不同程度肝纤维化水平与CKD较高发病风险间的联系:①胰岛素抵抗:胰岛素抵抗是肝脏纤维化的独立影响因子,NAFLD发生高度纤维化后,JNK通路的激活参与了胰岛素抵抗的发生,所引发的高胰岛素血症激活了交感神经系统,促进血管内皮收缩,造成钠潴留和利尿钠肽系统的下调,进而导致肾脏损伤〔18〕。②炎症和氧化应激:非酒精性脂肪性肝炎患者NF-κB通路的激活,增加了多种促炎症因子如白细胞介素-6、C-反应蛋白、转化生长因子-β、肿瘤坏死因子-α、纤溶酶原激活物抑制剂-1等的转录,从而导致肾脏的慢性损伤〔19〕。不仅如此,氧化应激在NAFLD并发CKD的过程中也发挥着重要的作用。肝脏脂肪变性产生过多的游离脂肪酸,可诱导线粒体发生β氧化,出现中性粒细胞浸润增多,生成大量活性氧簇,导致细胞损伤和凋亡,机体表现出肾脏功能损伤〔6〕。③肥胖、胎球蛋白A和脂联素:肥胖患者体内胎球蛋白和脂联素可能是连接NAFLD和CKD的重要介质,其循环水平的改变参与了CKD的发生、发展过程〔20〕。④高凝状态及促粥样硬化性血脂异常:NAFLD可导致动脉粥样硬化性血脂异常,增加肾脏堆积的脂肪酸,引起肾脏细胞的凋亡,导致肾脏的血管损伤和肾脏内皮功能障碍,促进CKD的发生、发展〔21〕。⑤肾素-血管紧张素-醛固酮系统(RAAS)的激活:血管紧张素Ⅱ可能参与非酒精性脂肪性肝炎的进展,RAS的激活,引起血管紧张素Ⅱ及醛固酮分泌增加,造成水钠潴留,肾毛细血管压力增高,造成肾小管硬化和肾脏功能受损〔22〕。此外,还有一些学说认为肝脏脂肪变性可以使肠道微生态系统失衡,促进肝脏内炎症反应,使尿液中毒性代谢产物堆积,对肾脏造成损伤〔23〕。
本研究也存在着一定范围的局限性:①NAFLD的诊断未采用金标准肝脏组织活检,而是采用临床上应用较为广泛的超声检查,可能会低估一部分脂肪浸润小于30%的患者。②大规模流行病学调查发现NAFLD人群中CKD的发病率高达20%以上,但是本研究纳入的NAFLD人群CKD发病率仅为2.62%,可能是因为常规体检人群具有一定的局限性,尚不能代表全人群发病率〔7〕。③本研究属于回顾性分析,尚不能进行因果论证。因此在今后的研究中,有必要选取更具有代表性的社区人群作为研究对象,设计大样本量的前瞻性队列研究,来进一步深入探索NAFLD与CKD发病之间的关系,以期尽早发现NAFLD合并CKD的患者,适时调整这两种疾病的治疗方案,提高患者的生存质量。

