半剂量荧光素钠造影剂对轻中度慢性肾病患者肝肾功能的影响
——回顾性队列研究
李 莹,石 磊,贾 亮,张鸿瑫
1解放军总医院第三医学中心眼科医学部,北京 100853;2解放军总医院京南医疗区,北京100036
荧光素钠(FINa)是现今最为临床认可的眼底血管荧光造影剂,虽然其安全性及稳定性高,但由于其肝肾代谢的特殊性,对于肾功能异常的患者,全剂量荧光素钠的使用仍是临床高危因素和相对禁忌,这使很多肾病患者无法通过FAG得到精确诊断和及时治疗[1-2]。近年来,对于肾功能损伤患者眼底荧光造影检查过程中如何降低造影剂肾病(CIN)发生率的问题逐渐引起了临床医生的广泛关注和重点研究[3]。CIN是医院获得性急性肾衰竭(ARN)的第3位常见原因。典型的CIN一般在使用造影剂后1~2 d内发生,3~5 d达到高峰,7~10 d血清肌酐(Scr)可能恢复正常,但也有部分患者进入慢性肾衰竭,甚至需要维持性肾脏替代治疗。国内外报道中关于CIN的发生率差异较大[4-5],针对荧光素钠的研究更为少见,并且均为全量应用的对比分析[6-8]。就国内而言尚无研究分析半量荧光素钠对肾功能损伤患者的影响[9]。本文在综合文献及药理特性的基础上进行回顾性研究,观察半剂量荧光素钠造影剂对确诊的慢性肾病的患者的肾小管和肾小球的影响。
1 资料和方法
1.1 一般资料
选择2017年1月~2021年1月于解放军总医院第一医学中心肾内科肾功能正常及轻中度异常的住院患者,共纳入77例患者,其中男性50例,女性27例,年龄53.5±9.6岁(24~72岁),中位年龄54岁。诊断标准:造影后48 h内发生急性肾损伤(AKI),排除其他原因后,可诊断为CIN。CIN标准为:血管内注射造影剂后72 h内出现Scr 升高0.5~1 mg/dl(44.2~88.4µmol/L),或较基础值升高25%~50%。排除标准:造影前1月内肾功能不稳定,波动范围超过基线的20%;造影后1周内新加用ACEI、利尿剂、非甾体类解热镇痛药或其他肾毒性药物;孕妇;造影剂过敏;心衰、房颤室颤患者;维持性血液透析或腹膜透析治疗;伴出血性疾病;同时进行碘造影成像的病例;依从性差。本研究已通过医院伦理委员会审查。
1.2 半剂量FAG方法
所有患者使用海德堡激光眼科诊断仪Spectralis HRA进行FAG。
1.2.1 造影剂用法 使用荧光素钠注射液,历设得Flurescite,(规格5 mL:0.5 g 10%),含荧光素100 mg/mL(相当于荧光素钠113.2 mg/mL),所用辅料为氢氧化钠/注射用水。选择肘静脉进行造影剂注射,注射时间为4~5 s。注射计量为2.5 mL。注射后7~14 s开始观察拍摄,15 min后结束拍摄,观察30 min患者无不适后方可离开[10]。
1.2.2 观察指标 测定FAG前3 d(任1 d)及造影后第1、3、7、30天的转氨酶(ALT、AST)、Scr、血尿素氮(BUN)、血β2微球蛋白(β2-MG)、尿渗透压等,计算肾小球滤过率、造影剂肾病的发生率、造影剂诱发的急性肾损伤(CIAKI)的发病率及平均住院时间。eGFR计算公式为:GFR=a×(Scr/b)c×(0.093)age,其中a值根据性别与人种分别采用:女性=144、男性=141。b值根据性别不同采用:女性=0.7、男性=0.9。c值根据年龄与Scr值的大小分别采用如下数值:女性[Scr≤0.7 mg/dL(62 μmol/L)=-0.329;Scr>0.7mg/dL(62μmol/L)=-1.209],男性[Scr≤0.9mg/dL(80μmol/L)=-0.411;Scr>0.9mg/dL(80μmol/L)=-1.209]。
1.3 统计学方法
采用SPSS 25.0软件进行统计学处理,计量资料用均数±标准差表示,FAG前后比较采用配对t检验;计数资料采用率或构成比表示,组间比较采用卡方检验。以P<0.05为差异具有统计学意义。
2 结果
造影前平均Scr为109.7µmol/L,BUN为7.76mmol/L,尿NAG酶浓度25.3 U/L,血β2-MG为0.385µg/mL,尿渗透压为579 mOsm/kg·H20,ALT为18.2 U/L,AST为16.2 U/L,eGFR为58.4(表1、2)。77例患者中,共发生1例CIN,发病率为1.3%。
FAG 前后BUN、尿β2-MG、快速微量白蛋白/肌酐差异均无统计学意义(P>0.05)。Scr在FAG后1、7 d均无升高,3 d升高24.6±2.3(P<0.01),30 d升高16.0±21.7(P=0.239)。尿NAG 酶、尿渗透压、尿白蛋白定量在FAG术后1、3、7、30 d均明显降低(P<0.01)。eGFR在术后第3天下降10.23±0.62,术后第7天恢复正常。血β2-MGFAG在术后3 d升高值0.314±0.121(P<0.01),术后7 d降低0.134±0.143(P=0.391),术后30 d升高0.119±0.058(P=0.402)。造影前后的转氨酶在术后第3、7天有显著下降(P<0.01,表1)。
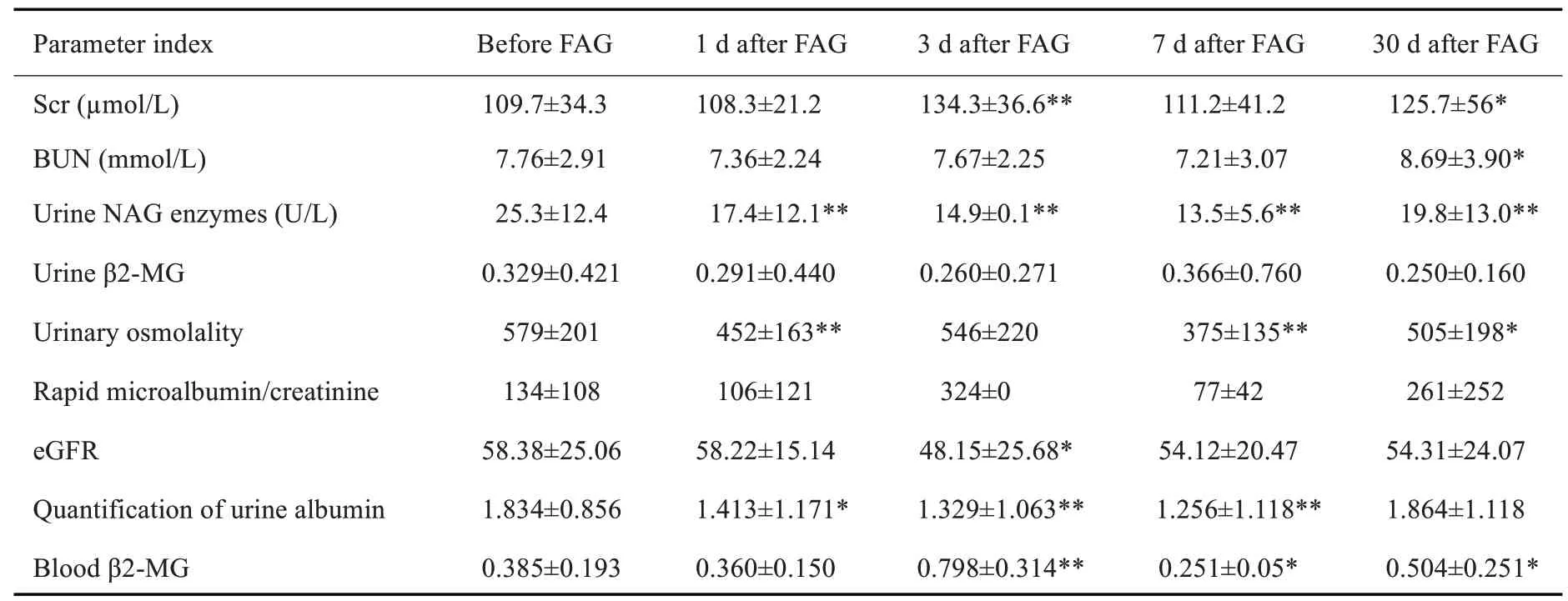
表1 FAG前后肾功能的变化Tab.1 Changes in renal function before and after FAG(Mean±SD)
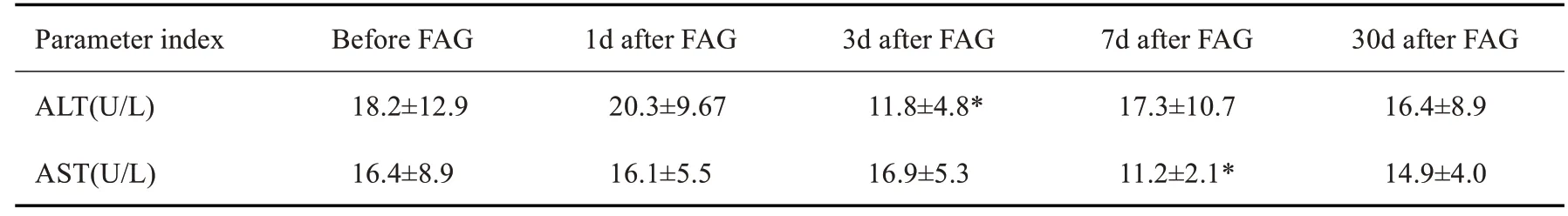
表2 FAG前后肝功能的变化Tab.2 Changes in liver function before and after FAG(Mean±SD)
3 讨论
FAG对眼底疾病的诊断和治疗有着决定意义,造影剂FINa的临床常用剂量为250~1000 mg(相当于15~20 mg/kg),成人最大剂量1g,所用浓度及剂量为10%溶液5 mL或20%溶液3 mL[11,12]。FINa不参加体内代谢分解,不与组织牢固结合[13,14]。一般机体对荧光素钠有很好的耐受性,毒性极微,组织匀浆液荧光强度的测定结果显示:不同脏器之间FINa分布极不均匀,脑部最低,肝肾最高,心肺次之;进入体内的荧光素钠24 h大部分通过肾脏排出体外,其余经胆道排出,因此有心、肝、肾疾病患者要慎用,严重者应忌用[15]。
近年来随着医学影像设备的高速发展,眼底荧光造影设备的不断更新完善,眼底成像的清晰度节节攀升,现基本的成像系统已从早期的绿光片反射,改变为激光单波段反射直接成像,所用成像系统分辨率不断提高,使图像的清晰度不断提高,同时FAG造影剂也不断改良[16,17]。但对于慢性肾病肾功能不全的患者,造影剂的应用依然是高危因素,造影导致的AKI也频繁发生,其发病率已成为仅次于药物和手术的常见医源性肾损害的第三大原因[18]。尤其近年来慢性肾病的发病率与患病率均呈上升趋势,造影剂肾病对于这部分患者可能会出现不可逆的肾功能丢失,且无特异性治疗方法,其死亡风险显著增加。所以如何预防避免其发生就成为重中之重[19],然而对慢性肾脏疾病患者应用造影的肾脏安全性报道确少见。在满足显影的前提下尽量减少造影剂用量是减少肾损伤的有效方法,现今眼底造影设备的不断进步也为造影剂减量的应用提供了坚实后盾,可以满足减量造影剂下对FAG成像质量的要求[20,21]。
对于不能用其他方法替代而必须造影的患者,有研究推荐根据肾功能状况计算造影剂最大允许剂量的计算公式[13,14]:最大剂量(mL)=5×体质量(kg)/Scr(mg/dl)超过该剂量的患者CIN 的发生率和病死率均显著升高。鉴于此,我们给于慢性肾病肾功能正常或轻中度损伤患者行半量FINa的FAG检查,并对所有患者测定造影前;造影后第1、3、7、31天Scr、尿β2—MG、尿素、GFR、统计其CIN的发生率、CIAKI的发病率。
本研究显示,慢性肾病肾功能正常或轻中度损伤患者行半量FINa的FAG检查,对于患者肾功能所检测指标影响甚微,有效的减低了FINa的肾脏毒性作用,对于CIN 和CIAKI的发生有明显的预防效果。77例患者中只有1 例发生CIN,发病率为1.30%。对于文献报道FINa 作为造影剂的FAG检查CIN的发生率5%~6%[20],明显下降。FAG前后BUN、尿β2-MG、快速微量白蛋白/肌酐的差异均无统计学意义。Scr在FAG后1、7 d均无升高,3 d 升高,这与FINa对肾功能影响2~3 d 为最高峰,5~7 d恢复正常的特性高度一致,同时得到3 d峰值变化,尿β2-MG、快速微量白蛋白/肌酐差异均无统计学意义。这与报道上全量FINa应用后尿β2-MG、快速微量白蛋白/肌酐均明确升高[21]有显著差异,说明半量FINa 对于肾小球及肾小管的损几极小,明确了半量FINa对肾脏的安全性。患者造影期间持续肾内科对原发病的原始方案治疗,并未因FAG造影追加或改变原治疗方案,本研究观察发现尿NAG酶、尿渗透压、尿白蛋白定量在FAG术后1、3、7、30 d均明显降低。eGFR在术后第3天显著下降,术后第7天恢复正常。血β2-MGFAG术后3 d升高,术后7 d明显降低,术后30 d升高。结果证明,半量FINa应用下FAG造影没有对轻重型肾病患者的治疗和病情恢复造成任何影响。研究还观察到造影前后的转氨酶,术后第3、7天有显著下降,明确了半量FINa应用下FAG造影没有对轻重型肾病患者的肝功能未造成影响及损伤。
综上所述,本研究明确显示了半量FINa眼底荧光血管造影对轻度中慢性肾病患具有很高的安全性,半量FINa 眼底荧光血管造影对轻度中慢性肾病患是可行的,可用此方法帮助轻度慢性肾病患完成其眼底荧光血管造影的检查,为轻中度眼底荧光血管造影剂的临床应用提供更明确的用量用法依据,为慢性肾病患完善其眼底的诊断及治疗提供安全保障。

