褪黑素可改善PBDE-47所致PC12细胞的异常自噬与凋亡
肖博雅,董理鑫,高 慧,杨凯朝,王亚飞,李晓凝,邱海霞,王爱国,张 舜
1华中科技大学同济医学院公共卫生学院劳动卫生与环境卫生学系,环境与健康教育部重点实验室,湖北 武汉 430030;2华中科技大学同济医学院附属同济医院临床营养科,湖北 武汉430030
多溴联苯醚(PBDEs)是一类溴代阻燃剂,因其良好的耐火性能被广泛应用于电子电器、建材、纺织品、家具等领域[1]。PBDEs难降解且缺乏化学键束缚,易蒸发、渗漏入环境,在环境介质如水、空气、土壤中广泛存在,并能随食物链蓄积于生物体内[2]。一般人群主要通过饮食和灰尘吸入暴露PBDEs[3];此外,婴幼儿还可通过胎盘转运、母乳喂养以及特有的手-口行为等途径额外暴露于PBDEs,致使其体内PBDEs负荷达成人的3~9倍之多[4]。由于婴幼儿期是大脑发育关键期,故PBDEs的发育神经毒性备受人们关注。2,2',4,4'-四溴联苯醚(PBDE-47)是人体内含量最多、毒性最强的PBDEs同系物之一[5]。队列研究与动物实验表明,孕前和/或孕期PBDE-47暴露可导致子代行为和认知功能异常[6,7]。机制研究进一步发现,PBDE-47引起的动物学习记忆损害等神经毒性表现与神经细胞异常自噬和凋亡密切相关[8]。然而,目前对于PBDE-47的神经毒性,尚缺乏有效的防治措施。因此,靶向异常自噬和凋亡对寻找针对性的药物可能具有重要的现实意义。
褪黑素(MT)是脑松果体在黑暗时分泌的昼夜节律调节激素,能控制体内内分泌腺活动[9]。目前,越来越多的研究关注褪黑素对神经细胞自噬与凋亡的调节作用[10,11]。研究显示,褪黑素可激活神经细胞自噬,抑制神经细胞凋亡[12],维持神经细胞自噬与凋亡间的内环境稳态,保护神经系统免受损伤[13]。然而,褪黑素能否通过同时调节自噬与凋亡以缓解PBDE-47所致的神经毒性,尚未见文献报道。本研究旨在探讨褪黑素对PBDE-47所致神经细胞异常自噬和凋亡的影响,观察其对PBDE-47致神经细胞毒性的保护作用,从而为PBDE-47神经毒性的预防与控制提供思路。
1 材料和方法
1.1 仪器与试剂
高分化PC12细胞购买自中国科学院上海细胞库,PBDE-47(纯度>99.99%,GC/MS 级,Accustandard),二甲基亚砜(DMSO)(Biofroxx),褪黑素(MCE),RPMI 1640 培养基(HyClone),胎牛血清、胰蛋白酶(Gibco),BCA蛋白浓度测定试剂盒、IP裂解液、PMSF(碧云天),Western blot相关仪器设备(Bio-Rad),PVDF膜(Millipore),自噬相关蛋白7(ATG7)抗体(abcam),自噬选择性底物p62/SQSTM1、微管相关蛋白1轻链3(LC3)抗体(Proteintech),含半胱氨酸的天冬氨酸-3(caspase-3)、多(ADP-核糖)聚合酶(PARP)抗体(CST),GAPDH抗体(Bioworld),HRP标记山羊抗兔、小鼠IgG抗体、细胞计数试剂盒(CCK8)(启动子),ECL增强型化学发光液(Pierce),Forma Series II水套式二氧化碳培养箱(Thermo),ELX-800 型多功能酶标仪(Bio-Tek),GeneGnome XRQ 荧光化学发光凝胶成像系统(Syngene),Eclipse Ti型激光共聚焦显微镜(尼康)。
1.2 试剂配制
1.2.1 PBDE-47工作液配制 准确称取1 mg PBDE-47粉末溶于50 μL DMSO溶液,制成PBDE-47储备液,浓度为40 mmol/L。临用前用培养基稀释为相应工作液浓度,室温保存备用。
1.2.2 褪黑素工作液配制 准确称取233 mg褪黑素粉末溶于1 mL DMSO溶液,制成1 mol/L褪黑素储备液,临用前用培养基稀释为25 μmol/L褪黑素工作液,-20 ℃避光保存备用。
1.3 细胞处理
选用发育神经毒性研究的体外细胞模型大鼠肾上腺嗜铬细胞瘤PC12细胞,将其培养于培养液(10%胎牛血清)中,并置于37 ℃、5%CO2培养箱,2 d/次传代。待细胞融合度达80%左右,弃培养液,按实验分组进行染毒干预处理。根据课题组前期CCK8实验结果,20 μmol/L PBDE-47溶液染毒PC12细胞活力显著下降且在70%以上[14],因此选择此染毒浓度用于本次实验。首先进行MT干预剂量摸索,参考文献报道[15]设置MT浓度梯度(12.5、25、50、100、200 μmol/L),并联合20 μmol/L PBDE-47处理,CCK8测定结果显示PBDE-47+25 μmol/L MT处理组可显著改善PBDE-47所致细胞活力下降且保持在80%以上,因此选择此浓度用于后续实验。实验分组如下:对照组(DMSO),20 μmol/L PBDE-47处理组,20 μmol/L PBDE-47+25 μmol/L MT处理组(预处理2 h后与PBDE-47共培养),25 μmol/L MT处理组。细胞处理24 h后收获。
1.4 Western blot实验
待细胞经上述1.3 处理培养后,用胰酶收集细胞,离心后弃去上清液,加入RIPA 裂解液和PMSF(RIPA∶PMSF=100∶1),冰上裂解30 min 后4 ℃离心(12 000 r/min,10 min),取上清液6 μL用磷酸盐缓冲液(PBS)稀释10倍,定量按BCA试剂盒说明书操作,吸取剩余蛋白上清液,根据定量结果将5×loading buffer与蛋白上清液按1∶4比例混合后煮沸(100 ℃,10 min),-20 ℃保存蛋白样品。上样时取20 μg蛋白样品在10%~15%SDS-聚丙烯酰胺凝胶上进行电泳,待蛋白质分子量标准充分分离时停止电泳,并湿转至PVDF膜,配制5%脱脂牛奶用于封闭(1.5 h),4 ℃一抗孵育过夜,次日1×TBST洗膜(3次×15 min),用HRP-耦合的二抗封闭液于室温孵育1 h,再次1×TBST洗膜(3次×15 min),用ECL显影液均匀淋洗PVDF膜后显影。将采集的图像用Quantity One软件分析灰度值。
1.5 CCK8细胞存活率实验
准备96 孔板,接种细胞(5×104/mL),设置空白组(Blank),对照组与实验处理组,其中Blank 组不接种细胞,只加培养基。实验孔外1周用PBS封闭,按1.3处理细胞,置于培养箱培养24 h。加入20 μL/孔CCK-8工作液(培养基:CCK8=1∶1),37 ℃避光温育1 h,用多功能酶标仪检测各孔吸光度A450nm,计算细胞存活率=(A实验处理组-A空白组)/(A对照组-A空白组)×100%。
1.6 细胞免疫荧光实验
载玻片用0.1 mg/mL多聚赖氨酸固定于六孔培养板,将细胞以1×105/mL种板并按1.3所述处理细胞,待处理培养结束,4%甲醛固定(30 min),PBS 清洗(3次×3 min),用PBS配制的0.5%Triton X-100于室温通透30 min,重复PBS清洗(3次×3 min),用PBS配制的10%山羊血清封闭液于室温封闭1 h,然后用山羊血清稀释的LC3一抗封闭液(1∶400)于4 ℃孵育过夜,次日弃去封闭液,PBS清洗(3次×3min)后加入Alexa Fluor 488绿色荧光标记山羊抗兔IgG(1∶250)于室温避光孵育1.5 h,再次PBS清洗(5次×3 min),滴加DAPI染液避光染色15 min,PBS清洗(5次×3 min),滴加荧光猝灭剂封片固定,激光共聚焦显微镜观察荧光图片。
1.7 统计学分析
所有数据用均数±标准差表示,将至少重复3次独立实验后得到的数据经SPSS 22.0统计分析,单因素方差分析(One Way ANOVA)和最小显著性差异法(LSD)进行多重比较,检验以P<0.05 为差异有统计学意义,GraphPad Prism 8.0制作统计条图。
2 结果
2.1 褪黑素对PBDE-47所致PC12细胞存活率降低的影响
与对照组相比,PBDE-47处理组PC12细胞存活率下降,差异有统计学意义(P=0.001);与PBDE-47处理组相比,PBDE-47+MT(12.5 μmol/L,25 μmol/L)处理组PC12细胞存活率上升(P值分别为0.044和0.023),差异有统计学意义,且PBDE-47+25 μmol/L MT处理组细胞存活率在80%以上(图1)。

图1 不同浓度褪黑素对PBDE-47处理的PC12细胞存活率改变的影响Fig.1 Effect of melatonin on survival rate of PC12 cells treated with PBDE-47.The cell survival rate was determined using CCK8 assay.*P<0.05 vs control;#P<0.05 vs PBDE-47.
2.2 褪黑素对PBDE-47所致PC12细胞自噬体蓄积的影响
与对照组相比,PBDE-47处理组PC12细胞LC3蛋白阳性着色增强;与PBDE-47处理组相比,PBDE-47+MT处理组PC12细胞LC3蛋白阳性着色减弱(图2)。

图2 褪黑素对PBDE-47处理的PC12细胞LC3蛋白阳性着色改变的影响Fig.2 Effect of melatonin on expression f LC3 protein in PC12 cells treated with PBDE-47 (immunofluorescence taining,scale bar=2 μm).Green:LC3-positive puncta;blue:DAPI staining.
2.3 褪黑素对PBDE-47所致PC12细胞自噬损伤的影响
与对照组相比,PBDE-47处理组PC12细胞ATG7蛋白水平下降(P<0.001),p62、LC3-II 蛋白水平上升(P<0.001),差异有统计学意义;与PBDE-47处理组相比,PBDE-47+MT处理组PC12细胞ATG7蛋白水平上升(P=0.034),p62蛋白水平下降(P=0.048),LC3-II蛋白水平下降(P=0.018),差异有统计学意义(图3)。
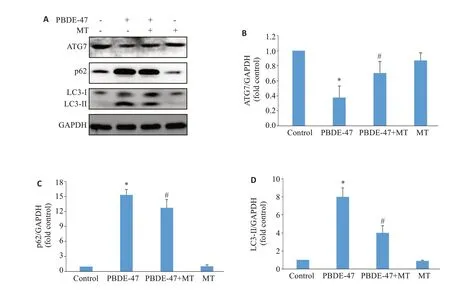
图3 褪黑素对PBDE-47处理的PC12细胞自噬相关蛋白水平改变的影响Fig.3 Effect of melatonin on autophagy-related protein levels in PC12 cells treated with PBDE-47.A:Representative Western blots of the autophagy-related proteins.B-D:Quantitative analysis of the expression levels of ATG7(B),p62(C)and LC3-II(D).*P<0.05 vs control;#P<0.05 vs PBDE-47.
2.4 褪黑素对PBDE-47所致PC12细胞凋亡的影响
与对照组相比,PBDE-47处理组PC12细胞凋亡相关蛋白active caspase-3 水平上升(P<0.001),cleaved PARP 水平上升(P<0.001),差异有统计学意义;与PBDE-47 处理组相比,PBDE-47+MT 处理组PC12 细胞活化型caspase-3(active caspase-3)蛋白水平下降(P<0.001),剪切型PARP(cleaved PARP)蛋白水平下降(P=0.032),差异有统计学意义(图4)。

图4 褪黑素对PBDE-47处理的PC12细胞凋亡相关蛋白水平改变的影响Fig.4 Effect of melatonin on apoptosis-related proteins levels in PC12 cells treated with PBDE-47.A:Representative Western blots of apoptosis-related proteins.B,D:Quantitative analysis of the expression levels of active caspase-3(B)and cleaved PARP(C).*P<0.05 vs control;#P<0.05 vs PBDE-47.
3 讨论
自噬是真核细胞内自我降解和循环利用胞内组分的过程[16]。ATG是调控自噬体起始的关键基因,主要由自噬体前体招募并参与形成杯状双层隔离膜,隔离膜进一步延伸扩展直至封闭形成自噬体[17]。在此期间,游离LC3-I经ATG7介导与磷脂酰乙醇胺结合形成复合物LC3-II,后者可作为反映自噬体水平的关键指标[18]。p62是重要的接头蛋白,参与自噬过程并作为自噬底物被降解[19]。我们的结果显示,PBDE-47可致PC12细胞ATG7蛋白水平降低,表明自噬体生成减少;但LC3-II和p62蛋白水平增加,且免疫荧光结果也显示LC3阳性荧光斑点聚集增加,表明自噬体降解受阻。这些结果提示PBDE-47能同时损伤自噬生成和降解两个环节导致PC12细胞自噬异常,与其它污染物仅影响其中一个环节的机制并不相同[8],显示出PBDE-47损伤神经细胞自噬的特异性。有趣的是,褪黑素干预后自噬相关蛋白ATG7水平升高,p62、LC3-II水平降低,LC3阳性着色减少,提示自噬体生成与降解异常朝正常水平恢复。研究表明,褪黑素可通过激活自噬延缓锰所致小鼠小胶质细胞毒性[20],以及过氧化氢诱导的海马神经元损伤[21]。与此类似的是,褪黑素可通过激活自噬以缓解大鼠脊髓损伤所致中枢神经系统功能障碍[22],提示激活自噬可能是褪黑素的神经保护机制之一。然而,我们的结果显示,褪黑素还能提高整体自噬活性,通过促进自噬生成和降解过程以改善PBDE-47所致PC12细胞异常自噬。这些结果表明,褪黑素能通过调节自噬水平以发挥神经保护作用。
凋亡是细胞为维持内环境稳定而自主程序性死亡的过程[23]。Caspase家族是介导细胞凋亡的关键蛋白酶,而caspase-3在细胞凋亡中的作用非常关键,可以通过剪切关键蛋白PARP,从而增高由PARP负调控的核酸内切酶活性,后者可使核小体间DNA裂解,从而诱导细胞凋亡[24]。因此活化的caspase-3和剪切的PARP可作为细胞凋亡的重要指标。本研究发现PBDE-47可增加PC12细胞凋亡相关蛋白active caspase-3和cleaved PARP的水平,与我们在动物水平观察到的结果一致[25],且与细胞存活率下降结果相符。更重要的是,褪黑素干预可降低凋亡相关蛋白水平,缓解PBDE-47所致过度凋亡,提高细胞存活率。与此类似的是,褪黑素可抑制丙戊酸诱导的人神经母细胞瘤SH-SY5Y细胞凋亡蛋白表达,从而抵抗细胞凋亡[26]。此外,妊娠期给予褪黑素可改善砷所致子代雄性大鼠脑组织细胞凋亡[27]。不仅如此,褪黑素还可通过抑制凋亡改善大鼠脑出血后脑水肿和行为障碍[28]。这些结果均提示褪黑素还可通过抑制凋亡以起到神经保护作用。但有趣的是,褪黑素对鱼藤酮诱导的小鼠脑神经母细胞瘤N2a细胞凋亡却无保护作用[29],表明褪黑素对于不同凋亡通路的作用可能具有选择性。研究显示,褪黑素可抑制大鼠垂体GH3细胞自噬以缓解环孢菌素A所致细胞死亡[30]。然而,褪黑素对PBDE-47致PC12细胞凋亡的抑制作用是直接的,还是间接通过调节自噬而实现,有待进一步研究。
综上所述,PBDE-47可致PC12细胞自噬障碍与过度凋亡,而褪黑素处理可缓解自噬体蓄积和自噬损伤,减少细胞凋亡水平,从而提高细胞存活。我们的结果为揭示褪黑素对PBDE-47神经毒性的保护作用和机制提供了参考依据。

