超高效液相测定茶树水杨酸含量方法的建立
陈蓉,黄小贞2,,赵德刚,3
(1.贵州大学生命科学学院/农业生物工程研究院/山地植物资源保护与种质创新省部共建教育部重点实验室,贵州 贵阳550025;2.贵州大学茶学院,贵州 贵阳550025;3.贵州省农业科学院/国家农业农村部DUS中心贵阳分中心,贵州 贵阳550006)
茶树[Camellia sinensis(L.)O.Kuntze]是山茶科山茶属植物,它是许多国家重要的木本经济作物,广泛分布于热带和亚热带国家[1]。水杨酸(salicylic acid,SA)是一种类似于植物酚类的激素,被认为是介导防御机制的信号分子,在植物抗病防御过程中起着十分重要的作用[2]。大量已有研究表明SA的合成代谢和信号转导参与了植物生长发育调控和胁迫应答反应[3,4]。另外,内源SA含量对茶叶特殊香气的形成以及病害响应有重要作用[5-7],因此,准确测定茶树中SA的含量具有重要意义。
目前检测水杨酸含量的方法有紫外分光光度法和酸碱滴定法[8]、反相高效液相色谱法[9]、分光光度法[10]和在线光纤传感同步吸收-荧光光谱法[11]等,其中高效液相色谱法(high-performance liquid chromatography,HPLC)广泛应用于化工、医学和法医药理学等领域[12]。其包括检测器、色谱柱、进样器、色谱泵及控制器、数据处理和控制仪器的配置[13],具有适用性比较广泛、分析速度很快、分离效率极高、检测灵敏及样品回收利用简单等特点[14],应用前景广泛。相较于传统的HPLC,超高效液相色谱法(ultra-efficient liquid chromatography,UPLC)具有分析速度更迅速、分离度更高和灵敏程度更强等优点[15]。目前未见报道使用UPLC方法检测茶树水杨酸的含量,而且提取茶树水杨酸的方法还未见报道,所以建立茶树水杨酸提取和UPLC的检测方法尤为必要。
本研究选用4个关键可控参数进行正交试验,分别为流动相配比、流速、进样量和柱温,建立UPLC检测水杨酸的体系,并通过方法学实验检验其可靠性,以期为茶树水杨酸的快速检测提供方法参考。
1 材料与方法
1.1 实验仪器材料
本实验使用的黔茶一号茶苗购自贵州省湄潭星兴茶叶专业合作社。
主要化学试剂:甲醇(TEDIA,色谱纯);甲醇(天津富宇,分析纯);磷酸(天津科密欧,色谱纯);乙酸(天津科密欧,色谱纯);水杨酸标准品(ACMEC,纯度≥98%);三氯乙酸(天津科密欧,分析纯);乙酸乙酯(天津富宇,分析纯);环己烷(天津致远,分析纯)。
主要实验操作仪器:UItiMate 3000超高效液相色谱仪(Thermo Scientific),Waters POSSIBLETMC18柱(4.6 mm 250 mm,5 um)。
1.2 试验方法
色谱条件:色谱柱;1%磷酸,1%乙酸-甲醇为流动相;检测波长276 nm。
样品处理:精确称取新鲜叶片组织1.000g、2.000g、3.000g,放入20℃的冰箱冷冻30 min,研磨成匀浆,分别加入20 mL、40 mL和60 mL 90%的甲醇,将其转移至3个干净的50 mL的离心管中,涡旋震荡1 min后,以10 000 r/min离心30 min,分别取其上清液,下层再加20mL、40mL和60mL纯甲醇,涡旋震荡1 min后,以10 000 r/min离心30 min,取上清液,合并上清液,用旋转蒸发仪干燥(水温40℃),分别用15 mL 5%的三氯乙酸溶解,再加入40 mL的乙酸乙酯和环己烷1:1混合物萃取。重复萃取一次,合并有机相,转移至旋转蒸发瓶中,旋转蒸发仪旋干(水温40℃)后,用10mL最佳溶剂定容,用0.45m微孔有机滤膜进行过滤,置于4℃保存。
最佳溶剂确定:分别用1%磷酸、1%乙酸、甲醇和无水乙醇作为溶剂,进行超高效液相。
标准品配制:精确称取水杨酸标准品20 mg(精确至0.000 1 g)溶于最佳溶剂中,置于50 mL容量瓶中,用最佳溶剂溶解并定容至刻度,摇匀。用0.45m微孔有机滤膜过滤,制成0.400 mg mL-1标准品溶液。
分别从标准品溶液取出1.0 mL、2.0 mL、4.0 mL、8.0 mL、16 mL、32 mL于50 mL容量瓶中,用最佳溶剂混匀并定容至刻度。以峰面积为横坐标,水杨酸浓度为纵坐标,建立线性回归方程。
正交试验因素水平:通过设计正交试验从而对茶树中水杨酸的检测方法进行优化,包括考察流速(A)、柱温(B)、1%磷酸、1%乙酸-甲醇溶液的配比(C)和进样量(D)对检测效果的影响,见表1。

表1 正交试验因素水平Table 1 The factor level of the the orthogonal test
加标回收试验:取同一样品3份,分别加入标准品溶液(终浓度分别为32g mL-1、64g mL-1、128g mL-1),在同一色谱条件下测定茶树水杨酸含量,每个条件重复3次。
加标回收率=[(加标后测得量-样品量)/加标量]100%。
重复性和精密度试验:在优化后的色谱条件下,取3份不同浓度标准品溶液,1份标准品溶液分为6份,分别测定茶树中水杨酸含量,计算6份样品之间的相对标准偏差(RSD)。
1.3 数据处理
本研究采用Microsoft Excel和SPSS Statistics 26.0对数据进行处理、分析及作图。
2 结果与分析
2.1 最佳溶剂的确定
无水乙醇和流动相1%磷酸、1%乙酸与水杨酸有相同保留时间,且水杨酸难溶于流动相1%磷酸、1%乙酸中,水杨酸在流动相甲醇中溶解性好且没有相同保留时间,故选择甲醇作为最佳溶剂。
2.2 正交试验设计与结果
根据正交试验设计表(表2)进行9组试验,每组重复3次,均进行标准品含量测定。
水杨酸的浓度设置为y轴,峰面积设置为x轴。根据表2内容,绘制9个不同处理组相应标准曲线,并通过数据求出标准曲线方程(表3)。结果表明,在9个不同检测条件下,水杨酸标准品在0.008~0.256 mg mL-1之间且R2在0.998 8~0.999 8之间浮动,浓度及峰面积均呈现出良好的线性相关关系。

表3 水杨酸标准曲线(n=9)Table 3 The standard curve of salicylic acid(n=9)
回收率方差和分离度方差分析结果(表4)表明,4因素对回收率影响均显著;除了D因素,其他3因素对分离度影响也显著。回收率极差(表2)大小为:C>A>D>B,RSD在0.20%~0.55%之间波动,分离度极差分析(表2)顺序为C>A>B>D,RSD在0.9%~1.24%之间波动,且均未超过2%。综合方差分析和极差分析来看,4因素中对分离度影响最大的为C,对回收率影响最大的为A。

表2 正交试验设计和结果(n=6)Table 2 The design and result of the orthogonal test(n=6)
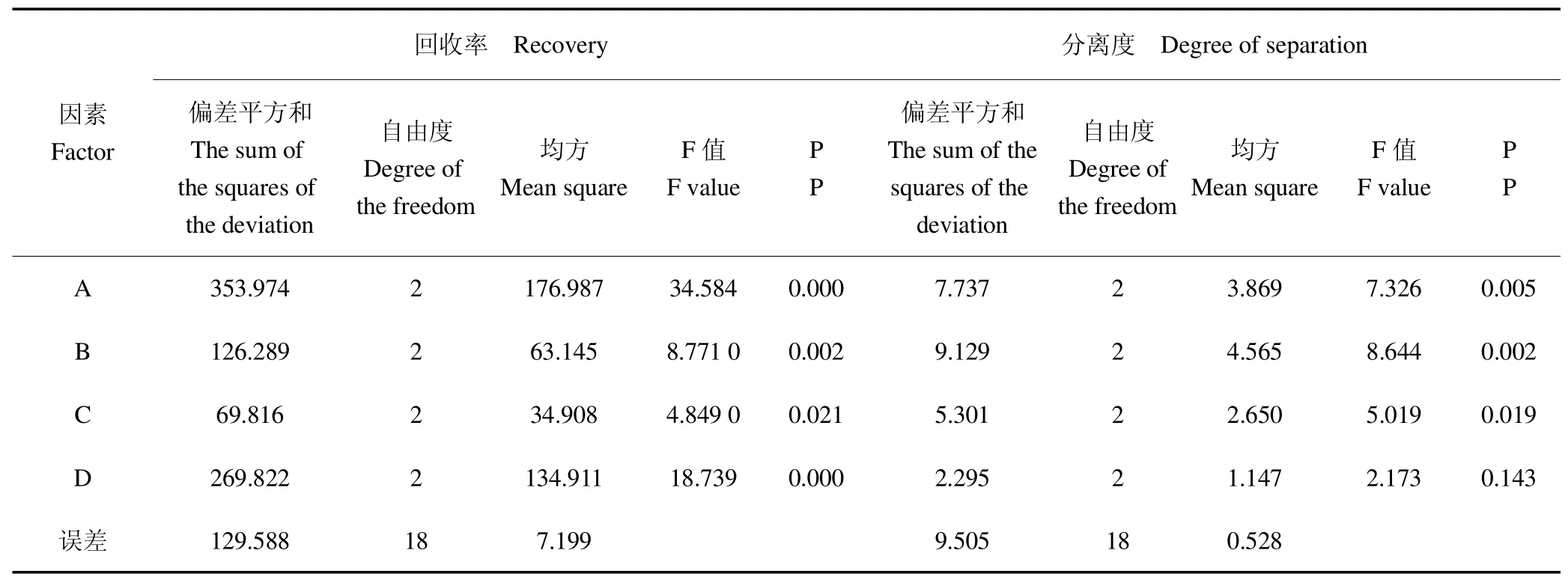
表4 方差分析Table 4 ANOVA analysis
综合回收率、分离度的极差分析与方差分析,4因素中对回收率和分离度的影响最大为C,最小是B。在4因素中选取最佳检测方法为A2B1C2D2,流速为0.8 mL min-1,柱温为30℃,进样量为3L,1%磷酸、1%乙酸水溶液-甲醇的比为30:70。
2.3 方法学检验
2.3.1 标准曲线与灵敏度 以最佳检测方法:流速设置为0.8mL min-1,柱温设置为30℃,进样量为3L,1%磷酸、1%乙酸水溶液-甲醇的配比为30:70。检测水杨酸标准品溶液,以峰面积为横坐标,水杨酸浓度为纵坐标作标准曲线图(图1)。曲线方程为y=0.062 9x-0.002 1,R2=0.999 8。表明水杨酸在0.008~0.256 mg mL-1的浓度范围内线性关系良好。

图1 优化条件下水杨酸浓度标准曲线Fig.1 The standard curve of salicylic acid concentration under the optimized conditions
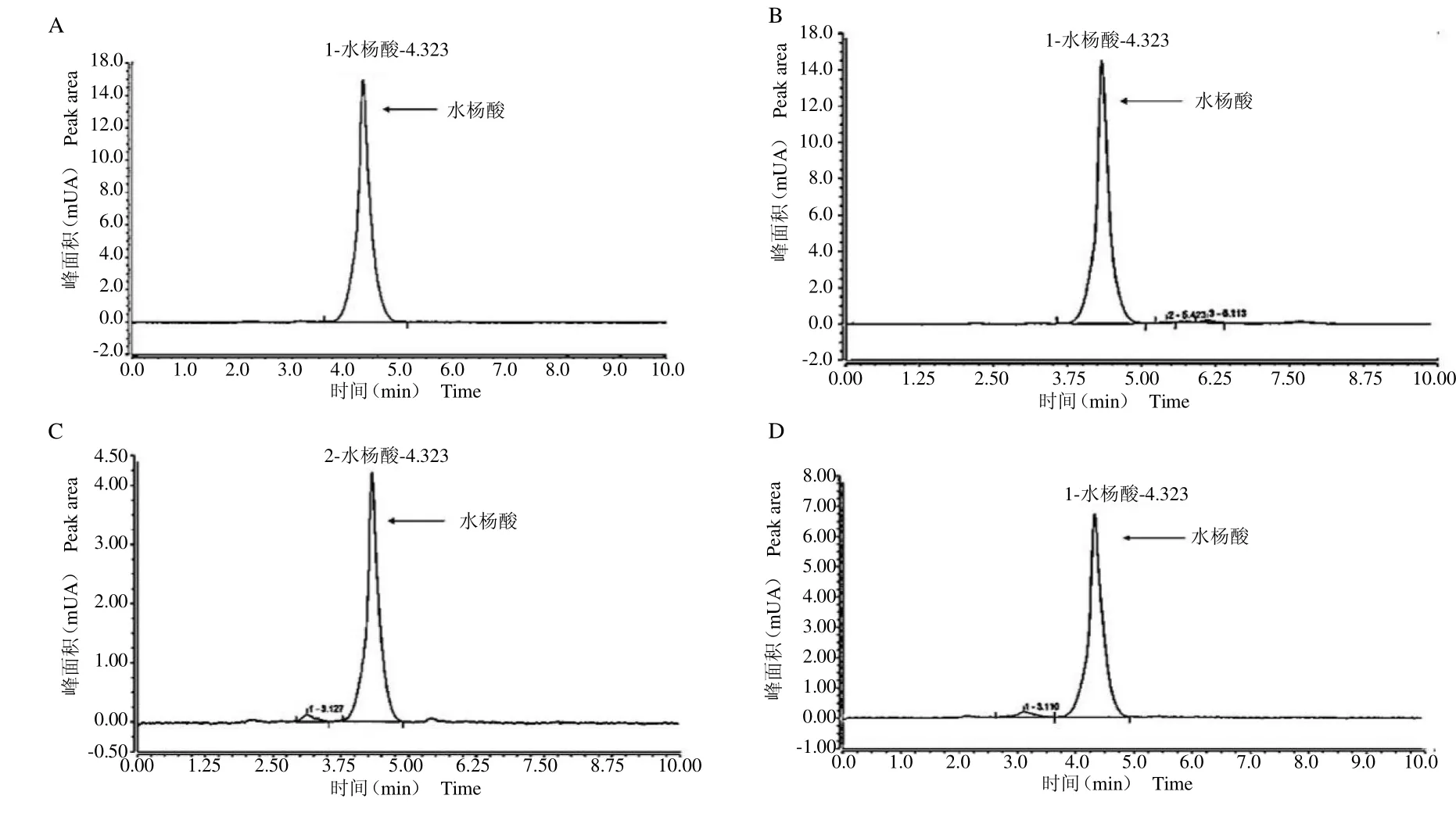
图2 标准品(A)和样品(B、C、D)色谱图Fig.2 The chromatograms of the standard(A)and spmples(B,C,D)
2.3.2加标回收率结果如表5所示,3浓度条件下加标样品的回收率均高于96%,RSD=1.04%,RSD低于2%,加标回收试验结果表明,此研究方法具有良好的回收率和准确度,符合检测的所需要求。
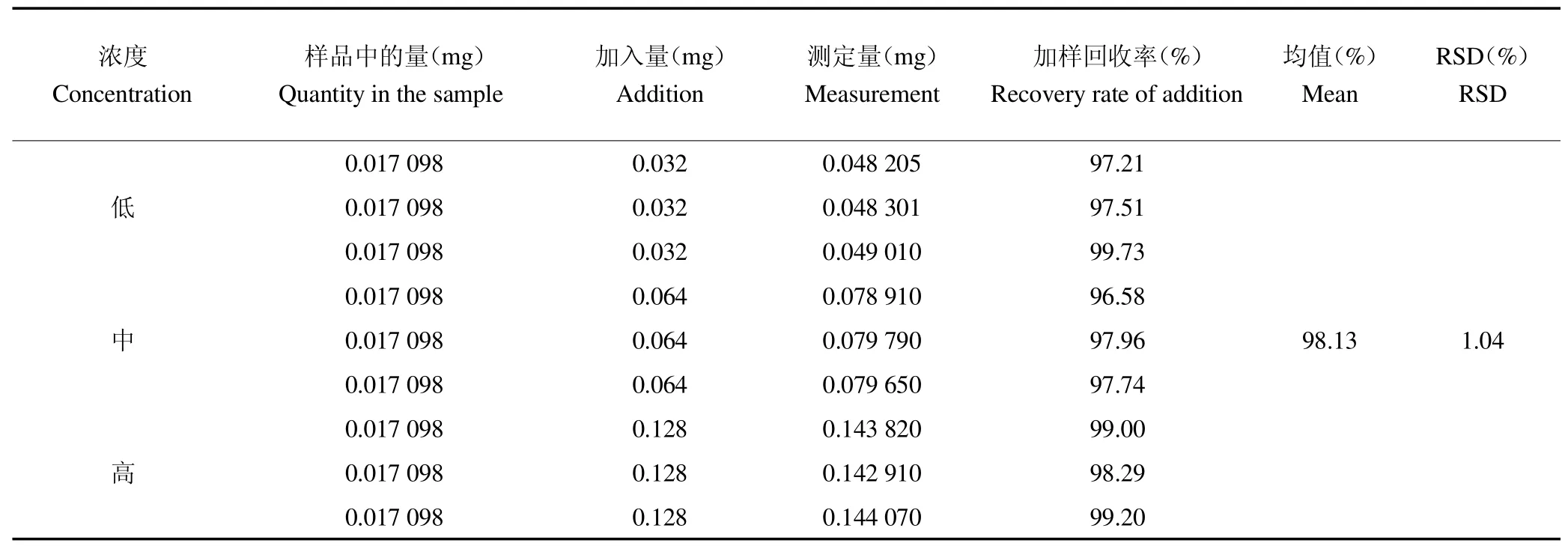
表5 回收率结果(n=9)Table 5 The results of the recovery rates(n=9)
2.3.3 精密度和重复性取3份不同浓度标准品溶液,1份标准品溶液分为6份,在优化条件下,分别测定后,计算6次进样的平均RSD,分别测得为0.23%、0.15%和0.11%(n=6),都低于2%,结果表明该方法精密度高,重复性良好,符合检测要求。
2.3.4 样品检测在优化后的色谱条件下,检测水杨酸出峰时间(即保留时间)为4.323 min,峰型良好,样品保留时间与标准品的保留时间一致,检测样品的浓度分别为0.038 mg g-1(图B)、0.024 mg g-1(图D)和0.013mg g-1(图C)。结果表明,检测提取的样品效果良好,并且出峰时间和标准品的显示一致,目标峰没有分叉和拖尾的现象,且分离度高,说明提取的茶树水杨酸可以被此检测方法分离出来。
3 讨论
水杨酸在植物中含量较少且提取过程易升华[16,17],因此,影响到分析结果最主要的因素是样品的提取[18,19]。赵伟伟、鲍峰伟等[20,21]检测蓬蘽悬钩子和烟草中水杨酸含量,采用高效液相色谱法对悬钩子和烟草中的水杨酸进行了甲醇直接萃取、三氯乙酸萃取、乙醚反萃取和三氯乙酸萃取,但是通过分析结果显示,使用甲醇提取的样品成分比较复杂,对水杨酸的测定干扰极大;三氯乙酸萃取样品的目标峰与杂峰不能完全分离。本试验参照杨国慧、王倩倩等[22,23]提取树莓叶片和果实中水杨酸的方法,利用有机溶剂甲醇粗提、乙酸乙酯和环己烷萃取的方法,液相分析结果表明,提取的茶树水杨酸峰形良好,杂峰比较少,但是提取的水杨酸溶液中掺杂有色素污染。与王倩倩[23]的报道相似。因此,色素的去除还有待于进一步研究,从而稳定水杨酸的检测方法。
在整个提取茶树水杨酸和检测含量过程中,水杨酸易分解的性质在一定程度上会给检测到的结果带来误差。本研究对提取茶树水杨酸和测定的过程中进行了优化,发现若在提取过程中操作迅速并且在避光状态下,可以有效减少水杨酸分解。提取的水杨酸避光并短时间保存于4℃效果最佳,检测过程中样品放置温度宜在4℃条件下;宜用HPLC或UPLC检测的物质沸点高、热稳定性差且具有生理活性以及相对分子质量较大[24]。本研究结果表明,UPLC的柱效较高,9个处理的回收率均不低于85%,在85.78%~98.91%之间波动,各组的RSD均小于2%。本研究探索出的UPLC检测方法,不但分离效果与回收率得到了保证,而且低流速流动相的使用和待测物的迅速出峰,最终达到了减少流动相的使用和缩短检测用时的目的[25]。
本研究通过优化色谱条件,发现此条件下检测茶树水杨酸样品的效果良好,具有出峰时间短、峰型良好且分离度高等优点,此UPLC检测方法可为茶树水杨酸的快速高效检测提供参考。

