人参皂苷Rg3诱导结直肠癌细胞凋亡作用研究
孙丹丹,邹宜芳,宋柳,杨浩,初迪,韩淑兰,刘昕,郭建锋
(吉林大学药学院,吉林 长春130021)
结直肠癌(colorectal cancer,CRC)是最常见的恶性肿瘤之一,已成为全球第四大致命癌症。据2018年全球癌症数据统计,新确诊CRC患者约180万人,且每年有近90万人死于该病,约占每年诊断出的癌症和癌症死亡数的10%[1,2]。目前,早期CRC治疗方法主要包括内窥镜或手术局部切除、局部消融治疗和姑息化疗等,晚期CRC治疗方法主要包括化疗和放射性治疗。但大剂量的化放疗产生不良反应和副作用,例如神经毒性和肝毒性[3-5],严重降低了患者的生活质量,因此,建立更安全、有效的CRC治疗方法已成为医药学界亟待解决的重点问题。
人参系五加科多年生草本植物人参(Panaxginseng)的根茎,在我国有着几千年的药用历史。人参皂苷是人参中主要的活性物质,其中人参皂苷Rg3和人参皂苷Rh2具有抑制多种癌细胞生长的作用[6,7]。近年来,大量的文献[8-11]显示人参皂苷Rg3在诱导肿瘤细胞凋亡、抑制肿瘤细胞侵袭和转移、逆转耐药、与化疗联合协同增效及提高机体免疫力等方面具有显著的作用。目前,已证实Rg3也可以抑制结肠癌细胞Caco-2的增殖和迁移,但其体外促进结直肠癌细胞凋亡机制还需进一步研究[12]。
为更好地研究Rg3的抗肿瘤效果,本文对其体外抗癌机制进行了研究。采用高效液相色谱法(High Performance Liquid Chromatography,HPLC)对Rg3单体进行含量测定,并利用流式细胞术法和蛋白质印迹法(Western Blot,WB)测定Rg3诱导结直肠癌CT26细胞凋亡,为建立新型结直肠癌免疫治疗提供科学依据。
1 仪器与试药
数显恒温水浴锅(常州国华电器有限公司);全自动雪花制冰机(常熟雪科电器有限公司);高速冷冻离心机(Eppendrof有限公司);低温离心机(湖南湘仪离心机仪器有限公司);电子分析天平(美国丹佛仪器公司);移液器(Thermo公司);超净工作台(北京东联哈尔仪器制造有限公司);倒置显微镜(Olympus公司);CO2培养箱(SANYO公司);化学发光凝胶成像仪(北京东胜创新科技有限公司);电热鼓风干燥箱(北京科伟永兴仪器有限公司);立式蒸汽压力灭菌锅(上海博讯实业有限公司);垂直电泳槽(上海天能科技有限公司);电泳仪(北京六一生物科技有限公司);迷你转印仪(杭州诺扬生物技术有限公司);多功能荧光酶标仪(美国Bio Tek公司);微孔板恒温振荡器(杭州奥盛仪器有限公司);流式细胞仪(美国BD公司);MYC-80上下摇跷跷板式振荡器(常州荣华仪器)。
RPMI 1640细胞培养基(美国Corning公司);0.25%胰酶-EDTA(美国Corning公司);FBS(以色列Biological Industries公司);青-链霉素双抗(以色列Biological Industries公司;台盼蓝(北京索莱宝科技有限公司);DMSO(天津百伦斯生物技术有限公司);PMSF(上海碧云天生物技术有限公司);RIPA细胞裂解液(上海碧云天生物技术有限公司);BCA工作液(北京全式金生物技术有限公司);5 Protein Loading Buffer(上海碧云天生物技术有限公司);牛血清白蛋白(上海碧云天生物技术有限公司);SDS-PAGE预制胶(上海碧云天生物技术有限公司);SDS(北京博奥拓达科技有限公司);甘氨酸(美国VWR生命科技公司);Tris(北京博奥拓达科技有限公司);吐温-20(北京博奥拓达科技有限公司);抗体Affinity(北京生物科技有限公司);ECL发光液(上海翊圣生物科技有限公司);Rg3(成都德斯生物技术有限公司);乙腈为色谱纯,其他试剂均为分析纯。
2 方法
2.1 色谱条件的确定与系统适用性试验
色谱柱为迪马C18色谱(4.6 mm 150 mm,5m);流动相为50%乙腈和50%超纯水(含0.05%磷酸);检测波长为203 nm;柱温为30℃;进样量为20L;流速为1.0 mL/min。理论塔板数按Rg3色谱峰计算,不得低于3 000。
2.2 MTT法
2.2.1 细胞培养小鼠结直肠癌CT26细胞属贴壁生长细胞,使用RPMI 1640完全培养基,内含1%的双抗和10%的FBS,在37℃、5%CO2和95%空气的无菌培养箱中进行常规培养。
2.2.2 细胞复苏在超净台中提前做好准备工作,取15 mL离心管,加入9 mL培养基备用,另取T25细胞培养瓶,加入5 mL完全培养基,准备完毕。将细胞从液氮中取出后,迅速在37℃恒温水浴锅中溶解,可适当轻轻摇动以加速溶解,完全溶解后,适当喷洒75%的酒精灭菌,快速移入超净台中,取出液体加入到事先准备好的离心管中,1 000 r/min离心5 min,离心后,弃上清液,加入适量完全培养基于离心管中,轻柔吹打重悬后,将重悬液吸出,全部加入到事先准备好的培养瓶中,轻柔摇晃使细胞在培养瓶中分布均匀,置于37℃培养箱中培养过夜,第2天观察细胞状态,若贴壁良好,弃掉旧培养基,无菌PBS清洗后,更换新培养基。
2.2.3 细胞传代在显微镜下观察细胞状态,若细胞长至70%~90%时对细胞进行传代。弃掉旧培养基,无菌PBS清洗后,加入适量含EDTA的胰酶进行消化,若细胞难消化可置于37℃培养箱中消化,显微镜下观察细胞状态,当细胞呈圆形、培养瓶底部呈现雾状时,加入适量完全培养基终止消化,用移液枪适当轻柔吹打培养瓶底部,尽量将全部细胞吹打下来,将培养瓶中的液体移到15 mL离心管中,1 000 r/min离心5 min,离心后,弃上清液,加入适量完全培养基于离心管中,轻柔吹打重悬后,吸取适量重悬液加入到含完全培养基的培养瓶中,轻柔摇晃使细胞在培养瓶中分布均匀,置于37℃培养箱中培养。
2.2.4 细胞冻存取对数生长期的细胞进行冻存。按照FBS:DMSO为9:1的比例配制细胞冻存液。弃掉旧培养基,PBS清洗后,加入适量含EDTA的胰酶进行消化,加入适量完全培养基终止消化,将培养瓶中的液体移到15 mL离心管中,1 000 r/min离心5 min,离心后,弃上清液,加入适量细胞冻存液重悬细胞,然后在冻存管中加入1 mL上述重悬液,封口膜封口。将冻存管放置在4℃冰箱30 min,﹣20℃冰箱2~4 h,﹣80℃冰箱中过夜,然后转移至液氮中长期保存。
2.2.5 IC50测定 取处于对数生长期的CT26细胞进行铺板,待细胞长至约70%时,胰酶消化,1 000 r/min离心5 min;PBS重悬细胞,使用台盼蓝进行计算细胞悬液浓度,按所得的结果将细胞悬液加入到96孔板中,5 000个/孔,在细胞培养箱中培养过夜,当96孔板内细胞密度为65%~75%时给药。将Rg3配制成一定浓度的母液,用完全培养基梯度稀释母液至设定的浓度。给药孵育24 h后,小心吸出孔内含药培养基,每孔更换100L基础培养基,然后每孔加入20L上述配制得到的MTT溶液,放置于细胞培养箱避光孵育4 h,孵育完成后,弃去孔内液体,每孔加入150L DMSO,放置于微孔板恒温振荡器中,37℃震荡孵育10 min,使孔内甲瓒充分溶解于DMSO中。使用酶标仪570 nm下检测各孔吸光度值,细胞存活率按照以下公式进行计算,并采用GraphPad Prism8.0软件计算IC50。
2.3 细胞凋亡测定
取2 mL对数生长期CT26细胞于6孔板中,每空细胞初始密度为2 105个,过夜,待细胞贴壁,长到60%左右进行给药。设置对照组以及给药6、12和24 h,给药浓度为2.2.5项中得到的IC50。弃掉孔中旧培养基,1 PBS轻柔洗一遍,使用不含EDTA的胰酶消化收集细胞(消化时间不宜过长,否则会影响细胞膜上PS与Annexin-V-FITC的结合;如果用含EDTA的胰酶消化,必须彻底清除EDTA:标记前用1 PBS或1 binding buffer洗涤,清除EDTA,以免残留的EDTA与Ca2+螯合影响Annexin-V的结合),室温2 000 r/min离心5 min收集细胞。1 PBS重悬,2 000 r/min离心5 min,弃上清液;加300L 1 binding buffer重悬细胞;加10L Annexin-V-FITC,涡旋混匀,避光常温孵育15 min;上流式细胞仪前5 min加10L PI;上流式细胞仪前补200L 1 binding buffer。
2.4 蛋白质印迹法
2.4.1 细胞铺板和给药消化细胞后使用台盼蓝计数,取10 cm2细胞培养皿,每皿加入2 106个细胞和10 mL培养基培养过夜,待细胞贴壁,长至60%左右进行给药。设置3个时间点6 h、12 h和24 h,给药浓度为2.2.5项中得到的IC50。
2.4.2 总蛋白提取 弃上清液,用无菌PBS清洗细胞3次;RIPA裂解液与PMSF按100:1混匀,使PMSF终浓度达到1 mmol/L,置于冰上待用;在培养皿中加入200L配制好的RIPA裂解液,用细胞刮刀使RIPA裂解液与细胞充分接触裂解;吸取裂解后的液体至1.5mL EP管中,14 000 g、4℃离心5 min,小心吸取上清液至新的EP管中,于﹣80℃冰箱保存。
2.4.3 BCA法测定蛋白浓度 按照BCA说明书,将试剂盒中的Solution A和Solution B以50:1的比例混合均匀,配制成BCA工作液;BSA Protein Standard母液为2 mg/mL,用蒸馏水稀释成不同浓度的液体,用于绘制标准曲线;向96孔板中加入20L上述不同浓度的BSA标准蛋白、待测样品和空白对照(n=3),每孔再分别加入200L BCA工作液,37℃恒温振荡,孵育30 min;待冷却至室温后,用多功能酶标仪检测562 nm处的吸光值。根据设置的标准蛋白浓度绘制标准曲线,并计算待测蛋白样品浓度;根据计算得到的样品浓度,将同组样品稀释成同一浓度,以方便后续试验。
2.4.4 电泳将蛋白样品和5 Loading buffer按照4:1的体积比混合均匀,95℃水浴煮沸10 min,使蛋白变性;将预制胶胶板安装到电泳槽中,加入1电泳缓冲溶液,拔出梳子,按照预先设计好的方式,在各孔中分别加入蛋白marker或蛋白样品。初始电压100 V,待样品到达分离胶后,将电压调整为130 V。
2.4.5 转膜将配制的1电转缓冲溶液在冰上预冷;裁剪一定规格和数量的滤纸备用;将PVDF膜提前5min浸泡在甲醇中激活;根据所检测蛋白的分子量,切取对应位置的凝胶;在转膜阴极板上依次铺海绵、3层滤纸、凝胶和PVDF膜,使用滚胶棒缓缓排除凝胶和PVDF膜之间的气泡,使二者紧密贴合;再依次盖上3层滤纸、海绵,夹紧夹板,放置在电转槽中,加满预冷的1电转缓冲溶液,恒流湿转,200 mA恒流,电压调至最大,转膜90 min,注意整个转膜过程在冰上进行。转膜后,将PVDF膜转移至5%BSA封闭液中,放置在翘板摇床上,轻微晃荡孵育3 h。
2.4.6 孵育抗体封闭后,将一抗按照推荐比例用封闭液稀释,分别加入到对应的PVDF膜上,4℃孵育过夜;吸出一抗稀释液,用TBST洗膜5次,每次5 min;将二抗按照推荐比例稀释后,加入到PVDF膜上,室温条件下,避光孵育1 h,TBST洗膜5次,每次5 min。
2.4.7 显影按照ECL显影试剂盒说明,将A液和B液按照1:1混合均匀,避光;将PVDF膜浸入ECL工作液中,孵育1 min;使用化学发光凝胶成像仪扫描成像,使用Image J软件计算各组蛋白条带灰度值,计算相对表达量。
2.5 统计分析
本实验采用Graphpad Prism 8.0软件进行数据处理和相关统计学分析。
3 结果
3.1 液相条件确定
阴性样品、对照品溶液色谱图见图1 A。在与对照品峰相应的保留时间位置无干扰峰检出,即阴性无干扰。由图1 B可见,供试品溶液在色谱图相应的位置上有相同保留时间的色谱峰,而阴性对照溶液在此无峰,各主成分峰与其他组分分离良好,说明阴性样品对Rg3含量测定无干扰。
3.2 体外抑瘤效果
随着Rg3浓度增加对CT26细胞毒性增强,可知,Rg3对CT26细胞具有抑制作用。如图2,当Rg3浓度增加至12.5g/mL时,对CT26细胞开始出现毒性作用;随着浓度增至100g/mL时,CT26细胞存活率仅为(10.2±1.43)%,证明Rg3对CT26细胞有明显的抑制作用,且随给药浓度升高,细胞存活率逐渐下降。通过Graphpad Prism 8.0软件对实验结果进行处理,计算各细胞半数抑制最大浓度(median inhibition concentration,IC50),结果所得Rg3对CT26细胞的IC50值为(27.36±8.75)g/mL。
3.3 细胞凋亡
3.3.1 促进细胞凋亡 结果如图3和图4所示,细胞凋亡率与给药时间呈正相关。在给药6 h后开始出现凋亡现象,但与对照组相比差异不大;在给药12 h后凋亡细胞显著增加(P<0.01),且在给药12 h到24 h之间凋亡细胞持续增多,尤其是CT26凋亡细胞数量由12 h的30%左右增加至24 h的80%。

图3 流式细胞仪检测分析Rg3处理CT26细胞后6 h、12 h、24 h细胞凋亡水平Fig.3 The apoptosis level of CT26 cell after treated with Rg3 determined for 6 h,12 h and 24 h by the flow cytometry

图4 流式细胞仪检测分析Rg3处理CT26细胞后6 h、12 h、24 h细胞凋亡水平量化图Fig.4 The apoptosis of CT26 cell treated with Rg3 determined for 6 h,12 h and 24 h by the flow cytometry
3.3.2 抑制细胞凋亡如图5,实验已证明Rg3能够活化多种Caspase蛋白从而诱导凋亡,因此通过抑制Caspase家族蛋白,可以间接证明Rg3对CRC细胞的抑制作用是通过凋亡引起的[13]。Z-VAD-FMK是Caspase家族蛋白抑制剂,能够不可逆地抑制Caspase蛋白活性。实验设计对照组和实验组,其中Z-VAD-FMK和Rg3联合给药组,需在给药前用Z-VAD-FMK预孵育4 h。如图5所示,与对照组相比,Z-VAD-FMK组未出现显著性差异(P>0.05);而在相同给药浓度的两组中,使用Z-VAD-FMK预孵育的细胞存活率有所增加(P<0.05),说明封闭Caspase家族蛋白活性可减少细胞的凋亡死亡数量,侧面证明了Rg3可以通过凋亡的方式抑制肿瘤细胞生长,但是考虑到Z-VADFMK并未完全逆转细胞的死亡趋势,推测Rg3并非仅通过凋亡的方式引起细胞死亡。

图5 MTT法检测分析Z-VAD-FMK对Rg3处理CT26细胞毒性的影响Fig.5 The effect of Z-VAD-FMK on the toxicity of CT26(A)cells treated with Rg3 was analyzed by MTT assay
3.4 蛋白免疫印迹
如图6和表1所示,活化的c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK激酶)即P-JNK(46+54 kDa)表达较对照组显著增加(P<0.001,P<0.01)。JNK激酶可激活内质网基膜上的促凋亡因子BAX构象改变而活化,并弱化BCL-2的抗凋亡能力,这与实验结果相一致;BAX(21 kDa)在CT26结直肠癌细胞系中表达显著增加(P<0.01,P<0.01),而BCL-2(26 kDa)呈现完全相反的趋势(P<0.001,P<0.01),这也暗示着Rg3在激活内质网应激的同时,能进一步诱导结直肠癌细胞凋亡。
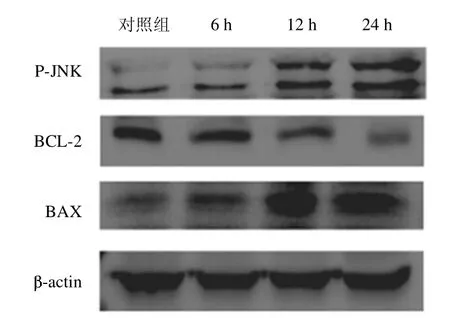
图6 WB法检测CT26细胞中细胞凋亡相关蛋白(BCL-2、BAX)表达情况Fig.6 The expression of apoptosis related proteins(BCL-2,BAX)in CT26 cells was detected by WB

表1 CT26细胞内凋亡通路蛋白(BCL-2,BAX)相对表达量Table 1 The relative expression of apoptosis pathway protein(BCL-2,BAX)in CT26 cells
4 讨论
CRC的治疗现状并不理想,传统的手术治疗仅适用于癌症早期,且会严重降低患者的生活质量,因此,建立更安全、有效的CRC治疗方法已成为医药学界亟待解决的重点问题[14]。
研究表明,人参皂苷Rg3在一定浓度范围内可以明显促进乳腺癌MDA-MB-231细胞的凋亡,这可能与人参皂苷Rg3通过干扰乳腺癌MDA-MB-231细胞中的MGBA基因的表达,从而影响H2S/CSE系统的活性得以实现[15]。Rg3诱导肿瘤细胞凋亡的机制研究表明,Rg3通过SP1升高和HSF1下调抑制了FUT4的表达,说明人参皂苷Rg3对胃癌患者具有有效的治疗作用[16]。由上可知,Rg3具有体外抑制肿瘤生长的作用,且机制各不相同。人参皂苷Rg3还可抑制人结肠癌细胞株SW480细胞的增殖,促进其凋亡,机制可能与抑制细胞间黏附分子1的表达,活化闭锁蛋白的表达有关[17]。但其对凋亡相关蛋白没做进一步研究,因此,我们进一步探讨了Rg3诱导结直肠癌凋亡作用,初步研究了其下游诱导凋亡相关蛋白的机制。
随着Rg3浓度增加,对CT26细胞出现明显的抑制作用,同时Rg3可促进CT26细胞凋亡相关蛋白的活化,诱导细胞凋亡,然而Caspase抑制剂可阻断Rg3诱导CT26细胞的凋亡,进一步证明Rg3通过诱导细胞凋亡杀伤CT26细胞。本文为人参皂苷研究和抗肿瘤药物开发提供依据,也为CRC的免疫治疗提供了思路和方法。

