Toll样受体及细胞因子表达水平与肠道病毒感染患儿临床表型的相关性分析
杨颖 周映儿 崔芬芬 陈燕 杨爱平
人肠道病毒(HEV)为单股正链RNA病毒,属小RNA病毒科,肠道病毒属,抗原具有高度多样性,患儿感染后临床表型多样化[1],首诊常见急性上呼吸道感染、手足口病、疱疹性咽颊炎、口腔炎、支气管肺炎、急性扁桃体炎、急性咽峡炎、高热惊厥等症状,严重者可出现无菌性脑炎、急性弛缓性麻痹、无菌性脑膜炎等中枢神经症状,甚至死亡[2-3]。HEV感染后患儿多样化的临床症状与个体的遗传多样性有关[4-5],宿主固有免疫在抗病毒感染的过程中起着至关重要的作用。机体固有免疫系统通过模式识别受体(PRR)可快速识别病原微生物相关分子而触发免疫反应,构成机体免疫系统抗感染的第一道防线,并进一步诱导产生适应性免疫[6-7]。Toll样受体(TLR)为宿主细胞识别病毒的PRR,其单核苷酸多态性与多种病毒的感染及预后相关,TLR7为识别HIV病毒、丙肝病毒感染的主要PRR[8],但TLR7基因多态性与肠道病毒感染的相关性尚不清楚。本研究旨在探讨TLR7基因rs3853839位点单核苷酸多态性、细胞因子水平与儿童肠道病毒感染后不同临床表型的相关性。
1 资料与方法
1.1 临床资料 收集2015年1月至2018年12月浙江萧山医院医共体儿童门诊及住院部的肠道病毒感染患儿200例,所有患儿咽拭子均采用通用引物检测试剂盒(湖南圣湘)检测验证。另选取同期浙江萧山医院医共体总院儿保科门诊体检儿童100例作为对照。肠道病毒感染患儿组,男103例、女97例,年龄(26.4±9.2)个月;对照组,男50例、女50例,年龄(25.6±8.3)个月。两组研究对象的年龄、性别比较,差异无统计学意义(P>0.05)。根据《手足口病诊疗指南(2013 年版)》[4]的诊断标准将手足口病患儿分为轻症组和重症组,轻症仅有发热伴手、足、口、臀部皮疹表现;重症组在轻症组临床表现的基础上合并出现肺水肿、肺出血、脑膜炎、脑炎、脊髓炎、脑脊髓炎、心力衰竭等其中至少1项并发症。本研究经浙江萧山医院医共体总院医学伦理委员会批准,所有患者法定监护人均签署知情同意书。
1.2 研究方法 (1)肠道病毒分子诊断:参照湖南圣湘(批号:2019007)试剂盒说明书提取和扩增肠道病毒HEV、CA-71、CA-16,根据试剂盒说明书提供的扩增程序用ABI7500进行定性检测。(2)肠道病毒 RNA提取及逆转录:参照Qiagen 公司(货号:DP419)提取病毒RNA,Takara逆转录试剂盒(货号:RR037A)说明书配制反应体系及扩增程序。(3)肠道病毒分型检测:病毒核酸检测阳性的标本根据文献合成测序引物,扩增产物送至上海生工生物工程公司进行测序,将测序结果在NCBI网站上进行BLAST比对,并与Genebank数据库中的序列进行比对分析,得出肠道病毒的分型结果。(4)基因组DNA提取:Ficoll密度梯度分离外周静脉血PBMC,用包含10%二甲基亚枫(DMSO)的胎牛血清重悬后液氮保存;参照ThermoFisher公司(货号:10503027)试剂盒说明书提取PBMC中人基因组,测定浓度后分装,-80 ℃保存备用。(5)SNP位点筛选:从美国国立生物技术信息中心(NCBI)数据库和HapMap数据库中筛选汉族人群TLR7基因相关SNP,所选SNP最小基因频率(MAF)>0.05、遗传平衡(Hardy-Weinberg)检验(P>0.05)、基因分型成功率>90%,rs3853839作为本研究的检测位点。(6)TLR7的SNP分析:用TaqMan探针实时荧光PCR对2个SNP进行基因分型,所用引物和探针序列见表1,荧光定量PCR参照试剂盒(美国ThermoFisher公司)操作说明配制反应体系及扩增程序,每个反应设3个复孔。(7)淋巴细胞及细胞因子检测:参照BD FACSCantoⅡ流式细胞仪及试剂说明书分离检测全血淋巴细胞五项细胞因子。
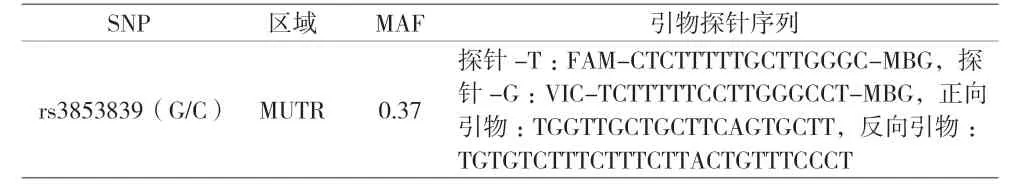
表1 SNP信息及其引物和探针序列
1.3 统计学方法 采用SPSS17.0统计软件。采用Hardy-Weinberg平衡检验TLR7基因SNP位点的分布情况,非条件Logistic回归分析SNP基因型与EV71感染之间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 Hardy-Weinberg遗传平衡检验 TLR7基因rsl79019与rs3853839两位点基因型在肠道病毒感染组和健康对照组的分布处于遗传平衡状态。
2.2 主要感染型别及临床表现 肠道病毒测序分析分型结果,EV71型17例(8.5%)、CoxA16型35例(17.5%)、CoxA6型57例(28.5%)、CoxA10型44例(22.0%),其他肠道病毒型47例(23.5%);肠道病毒感染的主要临床表现为上呼吸道感染、手足口病及疱疹性咽峡炎、支气管肺炎;脑炎/无菌性脑膜炎组主要见于EV71感染(P<0.05)。
2.3 肠道病毒感染患儿外周血T淋巴细胞亚群的变化 相较于轻症组,重症组患儿CD4+、CD3+淋巴细胞及NK细胞数量出现明显下降,差异有统计学意义(P<0.05);B淋巴细胞数量组间比较,差异无统计学意义(P>0.05)。见图1。

图1 三组淋巴细胞检测结果
2.4 肠道病毒感染患儿的外周血细胞因子水平 肠道病毒感染重症组患儿血清中IL-10、IL-6、IFN-γ水平显著高于轻症组,差异有统计学意义(P<0.05);重症组与轻症组的血清TNF、IL-2、IL-4表达水平无显著性差异。见图2。

图2 轻症组与重症组肠道病毒感染患儿细胞因子水平检测结果
2.5 TLR7基因rs3853839位点SNP与患儿不同临床表型分布 脑炎/无菌性脑膜炎重症组女性rs3853839基因型GC和CC的频率明显高于轻症组(手足口病、疱疹性咽颊炎、上呼吸道感染、支气管肺炎)(χ2=5.438、5.762、7.094、6.116,P<0.05),见表2。感染EV71患者组TLR7基因rs3853839位点C基因型的频率明显高于其它确诊型别组(CoxA6、CoxA10、CoxA16)(χ2=3.82、4.036、5.879,P<0.05),见表3。

表2 肠道病毒感染患儿不同首诊临床表型与健康对照组rs3853839基因SNP基因型分布[n(%)]
2.6 TLR7基因rs3853839位点SNP与不同肠道病毒型别 女性EV71感染者rs3853839基因型GC和CC的频率明显高于CoxA6、CoxA10、CoxA16(χ2=3.962、3.938、6.517,P<0.05);男性EV71感染患者rs3853839基因型CC和GG的频率与CoxA6、CoxA10、CoxA16比较,差异无统计学意义(χ2=0.816、0.814、1.461,P=0.366、0.367、0.227)。见表3。
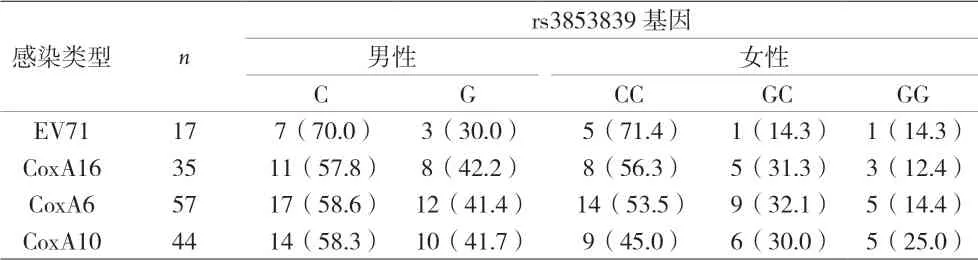
表3 肠道感染患者不同型别与TLR7基因rs3853839位点SNP分布[n(%)]
3 讨论
肠道病毒引发的疾病谱较广,临床症状多样化,同一型别肠道病毒可能导致不同的临床表现,不同型别肠道病毒感染亦可导致相似的临床表现。国内外均有报道指出,不同基因型别的肠道病毒感染与患儿差异化临床表现具有一定的相关性[9-10]。研究显示,引起我区夏季儿童急性呼吸道感染的主要病毒类型HEV为CoxA6,其次是CoxA10,这两型优势HEV感染的主要临床表现除呼吸道感染外,还包括疱疹性咽炎、手足口病,与国内其他学者的报道存在一定差异。深圳地区引起儿童夏季呼吸道感染的优势HEV主要是CoxA6,其次是CoxA16;上海市主要是CoxA2、CoxA5和CoxB5,上海市松江地区主要是CoxB3,其次是CoxA4;浙江省湖州地区主要是CoxA6,其次是CoxA2[11-13]。由此可见,不同地区优势CoxA血清型存在较大差异,提示肠道病毒的流行型别有明显地区差异。另外,周俊等[14]于2014年研究揭示杭州地区EV71、CoxA16病毒感染的阳性率依次为39.5%、10.2%,与本研究存在一定差异,提示同一地区肠道病毒流行型别可能随时间变迁而不同。
CD4/CD8的比值可反应辅助性T细胞与抑制性T细胞之间的平衡,机体健康状况下两者互相制约从而保持平衡[15]。本研究中肠道病毒感染患儿外周血CD3+、CD4+、CD8+T淋巴细胞数量及CD4/CD8的比值均显著降低,提示肠道病毒感染后机体存在细胞免疫功能的紊乱。此外,IL-10、IFN-γ等细胞因子水平在肠道病毒感染重症患儿急性期明显升高,经治疗后恢复期的细胞因子水平也随之下降。IL-10、IFN-γ在重症肠道病毒的呼吸道感染及病情进展中起着重要作用,其异常增高可以预测感染所致临床症状的重症化倾向,可用于帮助干预重症患者的治疗,作为监测病毒感染的严重程度一项指标。
因为病毒感染引发的人体免疫反应主要依赖于淋巴细胞,TLR7识别并结合HEV基因组RNA后,激活信号级联反应、启动固有免疫起到抗病毒感染作用[13]。研究表明,rs3853839等位基因G在女性HCV持续感染者中为保护性因素,于男性感染者并无上述作用,性别差异可能与雌雄激素参与女性固有免疫和适应性免疫有关[16]。TLR7位于X染色,按性别进一步分析显示女性EV71感染者rs3853839基因型GC和CC的频率明显高于CA6、CA10、CA16(P<0.05),男性则无上述结果,此种性别差异可能与雌激素介导的女性固有免疫和适应性免疫有关[17]。
本研究尚存在以下几点不足:病例资料仅来源于杭州市萧山区,可能不具有广泛代表性;实验组准入无统一标准,HEV阳性患儿可能无法排除合并实验室检查外的其它病毒感染;其它HEV型别与男女阳性率存在差异;有待后续研究进一步完善。此外,新型肠道病毒所致的呼吸道感染也值得儿科医生重视。

