薏苡糠壳的化学成分及其种子萌发活性研究
魏艳梅, 周丽琬, 陈惠琴, 杨理, 杨小雨, 刘凡值, 梅文莉,徐幸莲, 戴好富*
薏苡糠壳的化学成分及其种子萌发活性研究
魏艳梅1,2*, 周丽琬1,2,3*, 陈惠琴1,2, 杨理1,2, 杨小雨4, 刘凡值4, 梅文莉1,2,徐幸莲3, 戴好富1,2**
(1.中国热带农业科学院热带生物技术研究所, 海南省黎药资源天然产物研究与利用重点实验室, 海口 571101; 2. 中国热带农业科学院海南热带农业资源研究院, 海口 571101; 3. 南京农业大学食品科技学院, 南京 210095; 4. 贵州省农业科学院亚热带作物研究所, 贵州 兴义 562400)
为了解薏苡()糠壳的化学成分,利用多种柱色谱技术对其乙醇提取物乙酸乙酯萃取部位进行分离,经波谱数据分析鉴定了15个化合物,分别为香豆酸 (1)、香豆酸甲酯 (2)、2-羟乙基-香豆酸酯 (3)、咖啡酸甲酯 (4)、阿魏酸甲酯 (5)、()-3-(4-甲氧基苯基)丙烯酸 (6)、2,3-二羟基-1-(4-羟基-3-甲氧基苯基)-1-丙酮 (7)、2,3-二羟基-1-(4-羟基-3,5-二甲氧基苯基)-1-丙酮 (8)、对羟基苯甲酸 (9)、3-羟基-4-甲氧基苯甲酸 (10)、1,3,5-三甲氧基苯 (11)、methyl (3-hydroxy-2-oxo-2, 3-dihydroindol-3-yl)-acetate (12)、尿囊素 (13)、2-(2-羟乙基)-3-甲基反丁烯二酸 (14)和油酸 (15),其中化合物3、7、12、13和14为首次从薏苡中分离得到。活性测试结果表明,化合物1、2、9、10和11对种子萌发具有较强的抑制作用。
薏苡;化学成分;酚类;种子萌发
薏苡()为禾本科(Gramineae)薏苡属植物, 原产于东南亚地区,其资源丰富,种植面积广,至今已有数千年的种植历史[1]。在我国,除青海、甘肃、宁夏回族自治区尚未见报道外,全国各省区均有薏苡种植,其主要产区为贵州、辽宁、广西等地。现代药理研究表明,薏苡仁有抗炎、抗病毒、抗过敏、抗氧化等活性[2]。2020年版《中国药典》记载,薏苡仁有利湿健脾、舒筋除痹、清热排脓的功效;薏苡根同薏苡仁相似,同样具有利湿健脾、清热的功效,除此之外还有杀虫的功效;薏苡叶有温中散寒、补益气血的功效[3]。因其丰富的营养价值,薏苡享有“世界禾本科植物之王”的美誉[4]。
薏苡作为一种药食同源的农作物,在我国的产量巨大,其中贵州已成为全国及周边国家最大的薏苡仁加工集聚地和产品集散地[5]。数据显示,在薏苡植株的构成中,薏苡非种仁部位, 如糠、壳、根、茎、叶等占约86.1%。糠、壳分别为薏苡仁的浮粉层和外壳,是薏苡仁加工过程中的副产物,产量巨大,据报道,糠壳中富含脂肪酸类、酚酸类、黄酮类化合物,但目前仅用作饲料,不仅降低了薏苡植株的利用率,还造成极大田间资源的浪费[6]。近年来,农产品副产物的再利用关注度逐渐提高,薏苡糠壳的开发利用价值越来越受到重视。
为了探究薏苡糠壳中的化学成分,本课题对薏苡糠壳乙醇提取物的乙酸乙酯萃取部分进行了化学成分分离,共鉴定了15个单体化合物(图1)。对部分单体化合物进行了种子萌发抑制活性测试,为薏苡糠壳的化学成分研究和进一步开发利用提供了科学依据。
1 材料和方法
1.1 材料
糠壳于2019年3月收集于贵州省兴仁市潘家庄试验基地,经贵州省农业科学院亚热带作物研究所的刘凡值研究员鉴定为禾本科薏苡属薏苡()的糠、壳。
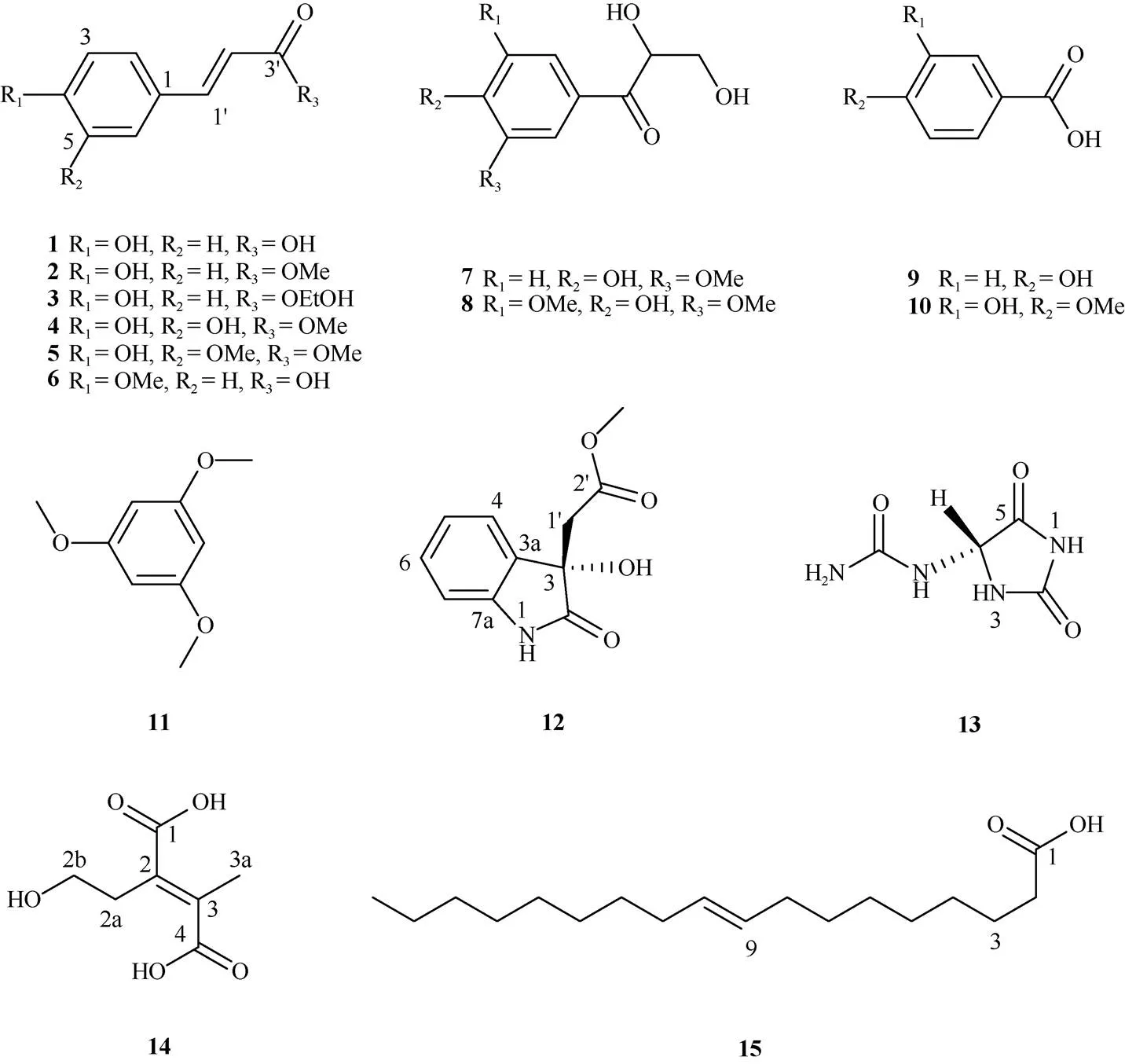
图1 化合物1~15 的结构
1.2 仪器和试剂
Bruker AV-500型超导核磁共振波谱仪(德国Bruker);Autospec300质谱仪(Bruker amaZon SL); AS 220.R2万分之一电子秤(RADWAG Wagi Elektro- niczne);Sephadex LH-20 凝胶(Merck Co. Ltd);C18反相硅胶(Fuji Silysia Chemical Ltd);柱层析硅胶(60~80、200~300目)和薄层层析硅胶板(青岛海洋化工厂);MCI GEL CHP20P (75~150m)(三菱化学);萝卜籽、草甘膦(浙江新安化工)均购自农资店;氘代试剂(Merck Co. Ltd.)、色谱甲醇(天津康科德);95%乙醇(天津福晨)、丙酮(西陇科学)、常用有机试剂甲醇、乙酸乙酯、氯仿、石油醚(广州光华)。
1.3 提取和分离
将11.0 kg薏苡糠壳用工业乙醇(1/3,/)常温浸提3次,每次浸泡7 d,收集滤液并浓缩得到相应的乙醇提取物842.8 g,然后分别用石油醚、乙酸乙酯、正丁醇按体积比1∶1依次萃取3次,得到石油醚部分422.2 g、乙酸乙酯部分22.0 g、正丁醇部分68.8 g和水提物319.0 g。
将乙酸乙酯相(22.0 g)用60~80目硅胶(15.0 g)拌样,经过减压柱色谱,以氯仿-甲醇(100∶1~1∶1)梯度洗脱,得到8个组份(Fr.1~Fr.8)。Fr.3组份(2.2 g)经Sephadex LH-20凝胶柱(甲醇为流动相)分离得到8个组份(Fr.3.1~Fr.3.8)。Fr.3.3组份经MCI柱(氯仿-甲醇15∶1)分离,得到化合物8 (14.2 mg)和11(3.0 mg)。Fr.3.5组份经硅胶柱色谱,以石油醚-氯仿(30∶1~0∶1)梯度洗脱,得到化合物13 (2.6 mg)和14 (1.2 mg)。Fr.3.6组份经硅胶柱色谱,以石油醚-氯仿(10∶1~0∶1)梯度洗脱,得到化合物10 (7.2 mg)和15 (1.5 mg)。Fr.3.7组份经硅胶柱,分别以石油醚-乙酸乙酯(20∶1)和氯仿-甲醇(60∶1)进行洗脱,得到化合物9 (3.0 mg)和12 (2.3 mg)。
Fr.4组份(6.7 g)经C18反相硅胶柱色谱,以甲醇-水(2∶8~1∶0)梯度洗脱,得到11个组份(Fr.4.1~ Fr.4.11)。Fr.4.2组份经Sephadex LH-20凝胶柱色谱,以氯仿-甲醇(1∶1)洗脱除去色素,后经重结晶得到化合物3 (48.9 mg)。Fr.4.4组份经Sephadex LH-20凝胶柱,以氯仿-甲醇(1∶1)分离,得到化合物4 (23.1 mg),剩余部分合并后再经硅胶柱色谱,以石油醚-氯仿(20∶1~5∶1)梯度洗脱,得到化合物5(33.1 mg)。Fr.4.5经Sephadex LH-20凝胶柱(甲醇)分离,得到化合物2 (5.0 mg)。Fr.4.6经Sephadex LH-20凝胶柱(甲醇)分离,得到5个组份(Fr.4.6.1~ Fr.4.6.5),其中Fr.4.6.2组份经硅胶减压柱,以石油醚-乙酸乙酯(8∶1~1∶1.5)梯度洗脱,得到化合物1 (26.1 mg)和7 (2.9 mg),Fr.4.6.4组份经硅胶柱色谱,以石油醚-丙酮(9∶1~1∶1)梯度洗脱,后经重结晶得到化合物6 (3.8 mg)。
1.4 化合物抑制种子萌发的活性测试
在12孔板中垫入干净滤纸片,加入600L的单体化合物溶液,以草甘膦为阳性对照,挑选颗粒饱满、大小均匀的萝卜()种子放入,在周围孔中加入水以保证湿度,置于28℃黑暗中培养7 d,测量根系的长度。
2 结果和分析
2.1 结构鉴定
化合物1 白色粉末;ESI-MS/: 187 [M + Na]+;分子式C9H8O3;1H NMR (500 MHz, CD3OD):H7.56 (1H, d,= 15.9 Hz, H-1ʹ), 7.41 (2H, d,= 8.5 Hz, H-2, 6), 6.77 (2H, d,= 8.5 Hz, H-3, 5), 6.24 (1H, d,= 15.9 Hz, H-2ʹ);13C NMR (125 MHz, CD3OD):C127.3 (C-1), 131.1 (C-2, 6), 116.8 (C-3, 5), 161.1 (C-4), 146.6 (C-1ʹ), 115.6 (C-2ʹ), 171.0 (C- 3ʹ)。以上数据与文献[7]报道的一致,故鉴定为香豆酸。
化合物2 白色粉末;ESI-MS/: 201 [M + Na]+;分子式C10H10O3;1H NMR (500 MHz, CD3OD):H7.63 (1H, d,= 16.0 Hz, H-1ʹ), 7.47 (2H, d,= 8.6 Hz, H-2, 6), 6.82 (2H, d,= 8.6 Hz, H-3, 5), 6.35 (1H, d,= 16.0 Hz, H-2ʹ), 3.78 (3H, s, OCH3);13C NMR (125 MHz, CD3OD):C127.2 (C-1), 131.1 (C-2, 6), 114.9 (C-3, 5), 161.3 (C-4), 146.6 (C-1ʹ), 116.8 (C- 2ʹ), 169.8 (C-3ʹ), 52.0 (OCH3)。以上数据与文献[8]报道的一致,故鉴定为香豆酸甲酯。
化合物3 淡黄色油状;ESI-MS/: 231 [M +Na]+;分子式C11H12O4;1H NMR (500 MHz, CD3OD):H7.66 (1H, d,= 16.0 Hz, H-1ʹ), 7.46 (2H, d,= 8.6 Hz, H-2, H-6), 6.81 (2H, d,= 8.6 Hz, H-3, H-5), 6.36 (1H, d,= 16.0 Hz, H-2ʹ), 4.23 (2H, dd,= 4.2, 5.6 Hz, H-5ʹa, H-5ʹb), 3.79 (2H, dd,= 4.2, 9.2 Hz, H-6ʹa, H-6ʹb);13C NMR (125 MHz, CD3OD):C127.2 (C-1), 131.2 (C-2, 6), 115.8 (C-3, 5), 161.3 (C- 4), 146.7 (C-1ʹ), 116.8 (C-2ʹ), 169.9 (C-3ʹ), 66.9 (C-5ʹ), 61.2 (C-6ʹ)。以上数据与文献[9]报道的一致,故鉴定为2-羟乙基-香豆酸酯。
化合物4 淡黄色粉末;ESI-MS/: 217 [M +Na]+;分子式C10H10O4;1H NMR (500 MHz, CD3OD):H7.54 (1H, d,= 15.9 Hz, H-2ʹ), 7.03 (1H, d,= 1.6 Hz, H-2), 6.94 (1H, dd,= 8.2, 1.6 Hz, H-6), 6.78 (1H, d,= 8.2 Hz, H-5), 6.26 (1H, d,= 15.9 Hz, H-1ʹ), 3.76 (3H, s, OCH3);13C NMR (125 MHz, CD3OD):C127.7 (C-1), 115.1 (C-2), 146.8 (C-3), 149.6 (C-4), 116.5 (C-5), 122.9 (C-6), 114.8 (C-1ʹ), 146.9 (C-2ʹ), 169.8 (C-3ʹ), 52.0 (OCH3)。以上数据与文献[10]报道的一致,故鉴定为咖啡酸甲酯。
化合物5 黄色油状;ESI-MS/: 209 [M + H]+;分子式C11H12O4;1H NMR (500 MHz, CD3OD):H7.62 (1H, d,= 15.9 Hz, H-1ʹ), 7.20 (1H, d,= 1.7 Hz, H-2), 7.08 (1H, dd,= 1.7, 8.2 Hz, H-6), 6.82 (1H, d,= 8.2 Hz, H-5), 6.37 (1H, d,= 15.9 Hz, H-2ʹ), 3.90 (3H, s, 3-OCH3), 3.77 (3H, s, 3ʹ-OCH3);13C NMR (125 MHz, CD3OD):C127.7 (C-1), 111.7 (C-2), 149.4 (C-3), 150.6 (C-4), 116.5 (C-5), 124.1 (C-6), 146.8 (C-1ʹ), 115.2 (C-2ʹ), 56.5 (3-OCH3), 169.7 (C-3ʹ), 52.0 (3ʹ-OCH3)。以上数据与文献[8]报道的一致,故鉴定为阿魏酸甲酯。
化合物6 淡黄色粉末;ESI-MS/: 201 [M +Na]+;分子式C10H10O3;1H NMR (500 MHz, CD3OD):H7.60 (1H, d,= 16.0 Hz, H-1ʹ), 7.44 (2H, d,= 8.6 Hz, H-2, 6), 6.79 (2H, d,= 8.6 Hz, H-3, 5), 6.31 (1H, d,= 16.0 Hz, H-2ʹ), 3.75 (3H, s, 4-OCH3);13C NMR (125 MHz, CD3OD):C127.1 (C-1), 131.1 (C-2, 6), 114.9 (C-3, 5), 161.3 (C-4), 146.6 (C-1ʹ), 116.8 (C- 2ʹ), 52.0 (4-OCH3), 169.8 (C-3ʹ)。以上数据与文献[11]报道的一致,故鉴定为()-3-(4-甲氧基苯基)丙烯酸。
化合物7 无色油状;ESI-MS/: 235 [M + Na]+;分子式C10H12O5;1H NMR (500 MHz, CD3OD):H7.61 (1H, d,= 2.0 Hz, H-2), 7.59 (1H, d,= 2.0 Hz, H-6), 6.89 (1H, d,= 8.1 Hz, H-5), 5.13 (1H, dd,= 3.7, 5.1 Hz, H-2ʹ), 3.92 (3H, s, 5-OCH3), 3.75(2H, dd,= 5.1, 11.7 Hz, H-3ʹa, 3ʹb);13C NMR (125 MHz, CD3OD):C128.0 (C-1), 125.1 (C-2), 149.2 (C-3), 153.8 (C-4), 115.9 (C-5), 112.5 (C-6), 199.6 (C-1ʹ), 75.5 (C-2ʹ), 66.2 (C-3ʹ), 56.4 (5-OCH3)。以上数据与文献[12]报道的一致,故鉴定为2,3-二羟基-1-(4-羟基-3-甲氧基苯基)-1-丙酮。
化合物8 无色油状;ESI-MS/: 265 [M + Na]+;分子式C11H14O6;1H NMR (500 MHz, CD3OD):H7.36 (2H, s, H-2, 6), 5.15 (1H, dd,= 3.9, 5.1 Hz, H-2'), 3.92 (6H, s, 3,5-OCH3), 3.76 (2H, dd,= 5.1, 11.7 Hz, H-3ʹa, 3ʹb);13C NMR (125 MHz, CD3OD):C126.7 (C-1), 107.8 (C-2, 6), 149.1 (C-3, 5), 143.0 (C-4), 199.8 (C-1ʹ), 75.5 (C-2ʹ), 66.2 (C-3ʹ), 56.9 (3,5- OCH3)。以上数据与文献[13]报道的一致,故鉴定为2,3-二羟基-1-(4-羟基-3,5-二甲氧基苯基)-1-丙酮。
化合物9 无色晶体;ESI-MS/: 161 [M + Na]+;分子式C7H6O3;1H NMR (500 MHz, CD3OD):H7.86 (2H, d,= 8.6 Hz, H-2, 6), 6.80 (2H, d,= 8.6 Hz, H-3, 5);13C NMR (125 MHz, CD3OD):C122.8 (C-1), 133.0 (C-2, 6), 116.0 (C-3, 5), 163.3 (C- 4), 170.2 (C-7)。以上数据与文献[14]报道的一致, 故鉴定为对羟基苯甲酸。
化合物10 白色粉末;ESI-MS/: 191 [M + Na]+;分子式C8H8O4;1H NMR (500 MHz, CD3OD):H7.56 (1H, d,= 1.9 Hz, H-2), 7.54 (1H, dd,= 1.9, 8.7 Hz, H-6), 6.83 (1H, d,= 8.7 Hz, H-5), 3.89 (3H, s, 4-OCH3);13C NMR (125 MHz, CD3OD):C122.2 (C-1), 115.8 (C-2, 6), 148.6 (C-3), 152.6 (C-4), 113.8 (C-5), 123.1 (C-6), 56.4 (4-OCH3), 169.8 (C-7)。以上数据与文献[15]报道的一致,故鉴定为3-羟基-4-甲氧基苯甲酸。
化合物11 白色粉末;ESI-MS/: 191 [M + Na]+;分子式C9H12O3;1H NMR (500 MHz, CD3OD):H7.33 (3H, s, H-2, 4, 6), 3.88 ( 9H, s, 1,3,5-OCH3);13C NMR (125 MHz, CD3OD):C148.9 (C-1, 3, 5), 108.4 (C-2, 4, 6), 56.9 (1,3,5-OCH3)。以上数据与文献[16]报道的一致,故鉴定为1,3,5-三甲氧基苯。
化合物12 黄色油状;ESI-MS/: 258 [M + Na]+; 分子式C12H13NO4;1H NMR (500 MHz, CD3OD):H7.35 (1H, dd,= 7.6, 0.8 Hz, H-4), 7.26 (1H, td,= 7.8, 1.2 Hz, H-6), 7.02 (1H, td,= 7.6, 0.8 Hz, H-5), 6.89 (1H, d,= 7.8 Hz, H-7), 3.48 (3H, s, 2ʹ- OCH3), 3.09 (1H, d,= 15.5 Hz, H-1ʹa), 3.05 (1H, d,= 15.5 Hz, H-1ʹb);13C NMR (125 MHz, CD3OD):C180.8 (C-2), 74.7 (C-3), 131.7 (C-3a), 125.2 (C-4), 123.5 (C-5), 130.9 (C-6), 111.2 (C-7), 143.6 (C-7a), 42.5 (C-1ʹ), 171.0 (C-2ʹ), 52.2 (2ʹ-OCH3)。以上数据与文献[17]报道的一致,故鉴定为methyl(3-hydroxy- 2-oxo-2,3-dihydroindol-3-yl)-acetate。
化合物13 无色晶体;ESI-MS/: 181 [M + Na]+;分子式C4H6O3N4;1H NMR (500 MHz, DMSO-6):H10.48 (1H, s, H-1), 7.98 (1H, s, H-3), 6.82 (1H, d,= 8.1 Hz, H-1ʹ), 5.72 (1H, s, H-3ʹ), 5.17 (1H, d,= 8.1 Hz, H-4);13C NMR (125 MHz, DMSO-6):C156.8 (C-2), 62.5 (C-4), 173.7 (C-5), 157.4 (C-2ʹ)。以上数据与文献[18]报道的一致,故鉴定为尿囊素。
化合物14 黄色油状;ESI-MS/: 197 [M + Na]+;分子式C7H10O5;1H NMR (500 MHz, CD3OD):H3.71 (2H, t,= 6.4 Hz, H-2b), 2.60 (2H, t,=6.4 Hz, H-2a), 1.96 (3H, s, CH3);13C-NMR (125 MHz, CD3OD):C174.5 (C-1), 139.7 (C-2), 28.1 (C-2a), 60.8 (C-2b), 141.1 (C-3, 4), 8.5 (C-3a)。以上数据与文献[19]报道的一致,故鉴定为2-(2-羟乙基)-3-甲基反丁烯二酸。
化合物15 无色油状;ESI-MS/: 283 [M + H]+;分子式C18H34O2;1H NMR (500 MHz, DMSO-6):H5.32 (2H, m, H-9, 10), 2.27 (2H, t,= 7.4 Hz, H-2), 1.98 (4H, dd,= 6.5, 12.3 Hz, H-8, 11), 1.50 (2H, m, H-3), 1.17~1.29 (20H, m, 10×CH2), 0.85 (3H, t,= 6.9 Hz, H-18);13C NMR (125 MHz, DMSO-6):C173.3 (C-1), 33.3 (C-2), 24.4 (C-3), 28.4 (C-4, 5, 6), 29.1 (C-7), 26.6 (C-8, 11), 129.7 (C-9), 130.0 (C-10), 29.7 (C-12), 28.5(C-13, 15), 28.8 (C-14), 31.8 (C-16), 22.7 (C-17), 14.1 (C-18)。以上数据与文献[20]报道的一致,故鉴定为油酸。
2.2 种子萌发抑制活性测试结果
对化合物1、2、9、10和11进行种子萌发抑制活性测试。在种子处于低水平发芽时,测量发芽种子胚根的长度,结果表明(图2),经400g/mL化合物处理后,根的生长受到显著抑制,根的长度明显变短,与对照的差异显著(<0.05),可见这些化合物有抑制萝卜种子萌发的作用。
3 结论和讨论
我国薏苡资源丰富,薏苡的生物量比传统饲料玉米()大[21]。近年来随着人们保健意识的提高,薏苡被越来越多的消费者认可,在食品、药品以及化妆品等方面薏苡仁都在不断进行研发,导致其销量逐年增加。文献报道,薏苡根、茎、叶部位中的功能性氨基酸含量丰富,占总氨基酸含量的59.34%~69.27%,可作为一种优良的新兴饲料作物[22–23]。而薏苡糠壳作为薏苡仁生产过程中的副产物,其产量较大,但对其开发利用较少,因此进一步开发薏苡糠壳的产业价值,高效地利用薏苡糠壳成为亟待解决的问题。本研究从薏苡糠壳乙醇提取物的乙酸乙酯萃取部分分离得到15个化合物,分别为香豆酸甲酯(1)、咖啡酸甲酯(2)、阿魏酸甲酯(3)、2-羟乙基-香豆酸酯(4)、香豆酸(5)、()-3-(4-甲氧基苯基)丙烯酸(6)、2,3-二羟基-1-(4-羟基-3-甲氧基苯基)-1-丙酮(7)、2,3-二羟基-1-(4-羟基-3,5-二甲氧基苯基)-1-丙酮(8)、对羟基苯甲酸(9)、3-羟基-4-甲氧基苯甲酸(10)、1,3,5-三甲氧基苯(11)、methyl (3-hydroxy-2-oxo-2,3-dihydroindol-3-yl)-acetate (12)、尿囊素(13)、2-(2-羟乙基)-3-甲基反丁烯二酸(14)和油酸(15),以酚类化合物较多,这与薏苡仁中脂肪酸含量较大不同,但分离出的化合物种类相似[24],其中化合物3、7、12、13和14为首次从薏苡中分离得到,丰富了薏苡的化合物结构类型。
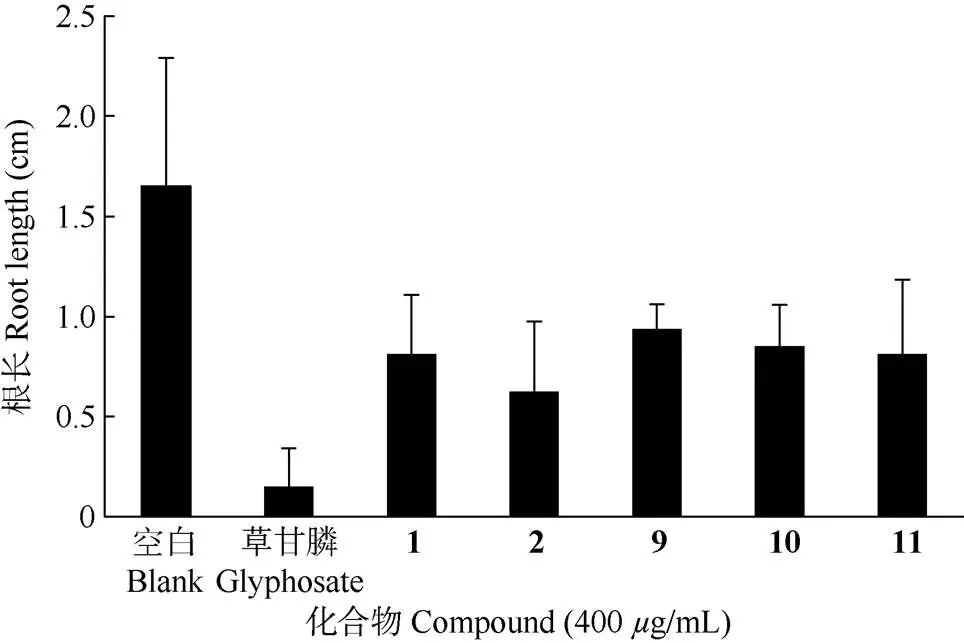
图2 薏苡糠壳中化合物对种子萌发的抑制作用。草甘膦为阳性对照。
酚类化合物是植物中广泛存在的一种次生代谢物质,部分小分子化合物易合成且用途广泛,据报道[25],阿魏酸和香豆素能够显著抑制藻细胞的生长,且对水稻种子发芽有抑制作用,可为选取高效安全的抑藻剂提供一定的参考。香豆酸[26]具有抗氧化、抗病毒等作用,广泛应用于医药、食品、饲料等领域。本研究对分离得到的部分化合物进行生物活性筛选,结果表明添加化合物1、2、9、10和11后,萝卜种子生根长度明显缩短,表明其对种子萌发具有不同程度的抑制作用。种子萌发是植物生长的基础,有研究报道,抗寒多年生麦草种子带壳直播出苗率与成苗率较高,而一些禾本科牧草种子去掉多余颖壳利于种子萌发[27]。薏苡糠壳去留因素对其萌发的利弊未知,薏苡产业还处于发展的初期阶段,在品种培育、种植技术等方面均有不足。薏苡糠壳中部分化合物显示出对种子萌发的抑制作用, 可为薏苡育种栽培提供理论依据。薏苡作为一种健康的食品[28],近年来对其开发利用不断加大,薏苡糠壳作为薏苡副产物,若能将其充分利用,挖掘其更多的活性作用,进一步开发的产业价值,不仅可减少资源的浪费,还能提高薏苡产业的附加值。
[1] YANG X Y, JIANG L P. Starch grain analysis reveals ancient diet at Kuahuqiao Site, Zhejiang Province [J]. Chin Sci Bull, 2010, 55(12): 1150–1156. doi: 10.1007/s11434-009-0545-0.
[2] JIN L M, LIU Y Z, ZHAO X L, et al. Research progress on effective constituents ín coix seed [J]. J Anhui Agric Sci, 2011, 29(10): 5734, 5750. doi: 10.3969/j.issn.0517-6611.2011.10.024.
金黎明, 刘垠孜, 赵晓蕾, 等. 薏苡仁有效成分研究进展 [J]. 安徽农业科学, 2011, 29(10): 5734,5750. doi: 10.3969/j.issn.0517-6611. 2011.10.024.
[3] LIN Y, LU S H, YU Q R, et al. Study on the antitumor activity of petroleum ether fractions of the extract from stems and leaves of[J]. Chin J Clin Pharmacol, 2018, 34(3): 282–284. doi: 10. 13699/j.cnki.1001-6821.2018.03.028.
林瑶, 陆世惠, 喻巧容, 等. 薏苡茎叶提取物石油醚部位的体外抗肿瘤活性研究 [J]. 中国临床药理学杂志, 2018, 34(3): 282–284. doi: 10.13699/j.cnki.1001-6821.2018.03.028.
[4] WANG C, ZHOU L B, ZHANG G B, et al. Drought resistance identification and drought resistance indices screening of job’s tears (L.) germplasm resources at seedling stage [J]. Sci Agric Sin, 2017, 50(15): 2872–2887. doi: 10.3864/j.issn.0578-1752. 2017.15.003.
汪灿, 周棱波, 张国兵, 等. 薏苡种质资源苗期抗旱性鉴定及抗旱指标筛选 [J]. 中国农业科学, 2017, 50(15): 2872–2887. doi: 10. 3864/j.issn.0578-1752.2017.15.003.
[5] SHI M, LI X D, PAN H. Guizhou Industrial Development Status and Research Progress Report ofin 2018 [M]. Beijing: Social Sciences Academic Press, 2018: 263–271.
石明, 李祥栋, 潘虹. 2018年贵州薏苡产业发展现状及研究进展报告 [M]. 北京: 社科文献出版社, 2018: 263–271.
[6] DENG S F, YANG Y Q, LIN Z N, et al. Prospect analysis of high value utilization of wastes in[C]// Proceedings of the 2016 Annual Conference of Chinese Society of Tropical Crops. Nan- ning: Chinese Society of Tropical Crops, 2016: 2.
邓素芳, 杨有泉, 林忠宁, 等. 薏苡废弃物高值利用前景解析 [C]// 中国热带作物学会2016年学术年会论文集. 南宁: 中国热带作物学会, 2016: 2.
[7] FORINO M, TARTAGLIONE L, DELL’AVERSANO C, et al. NMR- based identification of the phenolic profile of fruits of(goji berries). Isolation and structural determination of a novel-feruloyl tyramine dimer as the most abundant antioxidant polyphenol of goji berries [J]. Food Chem, 2016, 194: 1254–1259. doi: 10.1016/j.foodchem.2015.08.129.
[8] GOPALAKRISHNAN S, SUBBARAO G V, NAKAHARA K, et al. Nitrification inhibitors from the root tissues of, a tropical grass [J]. J Agric Food Chem, 2007, 55(4): 1385–1388. doi: 10.1021/jf062593o.
[9] DELLAGRECA M, PREVITERA L, PURCARO R, et al. Cinnamic ester derivatives from(Bermuda Buttercup) [J]. J Nat Prod, 2007, 70(10): 1664–1667. doi: 10.1021/np0702786.
[10] LIU W B, DONG L M, LUO B, et al. Chemical constituents from the leaves of[J]. J Trop Subtrop Bot, 2018, 26(3): 317–322. doi: 10.11926/jtsb.3820.
刘文斌, 董丽梅, 罗碧, 等. 青钱柳叶的化学成分研究 [J]. 热带亚热带植物学报, 2018, 26(3): 317–322. doi: 10.11926/jtsb.3820.
[11] WANG L F, CHEN J Y, XIE H H, et al. Phytochemical profiles and antioxidant activity of adlay varieties [J]. J Agric Food Chem, 2013, 61 (21): 5103–5113. doi: 10.1021/jf400556s.
[12] THANG P T, THOA H T, GIAP T H, et al. Chemical constituents from the ethyl acetate extract of the stems ofGagnep [J]. Vietnam J Chem, 2018, 56(2): 249–253. doi: 10.1002/vjch.2018 00022.
[13] OTSUKA H, TAKEUCHI M, INOSHIRI S, et al. Phenolic compounds fromvar.[J]. Phytochemistry, 1989, 28(3): 883–886. doi: 10.1016/0031-9422(89)80136-0.
[14] LUO Y, SHEN H Y, ZHANG M, et al. Chemical constituents from the dregs of[J]. J Trop Subtrop Bot, 2019, 27(3): 294– 298. doi: 10.11926/jtsb.3984.
罗应, 申海艳, 张敏, 等. 鸦胆子药渣的化学成分研究 [J]. 热带亚热带植物学报, 2019, 27(3): 294–298. doi: 10.11926/jtsb.3984.
[15] ZHANG S, SONG L Y, CHEN Y L, et al. Antioxidant chemical composition and determination of total content of phenolic acid in seeds ofPlanch. [J]. Chin Pharma J, 2019, 54(20): 1653–1659. doi: 10.11669/cpj.2019.20.004.
张珊, 宋乐园, 陈林玉, 等. 中华猕猴桃籽中抗氧化化学成分研究及总酚酸含量测定 [J]. 中国药学杂志, 2019, 54(20): 1653–1659. doi: 10.11669/cpj.2019.20.004.
[16] GUO Y Z, WEI Q, GAO J, et al. Metabolites of the psychrophilic fungus[J]. Nat Prod Res Dev, 2019, 31(3): 446–449,505. doi: 10.16333/j.1001-6880.2019.3.012.
郭永智, 魏茜, 高洁, 等. 嗜低温真菌次级代谢产物研究 [J]. 天然产物研究与开发, 2019, 31(3): 446– 449,505. doi: 10.16333/j.1001-6880.2019.3.012.
[17] DING H Y. Extracts and constituents ofwith 1,1- diphenyl-2-picrylhydrazyl (DPPH) free radical scavenging activity [J]. Int J Mol Sci, 2011, 12(6): 3941–3949. doi: 10.3390/ijms12063941.
[18] SANG S M, LAO A N, WANG H C, et al. A phenylpropanoid glycoside from[J]. Phytochemistry, 1998, 48(3): 569–571. doi: 10.1016/S0031-9422(97)00896-0.
[19] SAMY M N, KHALIL H E, SUGIMOTO S, et al. Phytoconstituents from the aerial parts of[J]. S Afr J Bot, 2018, 118: 179–182. doi: 10.1016/j.sajb.2018.07.014.
[20] SUN X, WU Y Z, ZHANG Y B. Chemical constituents from the twigs and leaves of[J]. J Chin Med Mat, 2019, 42(8): 1796– 1800. doi: 10.13863/j.issn1001-4454.2019.08.017.
孙欣, 吴泳樟, 张玉波. 巴豆枝叶的化学成分研究 [J]. 中药材, 2019, 42(8): 1796–1800. doi: 10.13863/j.issn1001-4454.2019.08.017.
[21] GAO J X, WU S J, ZHOU Z Y, et al. A study on the explotation and utilization of: An experiment on its cultivation and the analysis of its nutrition [J]. J Anhui Agrotechnol Teach Coll, 1994, 8(1): 66–68.
高金香, 吴世景, 周宗运, 等. 薏苡饲料资源开发和利用的研究——栽培试验及营养分析 [J]. 安徽农业技术师范学院学报, 1994, 8(1): 66–68.
[22] DENG S F, YANG Y Q, LI C Y, et al. Feeding value evaluation of coix based on amino acid analysis [J]. Chin J Trop Crops, 2017, 38(8): 1468–1477. doi: 10.3969/j.issn.1000-2561.2017.08.016.
邓素芳, 杨有泉, 李春燕, 等. 基于氨基酸分析的薏苡饲用价值评价 [J]. 热带作物学报, 2017, 38(8): 1468–1477. doi: 10.3969/j.issn. 1000-2561.2017.08.016.
[23] LIU F Z, ZHOU M Q, BAN X W, et al. Comparative trial of 11 cultivars ofL.[J]. Chin J Trop Crops, 2016, 37(9): 1670–1676. doi: 10.3969/j.issn.1000-2561.2016.09.003.
刘凡值, 周明强, 班秀文, 等. 11个薏苡属牧草品种材料比较试验 [J].热带作物学报, 2016, 37(9): 1670–1676. doi: 10.3969/j.issn.1000-2561. 2016.09.003.
[24] LI X K, GU K, LIANG M W, et al. Research progress on chemical constituents and pharmacological effects of[J]. Chin Trad Herb Drugs, 2020, 51(21): 5645–5657. doi: 10.7501/j.issn.0253- 2670.2020.21.031.
李晓凯, 顾坤, 梁慕文, 等. 薏苡仁化学成分及药理作用研究进展 [J]. 中草药, 2020, 51(21): 5645–5657. doi: 10.7501/j.issn.0253-2670. 2020.21.031.
[25] GUO Y L, FU H Y, HUANG G H, et al. Allelopathy effects of ferulic acid and coumarin on[J]. Environ Sci, 2013, 34(4): 1492–1497. doi: 10.13227/j.hjkx.2013.04.001.
郭亚丽, 傅海燕, 黄国和, 等. 阿魏酸和香豆素对铜绿微囊藻的化感作用 [J]. 环境科学, 2013, 34(4): 1492–1497. doi: 10.13227/j.hjkx. 2013.04.001.
[26] HE S S, WANG L, LI J, et al. Study on extraction and biological activity of coumalic acid from[J]. Food Indust, 2018, 39(8): 1–5.
何善生, 王力, 李健, 等. 螺旋藻中香豆酸的提取及其生物活性研究 [J]. 食品工业, 2018, 39(8): 1–5.
[27] HE Z X, MAO P S, SUN Y, et al. Review of the current status of grass seed coating technology [J]. Acta Prata Sin, 2016, 24(2): 270–277. doi: 10.11733/j.issn.1007-0435.2016.02.005.
何祖欣, 毛培胜, 孙彦, 等. 草类种子包衣技术现状综述 [J]. 草地学报, 2016, 24(2): 270–277. doi: 10.11733/j.issn.1007-0435.2016.02.005.
[28] DEVARAJ R D, JEEPIPALLI S P K, XU B J. Phytochemistry and health promoting effects of Job’s tears (): A critical review [J]. Food Biosci, 2020, 34: 100537. doi: 10.1016/j.fbio.2020. 100537.
Chemical Constituents ofand Their Activities on Seed Germination
WEI Yanmei1,2*, ZHOU Liwan1,2,3*, CHEN Huiqin1,2, YANG Li1,2, YANG Xiaoyu4, LIU Fanzhi4, MEI Wenli1,2, XU Xinglian3, DAI Haofu1,2**
(1. Hainan Key Laboratory for Research and Development of Natural Products from Li Folk Medicine,Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences,Haikou 571101, China; 2. Institute for Tropical Agricultural Resource, Chinese Academy of Tropical Agriculture Science,Haikou 571101, China; 3. College of Food Science and Technology, Nanjing Agricultural University,Nanjing 210095, China; 4. Institute of Subtropical Crops, Guizhou Academy of Agricultural Sciences, Xingyi 562400, Guizhou, China)
In order to understand the chemical constituents of bran shell of, fifteen compounds were isolated from ethyl acetate fraction of ethanol extract by using various chromatographic methods. Based on their spectroscopic data, their structures were isolated as-coumaric acid (1),-coumaric acid methyl ester (2), ()-2-hydroxyethyl-3-(4-hydroxyphenyl) acrylate (3), caffeic acid methyl ester (4), methyl ()-3-(4-hydroxy- 3-methoxyphenyl) acrylate (5), ()-3-(4-methoxyphenyl)acrylic acid (6), 2,3-dihydroxy-1-(4-hydroxy-3- methoxyphenyl)propan-1-one (7), 2,3-dihydroxy-1-(4-hydroxy-3,5-dimethoxyphenyl)-1-propanone (8),-hydro- xybenzoic acid (9), 3-hydroxy-4-methoxybenzoic acid (10), 1,3,5-trimethoxybenzene (11), methyl (3-hydroxy- 2-oxo-2,3-dihydroindol-3-yl)-acetate (12), allantoin (13), 2-(2-hydroxyethyl)-3-methylfumaric acid (14) and 9-octadecenoic acid (15). The compounds 3, 7, 12, 13 and 14 were isolated from coix for the first time. The compounds 1, 2, 9, 10 and 11 had significant inhibitory activity on seed germination.
; Chemical constituent; Acid; Seed germination
10.11926/jtsb.4361
2020-11-24
2021-01-25
贵州省百万领军人才项目;中国热带农业科学院院级创新团队项目(17CXTD-15)资助
This work was supported by the Project for Million Leading Talents in Guizhou, and the Project for Innovative Research Team of Chinese Academy of Tropical Agricultural Sciences (Grant No. 17CXTD-15).
魏艳梅(1994~ ),女,硕士,从事天然产物化学研究。E-mail: weiyanmeinpc@126.com
* 共同第一作者
. E-mail: daihaofu@itbb.org.cn

