MTA2、PGK1在子宫内膜癌组织中的表达及其与肿瘤进展的关系
郭 静 王雅莉 李红娟 张国梅 李 瓅 尤小燕
临床上子宫内膜癌的较高发病率,已经促进其成为威胁育龄期女性生命健康的重要原因,在具有肥胖或者合并有糖尿病的患者中,子宫内膜癌的发病率会增加[1-2]。长期的研究表明,子宫内膜癌患者在远期发生多器官功能衰竭的风险高达5%以上,其中晚期病情进展速度比较快。对子宫内膜癌患者发病过程中相关肿瘤蛋白的分析,能够为临床上相关妇科恶性肿瘤的诊疗提供参考。转移相关基因(MTA)是转移调控相关因子,可以提高患者癌细胞的转录浸润能力,从而加剧癌细胞对于邻近致残组织的侵袭过程,最终促进恶性肿瘤的发生[3-4];磷酸甘油酸激酶1(PGK1)是磷酸激酶调控相关因子,其对于磷酸激酶的激活程度,能够增加癌细胞膜上糖蛋白配体的磷酸化修饰程度,影响到癌细胞的生物学行为[5]。本文对MTA2、PGK1的表达与子宫内膜癌患者的病情关系进行分析,以期为临床上子宫内膜癌的诊疗提供参考依据,先将结果进行如下报告。
1 材料与方法
1.1 对象
选取2017年1月至2019年7月我院病理中心收集的80例子宫内膜癌组织(癌组织)、因子宫脱垂等手术获取的正常子宫内膜组织标本40例(正常组织)。子宫内膜癌组织的患者符合中华医学会制定的标准[6],并经病理学检查证实。年龄39~71岁,平均(58.2±8.6)岁;国际妇产联盟(FIGO)分期:Ⅰ期患者22例、Ⅱ期患者36例、Ⅲ期患者17例、Ⅳ期患者5例;组织学分级:G1级患者24例、G2级患者30例、G3级患者26例;病理学类型:腺癌患者68例、其他类型患者12例;发生淋巴结转移患者39例;浸润深度>1/2患者 37例。正常组织,患者年龄41~75岁,平均年龄(60.2±11.5)岁。2组在临床资料上比较,差异无统计学意义(P>0.05)。
1.2 方法
石蜡切片,应用免疫组化染色技术处理并显色,复染,封片。当MTA2、PGK1蛋白的阳性着色表达于细胞质时,会呈黄色、棕黄色、褐色表达。
1.3 免疫结果判定
①依据着色强度分为:0分-无色、1分-淡黄色、2分-棕黄色、3分-褐色、黑色;②依据阳性细胞比例:1分,阳性细胞数≤10%、2分,阳性细胞数11%~50%、3分,阳性细胞数51%~75%、4分,阳性细胞数>75%。将两种积分相乘得到总分,当总分<3分是阴性、≥3分是阳性。
1.4 统计学处理
2 结果
2.1 子宫内膜癌组织与正常子宫内膜组织中的MTA2、PGK1蛋白阳性表达率对比
子宫内膜癌组织的MTA2、PGK1蛋白阳性表达率分别为71.25%、65.00%,正常子宫内膜组织中的MTA2、PGK1蛋白阳性表达率分别为25.00%、32.50%,2组具有统计学差异(P<0.05),见表1。
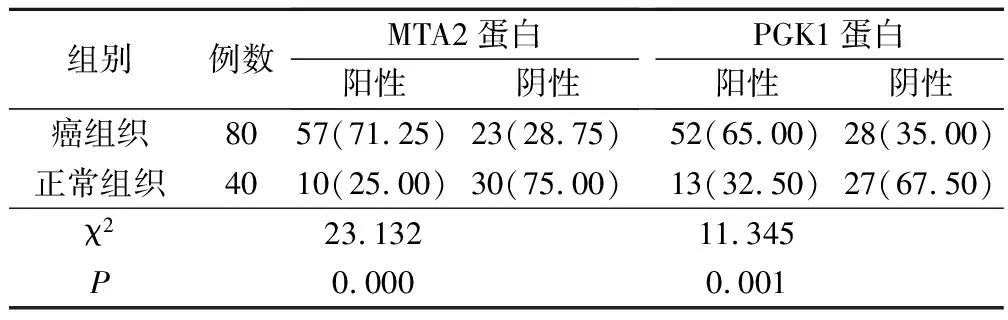
表1 子宫内膜癌组织与正常子宫内膜组织中的MTA2、PGK1蛋白阳性表达率对比(例,%)
2.2 MTA2、PGK1蛋白表达与子宫内膜癌病理学特征的关系
不同FIGO分期、不同组织学分级、是否发生淋巴结转移、不同肌层浸润深度的子宫内膜癌患者MTA2蛋白阳性表达率差异无统计学意义(P>0.05),见表2。
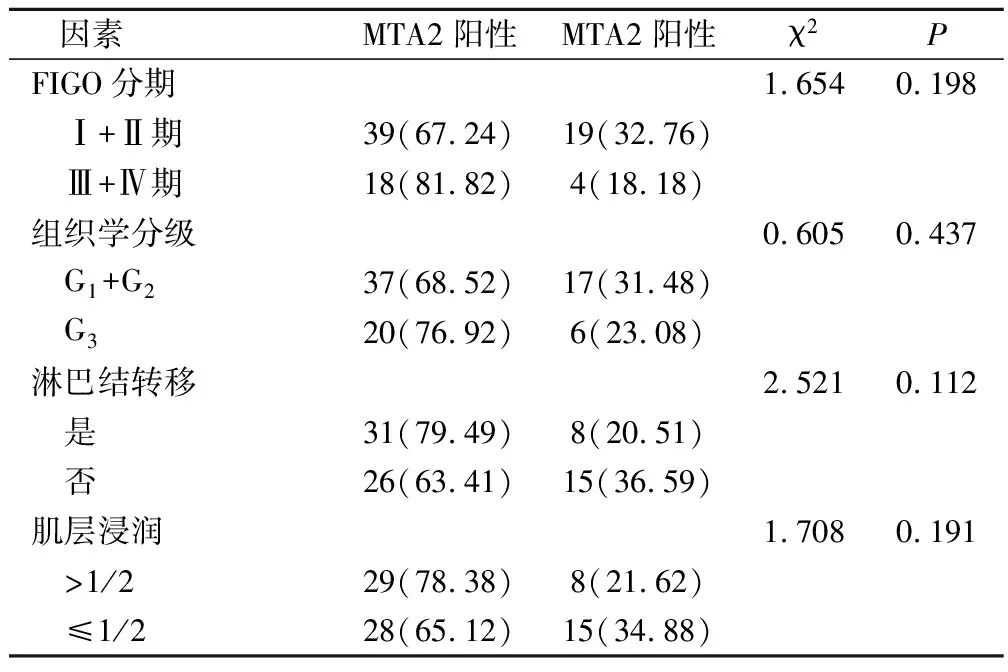
表2 MTA2蛋白表达与子宫内膜癌患者病理学特征的关系(例,%)
在不同FIGO分期、不同组织学分级、是否发生淋巴结转移的子宫内膜癌患者PGK1蛋白阳性表达率比较,差异均具有统计学意义(P<0.05);不同肌层浸润深度的子宫内膜癌患者PGK1蛋白阳性表达率差异无统计学意义(P>0.05);见表3。
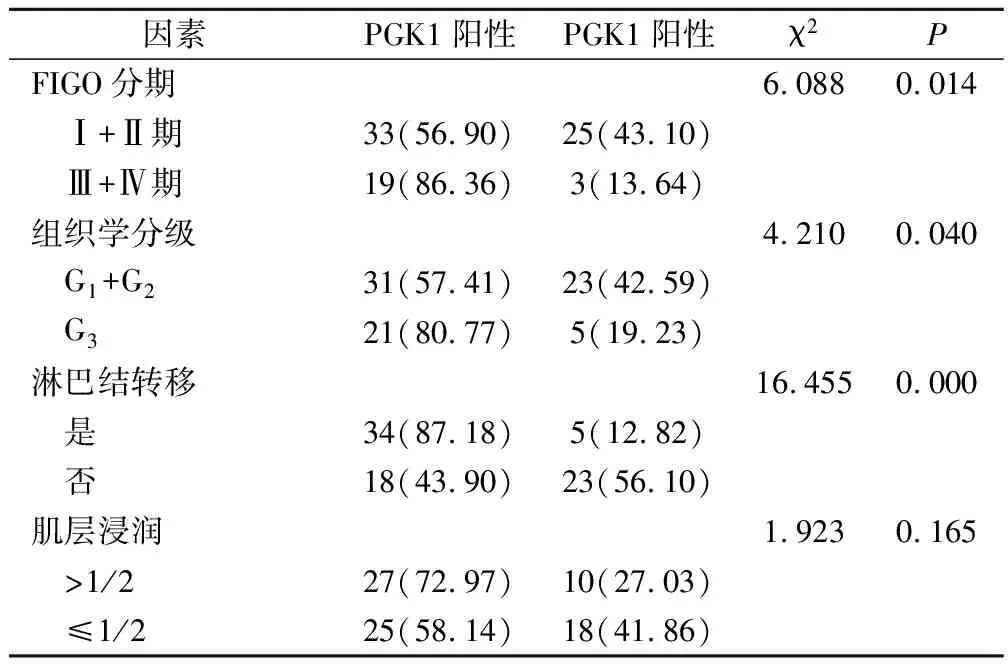
表3 PGK1蛋白表达与子宫内膜癌病理学特征的关系(例,%)
3 讨论
在不同的病理性途径激活的过程中,子宫内膜腺体细胞的异常增殖过程,能够显著促进子宫内膜恶性肿瘤的发[7-8]。体重指数的上升或者绝经后长期雌激素活性的上调,均能够增加子宫内膜腺体的异常分化风险,增加了子宫内膜癌的总体发病率[9]。临床上对于子宫内膜癌临床病理特征的评估,能够为子宫内膜癌诊疗提供参考,为临床上相关恶性肿瘤临床预后的评估提供依据。虽然肿瘤抗原或者糖蛋白指标如糖链蛋白125(CA125)或者糖链蛋白199(CA199),能够在子宫内膜癌的病情评估过程中发挥作用,但其对于子宫内膜癌病情评估的可参考性较低,对于子宫内膜癌患者临床分期或者癌细胞分化程度的预测价值不足[10-11]。妇科影像学检查能够在恶性肿瘤的临床病理特征评估中发挥作用,但影像学检查评估妇科恶性肿瘤的滞后性较为明显,评估的假阴性率较高。本次研究通过对于子宫内膜癌患者病灶组织中MTA2、PGK1的表达分析,能够为临床上子宫内膜癌的病情评估提供定量化的依据。
MTA是1种转移调控相关因子,可以对癌细胞的上皮-间质转换过程产生影响,从而提高了癌细胞伪足形成的能力,最终增加恶性肿瘤细胞的浸润增殖风险。MTA蛋白结构上包含的多个巯基及羟基结构,能够影响到癌细胞对于血管内皮分子的粘附能力,增加癌细胞的转移风险[12-13];PGK1是磷酸甘油激酶,其对于肿瘤细胞蛋白骨架结构中磷酸甘油酶的激活,可以促使肿瘤细胞糖代谢的异常,加剧恶化了癌细胞生物学特征。有部分研究者探讨了MTA子宫内膜癌病灶组织中的表达,发现在子宫内膜癌病灶组织中,MTA2的整体表达阳性率明显上升[14],但对于PGK1的分析不足。
免疫组化发现在子宫内膜癌病灶组织中,MTA2、PGK1蛋白的表达阳性率显著升高,高于子宫内膜良性组,具有统计学差异,表明MTA2、PGK1在子宫内膜癌患者中存在较高的表达状态。这主要由于子宫内膜腺体细胞的异常增殖过程中,释放了癌细胞内不同凋亡结构蛋白,能够显著激活下游信号通路,导致MTA2、PGK1蛋白的过度释放。还有研究指出,在子宫内膜癌病灶组织中,患者的PGK1蛋白表达阳性率可高达40%以上,在合并有盆腔淋巴结转移或者放疗敏感性较差的患者中,PGK1蛋白的表达阳性率会翻倍升高[15]。在对MTA2、PGK1的表达与子宫内膜癌患者临床病理特征关系的研究发现,在不同临床分期、不同淋巴结转移或者不同癌细胞浸润程度的患者中,MTA2蛋白的表达阳性率水平并无明显的差异,表明MTA2蛋白的高表达并不会影响到肿瘤细胞的生物学特征,不会影响到子宫内膜癌患者临床病理特征的进展。但这并不排除与入组病例数量的不足或者免疫组化染色敏感性的差别有关。在不同FIGO分期、不同组织学分级、是否发生淋巴结转移的患者中,PGK1蛋白的表达具有显著的差异,FIGO分期越晚、癌细胞分化程度越差或者组织学分级越差,PGK1蛋白的表达阳性率越高。其中的原因,主要考虑由于PGK1蛋白能够影响到子宫内膜腺体细胞内第二信使的磷酸化程度,加剧癌细胞生物学特征的恶化。而在不同浸润深度的患者中,PGK1蛋白的表达并无明显的差异,表明PGK1不能够影响到癌细胞对于基底膜组织的突破能力。
总之,MTA2、PGK1蛋白的表达阳性率在子宫内膜癌患者病灶组织中会明显升高,PGK1的表达升高会对子宫内膜癌的FIGO分期、淋巴结转移等过程产生影响。通过对于MTA2、PGK1的探讨,为临床上相关恶性肿瘤的病情评估提供蛋白检测指标。

