吉非替尼获得性耐药非小细胞肺癌患者miR-21、miR-155表达水平及临床意义
胡 波 朱琰琰 徐 颖
肺癌是我国发病率和死亡率均位居首位的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌的80%以上[1]。早期NSCLC发病隐匿且无明显临床表现,导致多数患者初诊即为晚期[2],而绝大多数晚期患者由于多种原因无法耐受手术治疗,常导致患者预后不良的发生[3]。吉非替尼是一种表皮生长因子酪氨酸受体抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI),已被证实其能有效延长NSCLC患者生存时间[4],但大多数患者用药过程中会发生获得性耐药,导致治疗失败,因此对耐药机制进行深入研究尤为重要。miRNA是一种长度约为20 bp的游离非编码RNA,研究表明其在多种肿瘤相关疾病中发挥重要作用[5]。相关研究报道miR-21表达水平与NSCLC的发生发展密切相关,可作为NSCLC诊断及预后相关指标应用于临床,而miR-155在肺癌中的高表达常与肿瘤的复发和转移相关[6],但二者在吉非替尼治疗过程中发生耐药的相关分子机制尚不明确。本研究采集吉非替尼获得性耐药NSCLC患者血清及组织并检测相关miRNA表达水平,旨在为解决NSCLC患者吉非替尼获得性耐药提供依据。
1 材料与方法
1.1 一般资料
选取2013年4月至2016年4月在本院接受吉非替尼治疗出现耐药的晚期NSCLC患者80例作为研究组,耐药标准参照中华医学会肺癌临床诊疗指南(2018版)[7]。纳入标准:①所有患者经细胞学检查确诊为NSCLC,根据TNM分期均为Ⅲ~Ⅳ期;②患者仅接受过吉非替尼单药治疗,未接受过其他靶向治疗及生物免疫治疗;③无合并其他肺部疾病和肿瘤。未达上述标准的NSCLC患者不纳入研究组。研究组中男性49例,女性31例,年龄为41~72岁,平均(57.14±9.33)岁。另选取60例吉非替尼治疗效果良好、6个月以上病情无进展NSCLC患者为对照组,其中男性33例,女性27例,年龄为43~71岁,平均(58.25±9.14)岁。本研究中所有患者均签署知情同意书并经医院医学伦理委员会审核通过。
1.2 RT-PCR检测技术检测miRNA-21、miRNA-155水平
所有患者入组第1天无菌采集患者外周血10 ml,3 000 r/min离心10 mim分离血清,于-80 ℃冰箱中低温储存。采用Serum RNA Purification Mini Kit试剂盒(加拿大Norgen Biotek公司)提取血清中总RNA,于-80 ℃保存。收集患者支气管镜检采集的肿瘤组织,采用Trizol试剂盒(上海酶联生物公司)提取总RNA,保存于-80 ℃。所提取RNA使用NanoDrop 2000检测,其A260/A280>1.8提示样品合格,使用TaKaRa逆转录试剂盒(大连宝生物公司)逆转录为cDNA模板备用。
使用SuperScriptTMⅢ One-Step RT-PCR System with PlatinumTMTaq DNA Polymerase试剂盒(美国Thermo Fisher公司)检测miRNA表达情况。体系中加入2×Reaction Mix 25 μl,正、反向引物各1 μl,cDNA 2 μl,SuperScriptTMⅢ PT/PlatinumTMTaq Mix 2 μl,加入ddH2O至50 μl,反应条件为94 ℃ 预变性2 min,94 ℃ 15 s、55 ℃ 30 s、68 ℃ 60 s,共40个循环,结果采用2-∆∆Ct法进行分析。所有引物均委托上海生工生物公司合成,miRNA-21引物:F:5’-AGACATCATACAGAGTGTCG-3’,R:5’-GCATCTAGGATCGACGTG-3’;miR-NA-155引物:F:5’-GCCGCTTAATGCTAATCGT-3’,R:5’-CAGTGCTGGGTCCGACTGA-3’。
1.3 免疫组化检测肺癌组织中EGFR表达情况
使用SP免疫组化试剂盒(上海酶联生物公司)检测NSCLC患者肿瘤组织中EGFR的表达情况,按照染色深度进行评分:未着色0分、淡黄色1分、棕黄色2分、棕褐色3分。再按阳性细胞比例进行评分:≤25%为1分、>25%~50%为2分、>50%~75%为3分、>75%为4分。将上述评分相乘记做总评分,<3分为低表达,≥3分为高表达。
1.4 统计分析
2 结果
2.1 2组患者临床资料比较
比较结果显示研究组及对照组患者年龄、性别、是否吸烟、肿瘤组织学类型、癌症分期及肿瘤分化程度均无明显差异(P>0.05),见表1。
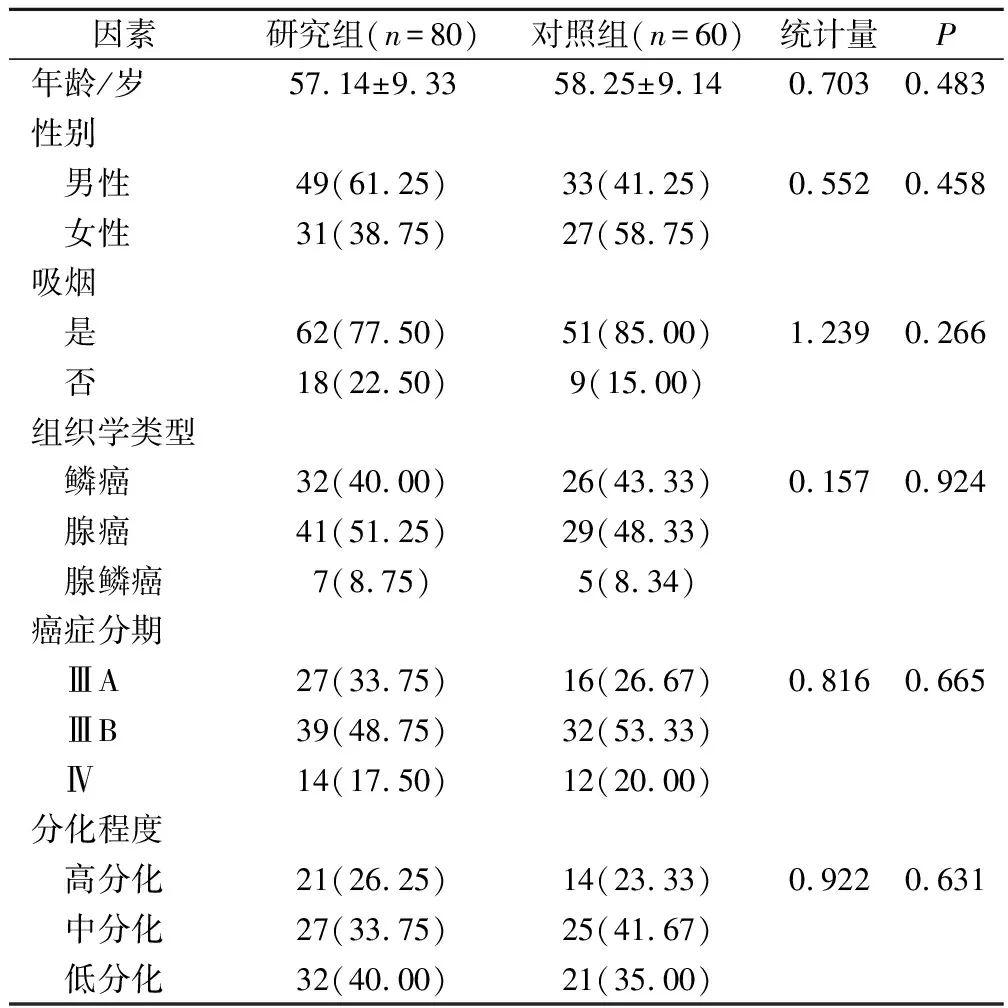
表1 2组患者临床资料比较(例,%)
2.2 2组患者miRNA-21、miRNA-155表达水平差异
经RT-PCR检测发现研究组血清、组织中miR-21水平及血清miR-155水平明显高于对照组(P<0.001),但组织中miR-155水平与对照组相比无统计学差异(P>0.05),见表2。

表2 2组患者miRNA-21、miRNA-155表达水平比较
2.3 肺癌组织EGFR表达与miRNA-21、miRNA-155水平的关系
免疫组化结果显示80例吉非替尼获得性耐药NSCLC患者组织中EGFR高表达59例,低表达21例。EGFR高表达患者血清、组织中miR-21及血清miR-155水平明显高于EGFR低表达患者(P<0.05),而组织中miR-155水平无统计学差异(P>0.05),见表3。

表3 miRNA-21、miRNA-155与肺癌组织中EGFR的关系
2.4 耐药组miR-21、miR-155表达水平与患者生存率的关系
采用门诊、电话、微信等方式对研究组患者进行随访,随访间隔3个月,随访患者死亡或截止2019年4月终止随访。所有死亡患者死因均为肺癌转移或并发症。随访结果绘制生存曲线,结果发现血清中miR-21、miR-155高表达患者生存率明显低于低表达患者(χ2=14.179,P<0.001;χ2=18.338,P<0.001),见图1A;而组织中miR-21高表达患者生存率明显低于低表达患者(χ2=12.195,P<0.001),但miR-155高表达患者生存率较低表达患者相比无统计学差异(χ2=1.162,P>0.05),见图1B。
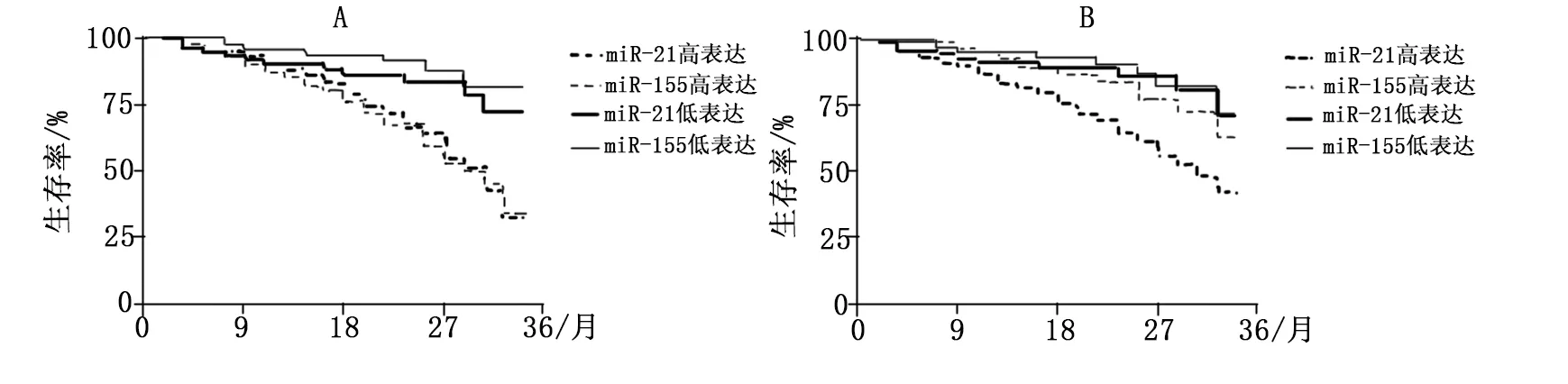
A:血清中miR-21、miR-155水平与患者预后的关系;B:组织中miR-21、miR-155水平与患者预后的关系
3 讨论
表皮生长因子酪氨酸激酶抑制剂吉非替尼具有抑制肿瘤血管生成、抑制细胞分裂和促进细胞凋亡的作用[8],目前研究已经证实其能够改善晚期NSCLC及转移性NSCLC患者临床症状并延长患者生存期,适用于化疗不耐受和化疗失败的NSCLC患者[9]。但临床试验发现大多数吉非替尼治疗有效的NSCLC患者在接收治疗6个月后会发生不同程度的耐药,导致治疗失败。相关研究表明EGFR基因二次突变、PI3K/AKT通路过度激活和肿瘤微环境的改变在肿瘤耐药中发挥重要作用[10-12],但其具体机制尚需深入研究。
研究发现miR-21在多种肿瘤细胞中高表达,与肿瘤的增殖转移密切相关,被称作促癌miRNA[13],高表达的miR-21调控其下游多个抑癌基因而促进肿瘤的发展。国内学者Dai的研究发现miR-21在NSCLC患者血清中表达水平明显上升,且miR-21的高表达常与患者预后不良相关[14],miR-21还能够通过PI3K/AKT通路调节NSCLC化疗的敏感性[15]。故miR-21表达水平可作为患者预后相关指标发挥临床作用。miR-155在肺癌、乳腺癌、胰腺癌等肿瘤中表达水平升高[16],且miR-155的高表达常与肿瘤耐药的发生相关。研究表明血清中miR-155高表达的乳腺癌患者曲妥珠单抗治疗效果较差[17];而利妥昔单抗治疗弥漫性大B细胞淋巴瘤患者时发现组织中miR-155高表达者常伴随预后不良的发生[18]。本研究发现研究组血清中miR-21、miR-155表达水平及组织中miR-21水平明显高于对照组,提NSCLC患者吉非替尼耐药的发生可能与miR-21、miR-155水平相关,但研究组组织中miR-155水平与对照组相比无统计学差异,可能与患者的特异性及免疫组化评分标准不同相关。
有研究表明EGFR通路能够调控miR-21水平,尤其在不吸烟的NSCLC患者中EGFR突变上调其磷酸化水平,导致miR-21水平升高抑制细胞凋亡[19]。Li的研究发现miR-21的高表达可能通过PTEN基因调控EGFR-TKI耐药的发生[20]。而miR-155可能通过NF-κB通路驱动FOXO 3a导致吉非替尼耐药的发生[21],但具体机制尚不完全明确。而本研究发现在EGFR高表达患者外周血miR-21、miR-155水平及组织中miR-21水平明显高于低表达患者,提示EGFR高表达患者可能通过上调miR-21及miR-155水平介导吉非替尼耐药的发生,而组织miR-155水平无明显差异可能与患者异质性相关。生存曲线说明血清miR-21、miR-155高表达及组织miR-21高表达患者常伴随预后不良的发生。
综上所述,吉非替尼获得性耐药NSCLC患者血清中miR-21、miR-155及组织中miR-21水平明显上升,且与肿瘤组织中EGFR水平相关,生存曲线结果为血清中miR-21、miR-155和组织中miR-21高表达患者生存率明显低于低表达患者,而组织中miR-155水平与上述指标无关。血清miR-21、miR-155和组织中miR-21水平可能作为相关指标对吉非替尼获得性耐药NSCLC患者预后进行评估,但其与吉非替尼获得性耐药发生的相关性仍需进一步研究。

