红掌松散型胚性愈伤组织的诱导
许丁帆,刘艳军,边一迪,董洪雨
红掌松散型胚性愈伤组织的诱导
许丁帆,刘艳军通信作者,边一迪,董洪雨
(天津农学院 园艺园林学院,天津 300392)
为获得红掌松散型胚性愈伤组织,采用不同红掌外植体、不同激素处理组合及MS培养基无机盐倍数进行红掌胚性愈伤组织的诱导。结果显示:红掌叶片为愈伤组织诱导最适外植体,可在1/2MS+2.0mg/L2,4-D+0.2mg/LNAA的培养基上诱导出红掌松散型愈伤组织;将松散型愈伤组织转接到MS+1.0mg/LBA+1.0mg/L2,4-D培养基上,每15 d继代培养1次,继代培养2~3次后可获得红掌松散型胚性愈伤组织,并可直接在MS培养基上再生。试验建立了红掌松散型胚性愈伤组织诱导体系,可为红掌组培快繁和离体诱变研究奠定一定基础。
红掌;胚性愈伤组织;外植体;激素;无机盐
红掌(),天南星科花烛属多年生附生性草本花卉,是名贵的盆切两用花,又名花烛、红鹤芋、安祖花等,是当前世界第二大热带花卉品种[1-3]。红掌花型优美,具有较高的观赏价值,且空气净化能力强,当前市场需求量大,产业价值高[4]。我国是世界红掌主要生产基地和消费市场之一。20世纪以来,我国红掌育种研究陆续开展,但仅部分自主品种在生产中推广应用[5]。与荷兰等欧洲国家相比,我国红掌品种少、品质差且生产成本高[6-7]。目前,国内红掌优质种苗及新品种主要依赖进口,红掌产业发展受到一定程度的限制。新品种选育是我国红掌产业持续发展的动力与基础,对提高我国红掌经济效益和国际竞争力具有重要意义。国内红掌新品种选育主要采用杂交育种等常规育种手段,但由于国内红掌种质资源缺少、重要性状遗传规律不明等原因,效率低、耗时长、成本高[8]。
近年来,随着生物技术的不断发展,细胞工程育种在红掌种质资源创新方面发挥了重要作用,如在红掌诱变育种、倍性育种、转基因育种等方面已有不少研究,并培育出不少的育种材料及新品种[9]。利用松散型胚性愈伤组织进行体细胞离体诱变是培育植物新品种的有效途径之一。因此,红掌胚性愈伤组织诱导体系的建立是红掌细胞工程和基因工程研究的重要基础工作,对于红掌组培快繁、离体诱变育种及基因转化等具有重要意义。本试验针对红掌胚性愈伤组织诱导这一关键技术环节,采用红掌不同外植体、不同培养基进行松散型胚性愈伤组织的诱导,建立红掌松散型胚性愈伤组织诱导体系,可为红掌离体诱变育种、基因转化研究和愈伤组织脱毒培养等奠定基础。
1 材料和方法
1.1 试验材料
本试验所用红掌组培苗由天津农学院园林植物实验室提供。
1.2 试验方法
1.2.1 红掌愈伤组织的诱导
选取生长健壮的红掌组培苗,以叶片、叶柄、茎段外植体,在超净工作台中选取刚展开的叶片,剪去其边缘及叶柄,叶片剪成约0.5cm2小块;叶柄约0.5cm;茎段不带有腋芽,约0.5cm;分别接种到愈伤组织诱导培养基上进行愈伤组织诱导。愈伤组织诱导培养基为1/2MS+2.0mg/L2,4-D+30g/L蔗糖,培养基pH5.8,琼脂粉7g/L。试验采用100mL三角瓶为容器,加入40mL培养基。每个三角瓶中接种外植体8块,每个处理重复5瓶。培养条件为(25±1)℃,连续光照,光照强度1000lx。每天观察记录不同外植体愈伤组织的诱导情况,50d后统计每个处理愈伤组织的生长情况。
1.2.2 红掌松散型愈伤组织的诱导
上述步骤中不同外植体诱导的愈伤组织类型不同,选择质地较硬的愈伤组织进行红掌松散型愈伤组织的诱导。将愈伤组织分割成0.25mm3左右大小,接种于不同的松散型愈伤组织诱导培养基上,培养基分别为MS;1/2MS;MS+2.0mg/L2,4-D;1/2MS+2.0mg/L2,4-D;1/2MS+2.0mg/L2,4-D+0.5mg/LBA;1/2MS+2.0mg/L2,4-D+1.0mg/LBA;1/2MS+2.0mg/L2,4-D+0.2mg/LNAA;1/2MS+2.0mg/L2,4-D+1.0mg/LIAA,并依次编号为1~8。所有培养基采用7g/L琼脂粉固化,添加30g/L蔗糖,调节pH为5.8。每个培养基接种10块外植体,重复5次。培养条件为(25±1)℃,连续光照,光照强度为2000lx。40d后统计每个处理愈伤组织的生长情况。
1.2.3 红掌松散型胚性愈伤组织的诱导
将获得的松散型愈伤组织分割为大小约0.25mm3的小块,接种到不同培养基上进行愈伤组织的胚性化诱导。培养基以MS为基本培养基,附加不同浓度NAA、BA、2,4-D,30g/L蔗糖、7g/L琼脂,pH5.8。每个培养基接种8块外植体,重复5次。培养条件为(23±1)℃,连续光照,光照强度为2000lx。每个处理采用相同的培养基每15d继代培养一次,并镜检观察愈伤组织胚性化情况,细胞个体较小、细胞质浓度大、细胞核较大的细胞为胚性愈伤组织,每次继代培养时选择结构松散且带有胚性化特征的愈伤组织,继代培养5次,记录每个处理愈伤组织生长与胚性化情况。
2 结果与分析
2.1 不同红掌外植体愈伤组织的影响
将红掌的叶片、叶柄和茎段外植体接种到愈伤组织诱导培养基后,外植体膨大,具体愈伤组织诱导情况见表1。

表1 红掌不同外植体对愈伤组织诱导的影响
由表1可知,不同外植体在相同愈伤组织诱导培养基上的诱导结果不同。以红掌叶片为外植体愈伤组织诱导率最高,达100.0%,叶柄愈伤组织诱导率次之,茎段最低。从愈伤组织类型看,不同外植体诱导的愈伤组织类型差异较大,叶片诱导的愈伤组织属于松软类型,颜色为白色或黄绿色;叶柄和茎段诱导的愈伤组织多为绿色、紧密型愈伤组织。从愈伤组织的生长速度看,以叶柄和茎段为外植体诱导愈伤组织,生长速度慢,约20d后才出现少量绿色愈伤组织,这类愈伤组织初期与外植体的表皮相似,不具备一般愈伤组织薄壁细胞的特性;以叶片为外植体时,培养10d后部分外植体上出现愈伤组织,且愈伤组织生长速度快。因此,叶片为诱导红掌愈伤组织理想外植体。
2.2 激素与MS无机盐倍数对红掌愈伤组织特性的影响
从表2可以看出,在MS培养基上,愈伤组织生长缓慢,只在原来愈伤组织表面长出少量的绿色愈伤组织,且愈伤组织质地较硬,结构紧密;在1/2MS培养基上,愈伤组织生长速度较MS培养基上快且结构略微松散,但生长仍缓慢,仍属紧密型愈伤组织。在MS和1/2MS培养基附加2.0mg/L2,4-D,愈伤组织生长速度均显著增加,尤其在1/2MS+2.0mg/L2,4-D培养基上愈伤组织生长迅速,但此时愈伤组织质地较软,结构松散,属于不可再生的愈伤组织,难以进一步形成胚性愈伤组织。为增加愈伤组织硬度,试验在1/2MS+2.0mg/L2,4-D培养基的基础上分别添加0.5mg/L和1.0mg/LBA后,愈伤组织的质地变硬,但愈伤组织结构紧密、不易分散,不是理想的愈伤组织类型。而在1/2MS+2.0mg/L2,4-D基础上添加生长素,愈伤组织结构变松散,具体来看:在1/2MS+2.0mg/L2,4-D+1.0mg/LIAA上,愈伤组织结构松散,但质地较软;在1/2MS+2.0mg/L2,4-D+0.2mg/LNAA上,愈伤组织质地较硬,结构松散,是诱导松散型胚性愈伤组织的理想材料,因此诱导红掌松散型愈伤组织的理想培养基为1/2MS+2.0mg/L2,4-D+0.2mg/LNAA。
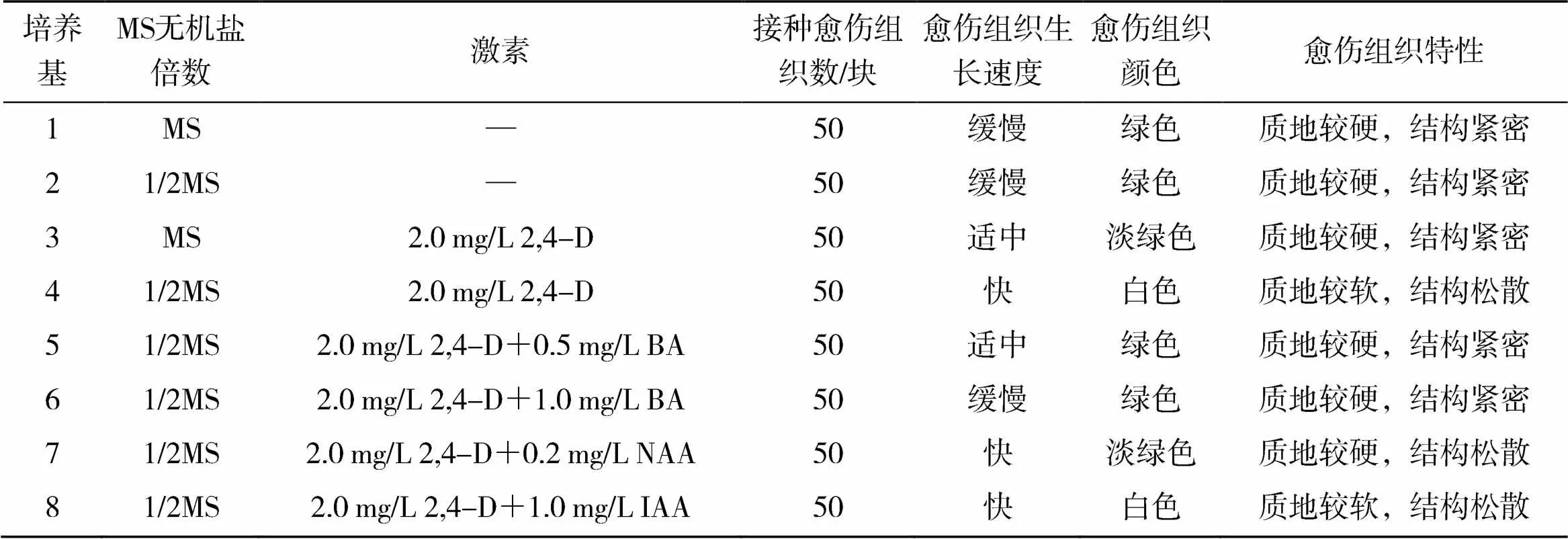
表2 激素与MS无机盐倍数对红掌愈伤组织特性的影响结果
2.3 红掌松散型胚性愈伤组织诱导试验结果
将红掌松散型愈伤组织继代于1/2MS+2.0mg/L 2,4-D+0.2mg/LNAA时,随继代次数增加,愈伤组织逐渐变软,最终褐变死亡,镜检时未见胚性细胞。将获得的松散型愈伤组织转接到不同的胚性愈伤组织诱导培养基上,每隔15d继代一次,每次继代时结合镜检,具体情况见表3。

表3 不同培养基对红掌愈伤组织胚性化的影响结果
由表3可知,当增加MS培养无机盐倍数后,即在MS+2.0mg/L 2,4-D+0.2mg/L NAA上,愈伤组织变软现象得以改变,但愈伤组织未胚性化,随着继代次数增加,愈伤组织逐渐老化。在0.5mg/L BA或1.0mg/L BA配合2.0mg/L 2,4-D使用的情况下,愈伤组织生长速度较快,且随着继代次数的增加愈伤组织结构与质地仍可保持理想状态,但始终未见愈伤组织胚性化,这类愈伤组织无法进行其他试验。在0.5mg/LBA或1.0mg/LBA配合使用较低浓度2,4-D(1.0mg/L)时,愈伤组织胚性化情况明显改变,在MS+0.5mg/L BA+1.0mg/L 2,4-D培养基上,愈伤组织部分胚性细胞,但随着继代次数增加,胚性化愈伤组织未见明显增多;而在MS+1.0mg/L BA+1.0mg/L 2,4-D,第一次继代时愈伤组织部分胚性化,第二次继代培养后愈伤组织全部为胚性细胞组成,并随着继代次数的增加,这种结构松散型的胚性愈伤组织可以保持。因此,采用MS+1.0mg/LBA+1.0mg/L 2,4-D培养基,继代培养3~5次,每次继代时间为15d,即可获得红掌稳定的松散型胚性愈伤组织培养体系。
3 结论与讨论
3.1 外植体类型对愈伤组织诱导的影响
外植体类型的选择是愈伤组织诱导的关键。在本试验中,采用红掌组培苗的叶片、茎段和叶柄为外植体诱导愈伤组织效果明显不同,以叶片为外植体诱导愈伤组织效果最佳,具有较高愈伤组织诱导率,这与周丽丽等[10]、刘宝骏等[11]研究结果一致。而李娜等[12]研究发现叶柄为外植体诱导愈伤组织效果最好,这可能与以下几个方面有关:第一,外植体中的细胞类型,不同的细胞类型诱导愈伤组织的难易程度不同,分生组织细胞分化能力强,细胞活跃,在外源激素作用下易转变为愈伤组织。第二,外植体的生理状态[13],一般初生的组织细胞活跃,易形成愈伤组织细胞。第三,外植体的大小[14],较大的外植体可能合成内源激素的能力较强,能够抵御外源激素的作用,从而降低了愈伤组织的诱导效率;而过小的外植体易受到外源激素及培养基中化学物质毒害,在未产生愈伤组织之前褐变乃至死亡,适宜的外植体大小是愈伤组织诱导的关键。第四,外植体伤口大小,诱导愈伤组织时,一定会造成伤口,尤其是表皮较厚的组织类型,如本试验采用的红掌组织。要求外植体伤口大小适度,伤口平滑,避免伤口过大或采用钝器切割,否则会影响外植体的成活率。此外,在诱导愈伤组织时,外植体应平置于培养基表面,避免伤口浸没在培养基中。
3.2 培养基渗透压对愈伤组织结构类型的影响
愈伤组织结构主要是指愈伤组织细胞间的联系程度,愈伤组织联系紧密且不容易分开为紧密型;相反,易分散的愈伤组织为松散型愈伤组织。本试验中诱导红掌松散型愈伤组织,以1/2MS为基本培养基诱导的愈伤组织生长速度与松散程度均高于MS为基本培养基,此结果与张劲松等[15]诱导北细辛愈伤组织结果相同。这可能与1/2MS培养基使用了半量无机盐有关,降低了培养基渗透压从而促进愈伤组织快速生长,而生长速度较快的愈伤组织多为松散型愈伤组织,因为生长速度快细胞间联系不紧密,从而结构变得松散。
3.3 继代培养对愈伤组织生长的影响
在愈伤组织培养中,继代培养可以提高愈伤组织的质量,继代时间与继代次数对愈伤组织生长和质量影响较大。李银凤等[16]研究认为随着继代次数的增加,愈伤组织的生长量逐渐增加,成活率也逐渐提高。周婵[17]认为胚性愈伤组织的保存与增殖,需要新鲜养分的供应,因此,适时进行继代培养对胚性愈伤组织的保持起重要作用。本试验中,在诱导红掌胚性愈伤组织的过程中,每15d继代一次,随着继代次数的增加,红掌愈伤组织胚性化程度增加,且经过5次继代仍保持胚性。但有研究表明随着继代次数的增加,胚性愈伤组织的增殖能力和体胚形成能力会逐渐减弱,红掌胚性愈伤组织的保持有待进一步研究[18-19]。
试验最终获得红掌松散型胚性愈伤组织诱导的具体方法为:选取生长健壮的红掌组培苗叶片,剪去叶片边缘及叶柄,平置于1/2MS+2.0mg/L2,4-D+0.2mg/LNAA培养基上诱导松散型愈伤组织;然后将松散型愈伤组织转接到MS+1.0mg/LBA+1.0mg/L2,4-D培养基上,每15d继代培养1次,继代2~3次后即可获得红掌松散型胚性愈伤组织。本试验结果可用于红掌组培快繁、离体诱变育种及基因遗传转化等研究。
[1]杨光穗,冷青云,王呈丹,等.16个红掌品种的核型分析[J].热带作物学报,2016,37(12):2283-2287.
[2]李心,杨柳燕,张栋梁,等.低温胁迫下2个红掌新种质的耐寒性鉴定[J].分子植物育种,2019,17(16):5446-5453.
[3]李水根,李秀芬,李记开,等.硝普钠对红掌愈伤形成及植株再生的影响[J].上海农业学报,2019,35(5):1-5.
[4]杨继凯,刘翠菊,郭霄,等.不同品种红掌观赏特性的比较[J].北方园艺,2018(7):60-65.
[5]易懋升,谢利,郭和蓉,等.红掌育种方法研究进展[J].中国农学通报,2015,31(4):157-161.
[6]易双双,李崇晖,杨光穗,等.红掌花色表型分类研 究[J].北方园艺,2018(16):105-111.
[7]黄静.9个红掌品种在漳州地区的引种表现[J].长江大学学报(自科版),2018,15(6):13-14,47.
[8]牛俊海,黄少华,冷青云,等.分子标记技术在红掌研究中的应用与展望[J].分子植物育种,2015,13(6):1424-1432.
[9]韩伟,包英华,于白音.红掌()细胞工程研究进展及其在育种上的应用[J]. 分子植物育种,2020,18(10):3311-3322.
[10]周丽丽,王晶,闫俊芳,等.不同外植体对红掌初代培养及愈伤组织诱导的影响[J].安徽农业科学,2012,40(28):13720-13724.
[11]刘宝骏,刘国锋.安祖花胚性愈伤组织诱导及植株再生研究[J].热带亚热带植物学报,2018,26(4):407-414.
[12]李娜,刘春,张黎.红掌愈伤组织诱导及再生体系的建立[J].农业科学研究,2015,36(4):22-25.
[13]朱向涛,王雁,吴倩,等.江南牡丹茎段愈伤组织诱导与植株再生[J].核农学报,2015,29(1):56-62.
[14]刘慧敏,刘艳军,黄俊轩,等.丹参愈伤组织快速生长培养方法[J].天津农业科学,2017,23(7):14-16.
[15]张劲松,于婷婷,何朋,等.北细辛愈伤组织诱导及其解剖结构观察[J].中草药,2015,46(4):566-571.
[16]李银凤,孙振元,韩蕾,等.草地早熟禾耐盐愈伤组织筛选的适宜NaCl浓度和继代次数研究[J].林业科学研究,2008(1):122-125.
[17]周婵.香樟胚性愈伤组织诱导、增殖及抗寒性鉴定体系的建立[D].南阳:南阳师范学院,2019.
[18]白玉娥,曾超,彭鹏,等.沙地云杉胚性愈伤组织诱导[J].分子植物育种,2015,13(6):1363-1368.
[19]刘宝光,李成浩,张含国.红皮云杉胚性愈伤组织保持与增殖阶段影响因子的筛选与分析[J].东北林业大学学报,2010,38(7):56-60.
Induction of loose embryogenic callus from
Xu Dingfan, Liu YanjunCorresponding Author,Bian Yidi,Dong Hongyu
(College of Horticulture and Landscape, Tianjin Agricultural University, Tianjin 300392, China)
In order to obtain the loose embryogenic callus of,different explants, different hormone treatment combinations and MS medium inorganic salt multiple were used to induce the embryogenic callus of.The results showed that the leaves ofwere the best explants for callus induction, and the loose callus could be induced on the medium of 1/2MS+2.0 mg/L 2,4-D+0.2 mg/L NAA, and transferred to MS+1.0 mg/LBA+1.0 mg/L 2,4-D medium, subcultured once every 15 days, and subcultured 2-3 times, and then the loose embryogenic callus ofcould be obtained and regenerated directly on MS medium. The induction system of loose embryogenic callus ofwas established in this experiment, which can lay a foundation for the study of tissue culture and in vitro mutagenesis of.
;embryogeniccallus;explant;hormone;inorganicsalt
1008-5394(2021)03-0022-04
10.19640/j.cnki.jtau.2021.03.005
S682.14
A
2020-04-30
魏县益聚种植园艺设计有限公司园艺植物种业创新团队(199A2905H)
许丁帆(1997—),男,硕士在读,主要从事园艺植物育种研究。E-mail:1424039435@qq.com。
刘艳军(1970—),男,高级实验师,硕士,主要从事园艺植物组织培养和分子育种研究。E-mail:liuyanjun00a@126.com。
责任编辑:杨霞

