骨化性气管支气管病1例并文献复习
陈颖洁,王子鸣,刘敏,李承红*
(江汉大学a.医学院,湖北武汉 430056;b.附属医院呼吸内科,湖北武汉 430015)
骨化性气管支气管病(tracheobronchopathia osteochondroplastica,TO)是一种罕见的疾病,主要以气管、支气管黏膜下多发性骨或软骨组织结节状增生并突向管腔为表现的良性病变[1]。临床上常因无症状或症状不典型而被误诊、漏诊,且目前尚无针对性治疗。本文报告骨化性气管支气管病1例,并结合文献讨论该病的发病机制、临床表现、诊断、鉴别诊断、治疗及预后。
1 临床资料
患者,男,39岁,卷烟厂工作,因“咯血3天”入院。患者3天前因咯血至结核病院就诊,因期间发生大咯血,药物止血效果欠佳遂急诊转入江汉大学附属医院,入院查体无异常。血气分析、肝肾功能、电解质、凝血功能、肿瘤标志物、血沉、降钙素原等均未见异常,痰检及支气管肺泡灌洗液未发现抗酸杆菌,肺功能结果示:FVC:4.14 L,FEV1/Pre:93.62%,FEV1/FVC:84.78%,肺通气功能正常范围,血常规:WBC 9.2×109/L,N 0.87,L 0.07,RBC:3.95×1012/L,Hb:98 g/L。入院查胸部CT提示:气管壁增厚,欠光整,管壁多发斑点状钙化影,两肺纤维硬结钙化灶并左肺上叶纤维空洞形成,双肺絮状模糊影,右肺下叶可见直径约2 cm的团块影(图1,图2)。支气管镜示:气管壁多发大小不等结节突向管腔,膜部不受累,结节无蒂,直径1~3 mm,大者可达10 mm,多为白色或灰黄色,散发或融合成片,管壁呈溶洞样改变,累及右主支气管及右中间支支气管,管腔轻度狭窄(图3)。镜下予以活检钳及冷冻活检,获取结节数枚并送病理检查,组织病理学提示送检组织被覆鳞状上皮,可见大量炎性细胞浸润,另见灶性软骨及骨组织,诊断为“骨化性气管支气管病”(图4)。入院后立即予以抗感染(阿莫西林氟氯西林+左氧氟沙星)、止血(止血芳酸+止血敏注射液+血凝酶)、吸氧等对症支持治疗,并急诊行支气管动脉造影及栓塞术止血,术后予以抗感染(去甲万古霉素+头孢噻利)、药物止血、化痰及对症治疗。术后患者无咯血、咳嗽、咳痰,病情改善出院。

图1 胸部CT纵隔窗:气管壁增厚,欠光整,可见点条状钙化,气管环变形Fig.1 CT mediastinal window of the chest:thickening of the tracheal wall,under-smooth,spot-like calcification,and deformation of the tracheal ring
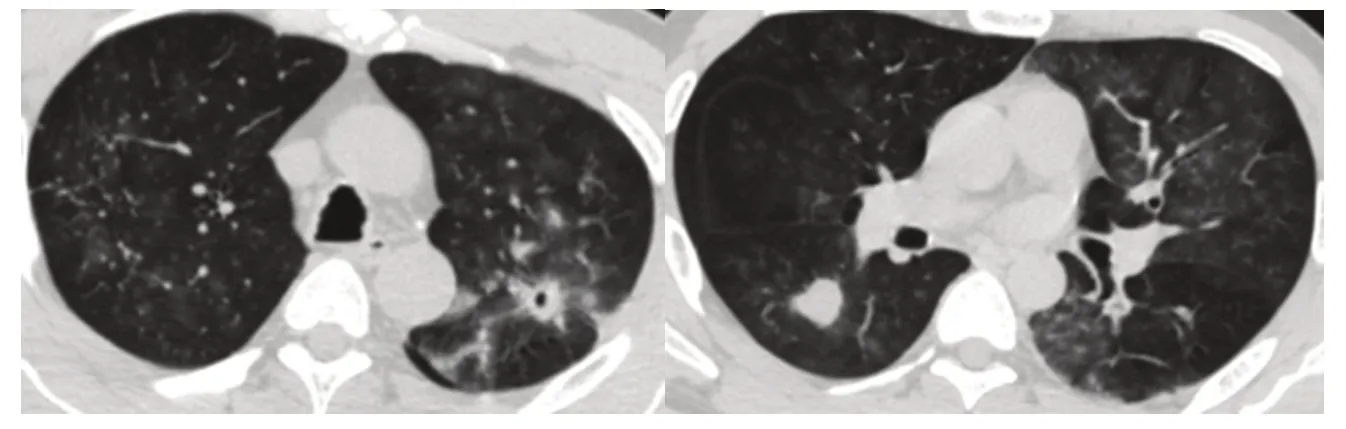
图2 胸部CT肺窗:左上叶纤维空洞形成,右下叶背段团块状高密度影Fig.2 CT pulmonary window of the chest:fibrous cavity formed in the upper left lobe,and the dorsal segment of the right lower lobe had a mass-like high-density shadow

图3 支气管镜检查:气管前壁和侧壁弥漫性结节样隆起,膜部不受累,累及右主支气管及右中间支支气管,管腔轻度狭窄Fig.3 Bronchoscopy:diffuse nodular bulge on the anterior and lateral walls of the trachea,the membranous part was not involved,involving the right main bronchus and the right middle bronchus,and the lumen was slightly narrowed
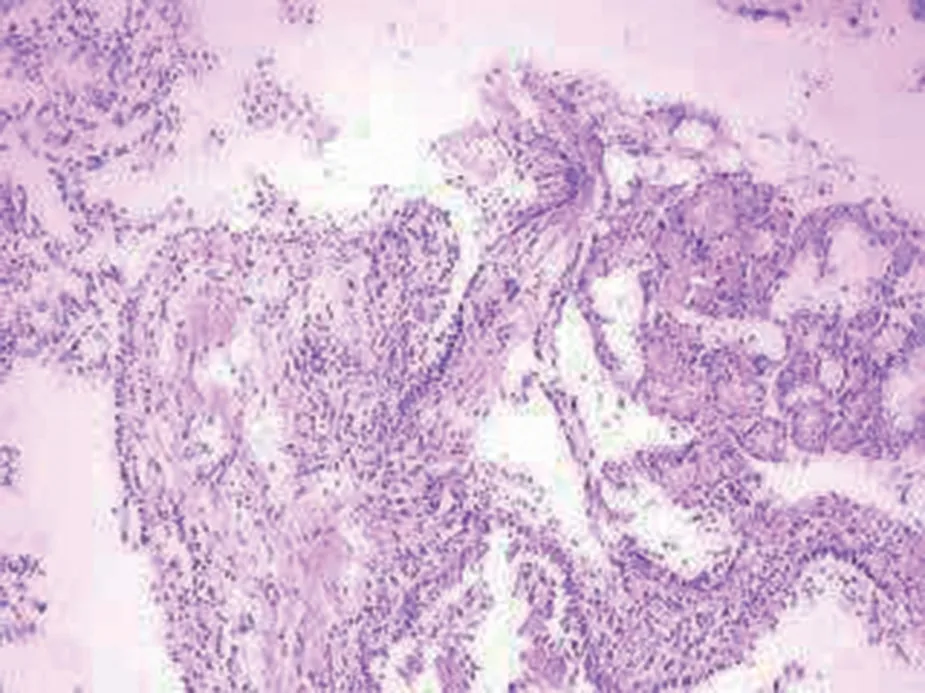
图4 组织活检:组织被覆鳞状上皮,可见大量炎性细胞浸润,另见灶性软骨及骨组织(HE:100×)Fig.4 Tissue biopsy:the tissue was covered with squamous epithelium,and a large number of inflammatory cell infiltration can be seen.Also,focal cartilage and bone tissue can be seen(HE:100×)
患者出院后随访一年,患者有咳嗽、咳痰,无咯血,入院查体无异常。血气分析、肝肾功能、电解质、凝血功能、肿瘤标志物、血沉、降钙素原等均未见异常,肺功能结果示:FVC:3.94 L,FEV1/Pre:83.52%,FEV1/FVC:99.70%,肺通气功能正常范围,血常规:WBC 4.74×109/L,N 0.70,L 0.21,RBC:5.12×1012/L,Hb:145 g/L。胸部CT示:气管壁增厚,欠光整,管壁多发斑点状钙化影,双肺肺纹理增多,部分边缘模糊,左肺上叶见空洞影,右肺下叶见钙化影(图5)。患者肺部病灶较前无明显改善,进一步行CT引导下经皮肺穿刺活检,肺穿刺活检组织报告:镜下见上皮样细胞结节,可见干酪样坏死、纤维组织增生、炎性细胞浸润及朗格汉斯多核巨细胞,考虑结核性病变;建议患者行抗结核治疗,患者拒绝而出院。支气管镜检查:大致同前(图6)。
图5 一年后复查胸部CT,大致同前Fig.5 The chest CT was reviewed one year later,which was roughly the same as before
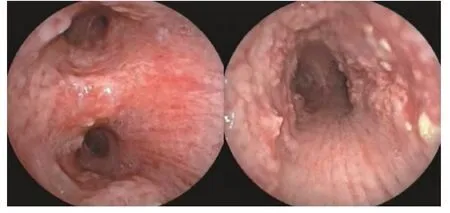
图6 一年后复查支气管镜检查,大致同前Fig.6 The bronchoscopy was reviewed one year later,which was roughly the same as before
2 讨论
骨化性气管支气管病(tracheobronchopathia steochondroplastiesa,TO)亦被称为气管支气管囊性纤维性骨软骨炎或骨形成性气管病。1855年RoRitanky首次在尸检中发现[2],1857年Wilks首次描述该 病的组织病理学特点[3],1896年Vonahroetter经 喉镜 首次诊断该病[4],1964年Screst等正式将其定义为TO[5],1991年国内出现首例报道[2]。该病比较罕见,发病率约为0.05%,好发年龄一般为50岁左右,男女发病比例无明显差异[6]。TO病程较长,可达数月至几年,甚至十几年。
TO的病因及发病机制至今尚未完全明确。其结节形成的理论目前分为两种,第一种是1863年由Virchow提出的气管软骨环外生性软骨瘤或骨疣逐渐钙化和骨化形成,第二种是由Aschoff定义,并由Dalgaard提出的化生理论,这一理论认为结节性病变由黏膜下层和固有层弹性纤维和结缔组织化生和骨化形成[7]。其中骨形成蛋白-2(BMP-2)与转化生长因子β1(TGF-β1)协同促进黏膜下结节的生长,可能在结节的形成过程中起了重要作用[8]。TO与慢性炎症、化学物质刺激、机械刺激、创伤、先天性异常、遗传易感性、代谢紊乱、退行性变性、选择性IgA缺乏症等有关[9]。有学者认为油烟可能也是致病因素之一,但目前缺乏相应的理论支持。本例患者从事卷烟厂工作,长期接触化学性烟雾。
有病例报道部分TO患者合并肺结核或支气管结核,但目前尚不明确结核杆菌是否是TO的直接致病因素。Mittal等[10]研究发现1例喉结核患者继发TO,由此认为结核杆菌可导致TO的发生。本例患者首次入院肺泡灌洗液及痰检未发现结核杆菌,1年后随访行肺穿诊断明确TO合并肺结核,但患者两次胸部CT无明显差异,均可见左肺上叶纤维空洞形成,不能排除首次入院肺泡灌洗液及痰检采取标本部位不全面导致假阴性结果。因此难以判断TO与结核病发展的因果关系。
TO可发生于喉、声门下区、气管、主支气管及右中间段支气管[11]。其临床症状和肺功能与病变范围、管腔阻塞的位置和程度有关。疾病早期大多无症状,随着疾病的进展,部分患者开始出现慢性咳嗽、咳痰、咯血、呼吸困难、胸痛、发音困难等症状。其中慢性咳嗽、咳痰、咯血、呼吸困难最为常见。严重TO可使气管管壁明显僵硬甚至管腔堵塞,导致阻塞性肺炎或肺不张反复发作,体检可闻及喘鸣音。病变累及喉部可出现声音嘶哑、咽干、咽部异物感和吞咽困难。由于这些症状缺乏特异性,往往易漏诊或误诊,少数患者气管插管或尸检时发现。本例患者为骨化性气管支气管病同时合并肺结核,肺功能基本正常,病变位于气管中下段2/3,累及右主及右中间支支气管,其临床表现以咯血、慢性咳嗽、咳痰为主。
TO的诊断可结合肺功能、高分辨CT扫描、支气管镜下特征性表现和病理学特征。TO患者肺功能大部分正常,以气管受累为主的TO患者,可出现不同程度的阻塞性或混合性通气功能障碍,限制性通气功能障碍很少见到,通常由肺不张等原因引起。肺功能的通气-流量曲线对TO的诊断有提示作用,可用于随访患者。
CT能够为TO的诊断提供重要的线索和依据。早期胸部CT可能仅显示气管及支气管管壁增厚、钙化,管腔非外压性变形,病变严重时,可见气管壁弥漫增厚,管壁塌陷,管腔缩小[12]。典型的胸部CT表现为气管及支气管前、侧壁多发的斑点结节状小突起突向管腔,突起相互融合使气道内壁呈“波浪样”改变。
目前通过支气管镜检查获得组织学病理检查是TO诊断的金标准,镜下可见气管的前壁和侧壁多发的孤立性或融合的骨或软骨结节,不累及气管膜部,多为白色或灰黄色,典型的呈鹅卵石样改变,质地较硬,活检时不易钳取。基于支气管镜下结节形态可以分成3类:①散在型:少数结节散在分布,结节之间黏膜正常;②弥漫型:结节弥漫性分布,影响整个黏膜,无正常黏膜区;③融合型:相邻结节样病变互相融合[13]。目前尚无根据病变累及气管、支气管范围的分类方法。本例患者具有TO典型的支气管镜下表现,据结节形态分类属于融合型。TO患者的病理学检查可见气管、支气管黏膜下软骨和骨性结节形成,结节可继发钙化,部分患者结节中包含具有造血功能的骨髓组织,表面覆盖的黏膜出现鳞状上皮化生或不典型增生,黏膜下可见淋巴细胞、中性粒细胞等炎症细胞浸润[14]。组织病理学检查对TO具有进一步确诊的作用,尤其对TO和其他气道结节性疾病的鉴别诊断非常重要。
TO主要需与气管支气管淀粉样变(TA)鉴别,该病常以多灶性黏膜下斑块的形式,因淀粉样物质的沉积导致血管脆性增加,故咯血较常见,活检时容易出血,病理学组织活检刚果红染色及偏振光显微镜双阳性作为诊断TA的金标准[15-16]。其他还需与支气管结核、老年性气管支气管软骨钙化、支气管结石病、气管内乳头状瘤或纤维瘤、软骨肉瘤、韦格纳肉芽肿、错构瘤、结节病、复发性多软骨炎等疾病相鉴别[17]。
目前TO的治疗缺乏统一的指南,主要为对症治疗。对有症状的患者,可给予抗感染、止咳、引流气道分泌物、吸入支气管舒张剂和糖皮质激素等对症处理。肺泡灌洗液(BALF)培养及药敏试验检查所确定的导致反复呼吸道感染的病原菌,有助于指导抗生素使用。空气湿化及黏液溶解剂可改善症状。有报道[18]认为吸入糖皮质激素可减轻气道炎性反应,逆转黏膜上皮细胞的化生,可能具有一定的治疗效果。另外,如有气道狭窄导致的呼吸困难,可采用支气管镜下介入治疗,包括电凝、激光、冷冻消融、硬质支气管镜下扩张手术及支架植入术等,必要时可行外科手术清除病灶,改善通气功能,减轻症状,提高患者生活质量。
综上所述,TO是一种良性病变,病程较长,预后良好,临床上常因无特异性症状而被漏诊、误诊。当患者出现慢性咳嗽、不明原因的咯血、难以解释的呼吸困难或喘息、反复发生肺部感染及叶段肺不张等症状,同时胸部CT扫描提示气管前壁及两侧壁黏膜不规则增厚或钙化时,需高度怀疑TO。支气管镜和组织病理学检查可明确诊断。目前有关TO的病例报道仍较少,发病机制尚不明确,需进一步积累更多病例及进行多中心、前瞻性研究,为TO的规范诊断和治疗提供依据。

