南果梨乙烯信号转导途径转录因子EIN3的克隆及与EBF的互作验证
赵佳明,刘娇娇,王爱德,袁 晖
(沈阳农业大学园艺学院/辽宁省果品采后生物学重点实验室/设施园艺教育部重点实验室,沈阳 110161)
南果梨是典型的呼吸跃变型果实,在室温贮藏条件下果实软化较快,严重影响其货架期和经济价值。呼吸跃变型果实的成熟过程主要受乙烯调控[1]。乙烯的合成受合成途径及信号转导途径的共同调控[2]。在信号转导途径中,EIN2(ethylene insensitive 2)将乙烯信号途径传递至细胞核内的EIN3[3-4]。EIN3是一类植物特有的位于细胞核内的乙烯信号转导元件,其编码基因属于一个小的转录因子基因家族[5]。关于EIN3的作用机制的研究仍主要集中于模式植物拟南芥。在拟南芥的生长发育过程中,EIN3的mRNA水平基本不变,蛋白水平随着生长发育阶段不断发生变化[6]。随着乙烯处理时间的增长,EIN3在细胞核中的积累量逐渐增多,并且用MG132(蛋白酶体抑制剂)处理之后,EIN3在细胞核中的积累量也逐渐增多[3]。说明EIN3蛋白水平的变化可能受翻译后修饰的调控。目前的研究认为,EIN3蛋白水平的变化主要受泛素化途径的调控。泛素化是普遍存在于真核生物中的一种翻译后修饰途径,参与调控细胞内多数生命活动过程[7]。泛素化的发生需要泛素激活酶(ubiquitin-activating enzyme,E1)、泛素结合酶(ubiquitin-conjugating enzyme,E2)和泛素连接酶(ubiquitin ligase,E3)的共同参与[8],其中SCF复合体是最常见的一类E3泛素连接酶[9]。而F-box作为E3泛素连接酶的组分之一,负责特异地与底物结合,最终引起泛素化降解[10]。
在乙烯不存在的情况下,EIN3迅速被泛素标记进而被26S蛋白酶体降解;在有乙烯存在的情况下,EIN3的泛素化降解途径受到抑制,EIN3在细胞核中大量积累[11-12],并与下游基因的启动子结合,激活乙烯反应,促使乙烯大量生成。在EIN3泛素化降解过程中,负责与EIN3识别的有2个F-box蛋白,EBF1和EBF2[13]。拟南芥中的EBF1和EBF2的N端都具有核定位序列(nuclear localization sequence,NLS),并且表达量受到乙烯的诱导[14]。但是EBF1和EBF2却有不同的功能,EBF1主要在乙烯不存在的情况下和黄化苗对乙烯反应的初始阶段发挥作用[15]。并且EIN3能够与EBF2基因的启动子结合进而对乙烯信号途径进行反馈调节[16]。EBF组成的SCF复合体作为一种E3泛素连接酶泛素标记EIN3,并进而被26S蛋白酶体降解,这一点在拟南芥中已经得到证实,但在南果梨中仍无关于EIN3被泛素化降解的相关研究。本研究克隆南果梨中的EIN3和EBF,并对其互作关系进行验证,为从分子水平调控果实软化提供理论依据。
1 材料与方法
1.1 材料
供试南果梨(Pyrus ussuriensiscv.Nanguo)果实采摘于辽宁省鞍山市宇昊生态红梨种植专业合作社。试验所用乙烯利(Ethephon,有效成分含量40%)和1-甲基环丙烯(1-MCP,纯度99%)均购自生工生物工程(上海)股份有限公司。试验所用的载体pGBKT7和pGADT7以及所用的酵母菌株Y2H Gold均购于大连宝生物有限公司。试验采用的荧光定量PCR仪(qTOWER3G)为德国生产;气象色谱(Agilent 7890A)为美国生产。
1.2 方法
1.2.1 材料处理于花后135d挑选形态大小均等,品相相近,无病虫害且无明显伤痕的果实进行采摘。采后当天对果实进行乙烯和1-MCP处理,以采后未作任何处理的果实作为对照,每个处理30个果实。1-MCP处理是将果实放入密封的容器中摆放均匀,互相之间留有空隙,防止果与果之间相互影响,向容器中注入1-MCP至终浓度为1μL·L-1,并于室温(25℃)下放置24 h。乙烯处理是将果实放入1mL·L-1乙烯利溶液中浸泡30s后取出,放入一密闭容器中并于室温下放置24h。处理结束后将果实取出,并于室温下贮藏。
分别在采后0,5,10,15d取果实测定果实硬度和乙烯生成量;选取5个果实,将果肉切片后于液氮中冷冻,放置于-80℃冰箱内进行后续的基因克隆及表达分析。
1.2.2南果梨果实乙烯生成量和硬度的测定果实乙烯生成量的测定参照TAN的方法进行[18]。分别在采后0,5,10,15d时,选取10个果实,每2个果实称重后放置于体积为1L的密闭容器内,室温下1h后用注射器从密封容器中抽取1mL的气体,每个容器抽取3次为一组,密封好后待测。
利用气相色谱仪(Agilent,7890A)测定乙烯含量,所用的气相色谱仪柱为S毛细管色谱柱,型号为HP-AL/S(19095P-S25,Agilent)。柱箱、检测器和进样口的温度分别为110,120,180°C。载气为氢气,尾吹气为氮气,其流速均为40mL·min-1。
果实硬度测定参照YUAN的方法[17]。分别在采后0,5,10,15d检测果实的硬度,每次测5个果实。沿待测南果梨果实赤道均匀选取4个点,用刀将果皮切去(每一块果皮的横截面直径约1cm),将硬度计(FT-327,Fac⁃chini,Italy)直径为11mm的探头垂直果面,用力均匀插进果肉约1cm处,读取表盘显示的数值,并计算出果肉的硬度(N)。
1.2.3PuEIN3的克隆及表达分析根据NCBI数据库(https://www.ncbi.nlm.nih.gov/)中得到的PuEIN3的全长序列设计克隆引物(引物序列见表1),以南果梨贮藏期的cDNA混样为模板,对PuEIN3进行基因克隆。将所得的PCR产物进行琼脂糖凝胶电泳,纯化以及转化测序最终确定所得的基因序列是否正确。
利用http://primer3.ut.ee/网站根据PuEIN3序列设计表达引物(引物序列见表1)。利用实时荧光定量PCR方法,以南果梨处理和未处理的贮藏期的cDNA为模板检测PuEIN3的表达水平。PCR反应程序为:95℃3min,95℃10s,58℃30s,72℃30s,40个循环,收集荧光信号;55℃30s,生成溶解曲线。每个样品3次生物学重复,最后根据公式2-△△Ct法计算基因的相对表达量。
1.2.4PuEBF1和PuEBF2的克隆及表达分析根据前期南果梨转录组测序结果中得到的2个EBF的序列设计全长引物对基因进行克隆(引物序列见表1)。基因克隆及表达分析方法同PuEIN3。
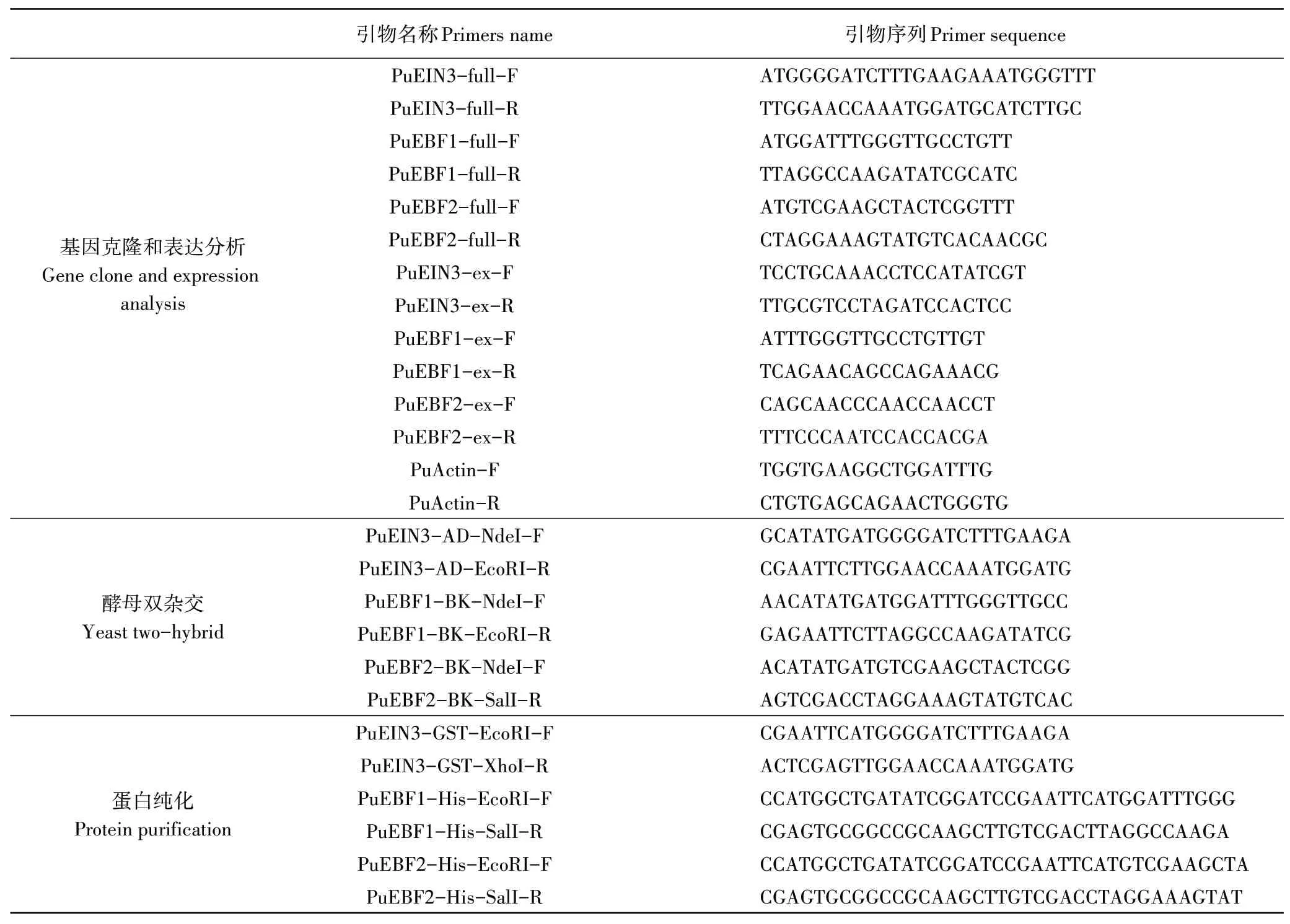
表1 本研究所用引物序列Table 1 The primers used in this research
1.2.5 PuEIN3与PuEBF1和PuEBF2的互作验证
1.2.5.1 酵母双杂交实验酵母双杂交参照YUAN的方法进行[19],将PuEBF1和PuEBF2的编码区分别连接到载体pGBKT7(Clontech,CA,USA),PuEIN3的编码区连接到载体pGADT7(Clontech,CA,USA)。将含有目的基因的载体共转化至酵母菌株Y2H Gold(Clontech,CA,USA),涂到DDO(SD/-Trp/-Leu)培养基上,28℃培养3d。待长出单菌落之后将单菌落溶于0.9%NaCl溶液中,分别滴于QDO(SD/-Trp/-His/-Leu/-Ade)/X-α-gal(Clontech,CA,USA)培养基上,观察菌斑颜色变化。
1.2.5.2 Pull down实验将PuEBF1和PuEBF2分别构建至pEAZY-E1载体,PuEIN3构建至pGEX4T-1载体。将构建好的载体进行转化,提取质粒并导入大肠杆菌BL21(DE3)感受态细胞中(cat.no.CD601-02,全式金,北京),放置于37℃培养箱中培养12h。通过PCR扩增筛选出阳性克隆的菌落。转化成功后进行标签融合蛋白的诱导,通过SDS-PAGE电泳检测蛋白是否诱导成功。纯化诱导成功后的蛋白。
纯化出GST标签的蛋白,与GST(阴性对照)蛋白质分别加入到含有His标签蛋白的柱料中(Ni-NTA Resin),孵育1h;孵育过后用SBB buffer洗脱未结合的蛋白3次,然后用SEB buffer洗脱蛋白质,最后用Anti GST抗体对其进行Western blot检测确定2个目的蛋白是否存在互作[20-21]。
2 结果与分析
2.1 乙烯和1-MCP处理对采后南果梨果实乙烯生成量和硬度变化的影响
试验结果显示,在贮藏期间南果梨果实的乙烯生成量逐渐升高,果实硬度逐渐下降;并且乙烯生成量明显的受到1-MCP处理的抑制和乙烯的促进(图1)。
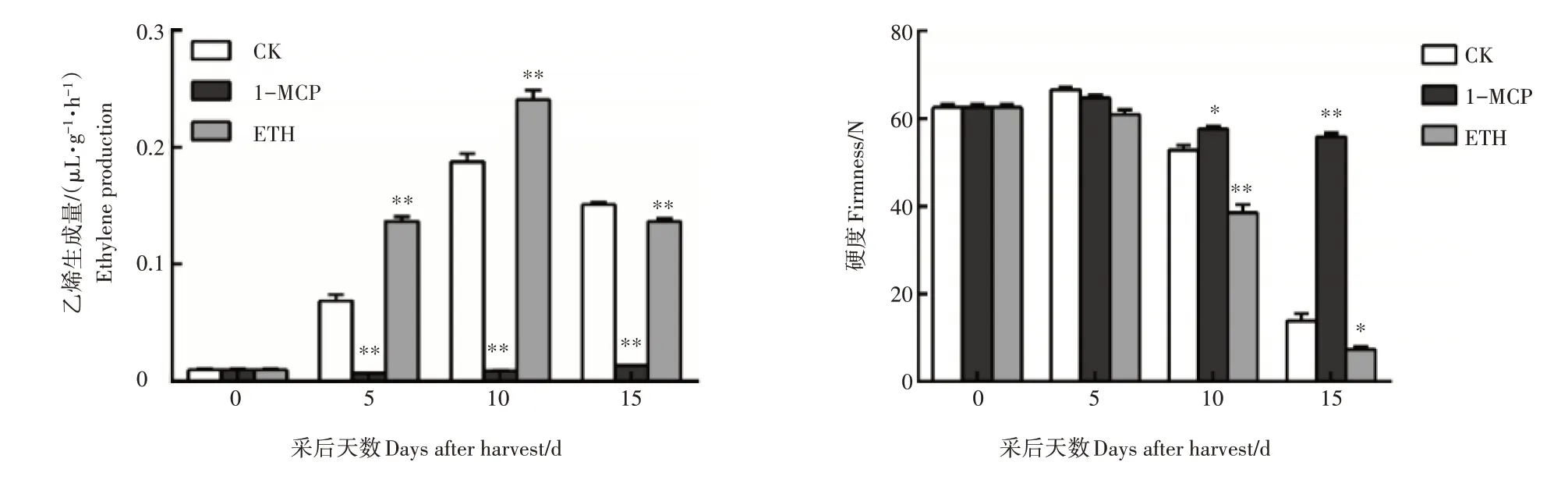
图1 南果梨贮藏过程中乙烯及硬度变化Figure 1 The changes of ethylene production and firmness in post-harvest stage of Nanguo pear
2.2 PuEIN3的克隆及表达分析
试验结果显示,PuEIN3全长序列为1824 bp,编码607个氨基酸,蛋白质分子量约为72.84kD。拟南芥EIN3有5个基本的结构域(basic domain,BD)[5]:BD I 53~66,BD II 88~94,BD III 238~248,BD IV 265~274,BD V 378~384。对克隆得到的PuEIN3序列进行分析发现,该序列也包含着5个结构域(图2),可见克隆的梨的EIN3序列是正确的。

图2 PuEIN3的结构域分析Figure 2 Structural domain analysis of PuEIN3
对PuEIN3在南果梨贮藏期的表达特性分析结果表明,PuEIN3的的表达量无明显变化规律(图3)。由此推测,PuEIN3的表达是受翻译后调控。
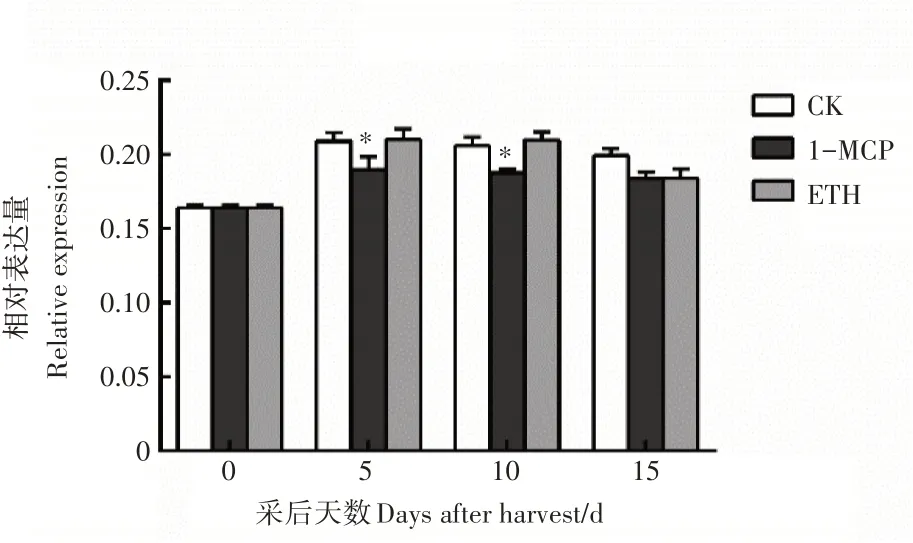
图3 果实成熟关键基因PuEIN3的表达分析Figure 3 Expression analysis of the key gene in fruit ripening PuEIN3
2.3 PuEBF1和PuEBF2的克隆及表达分析
为验证PuEIN3是否受泛素化调控,克隆了负责与EIN3识别的2个F-box基因,命名为PuEBF1和PuEBF2。PuEBF1全长1875bp,编码624个氨基酸;PuEBF2全长1941bp,编码646个氨基酸。对2个基因在梨贮藏过程中的表达特性分析结果表明,实时荧光定量PCR发现PuEBF1的表达量受到1-MCP的抑制和乙烯的促进,而PuEBF2基因表达并无明显规律(图4)。
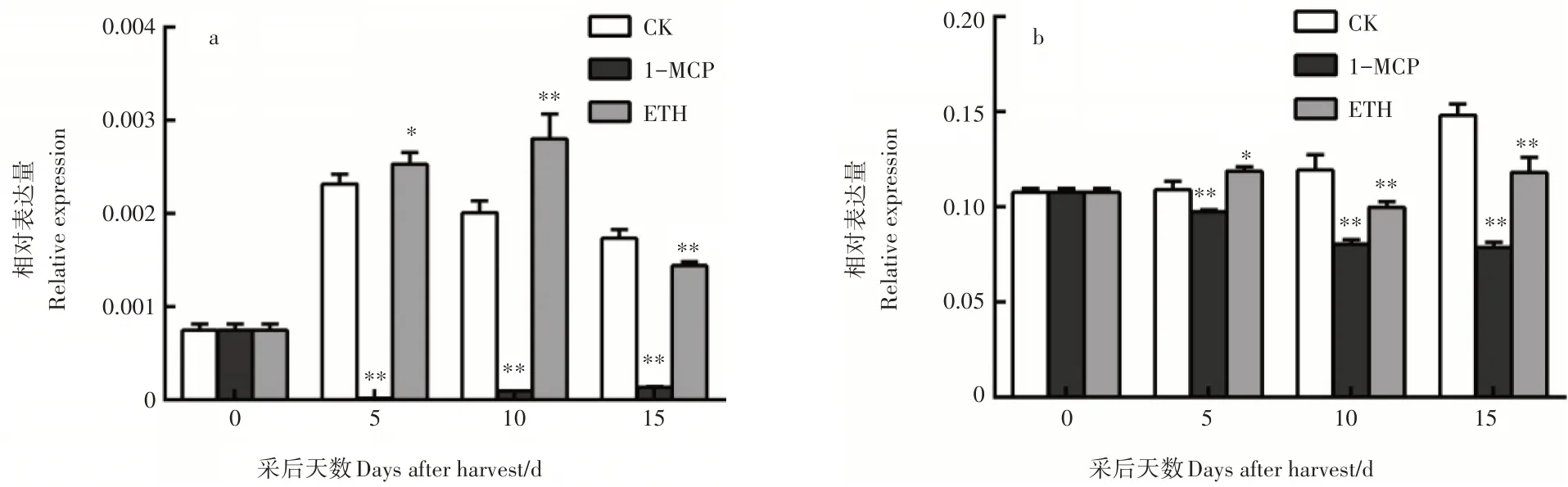
图4 PuEBF1(a)和PuEBF2(b)的表达分析Figure 4 Expression analysis of PuEBF1(a)and PuEBF2(b)
2.4 PuEIN3与PuEBF1和PuEBF2的互作验证
2.4.1 酵母双杂交实验验证PuEIN3与PuEBF1和PuEBF2互作为研究PuEIN3是否能够与负责对其标记泛素的EBF结合,从而被泛素化降解,进行了后续的实验。酵母双杂交实验结果显示,含有PuENI3和PuEBF1和PuEBF2的菌株在含有X-α-gal的QDO培养基上能够变蓝(图5),说明PuEIN3能够与PuEBF1和PuEBF2互作。

图5 PuEBF1、PuEBF2与PuEIN3互作的酵母双杂交实验Figure 5 Yeast two-hybrid experiment of PuEBF1,PuEBF2 and PuEIN3 interaction
2.4.2 Pull down实验验证PuEIN3与PuEBF1和PuEBF2互作为进一步确定PuEBF1和PuEBF2与PuEIN3蛋白的互作关系,设计了Pull down实验。先分别纯化出PuEBF1-His、PuEBF2-His和PuEIN3-GST蛋白,用PuEBF1-His、PuEBF2-His蛋白挂柱,加入PuEIN3-GST蛋白孵育1h,然后利用SEB洗脱并用Western-blot检测,实验结果发现当同时加入PuEIN3-GST蛋白(图6),PuEBF2-His和PuEIN3-GST蛋白(图7)洗脱下的蛋白泳道同时检测到His及GST信号,然而加入GST空载体对照只检测到His信号。可见,PuEBF1和PuEBF2与Pu⁃EIN3蛋白存在互作。
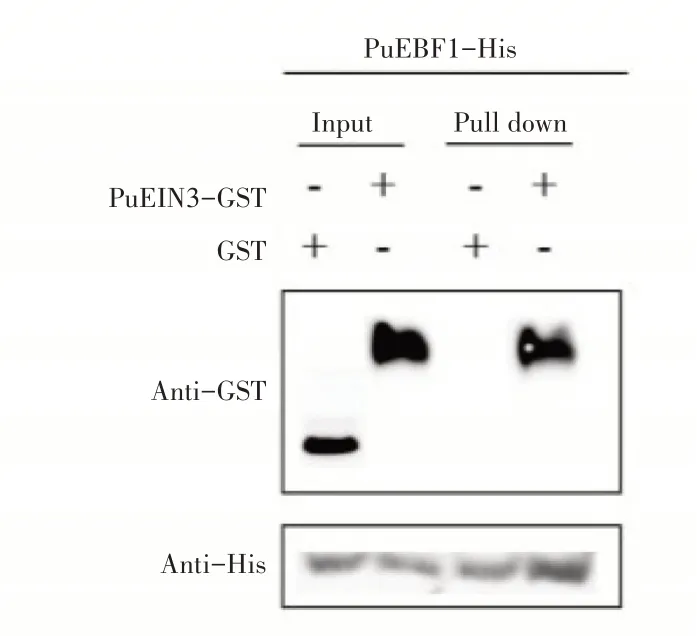
图6 PuEBF1与PuEIN3互作的Pull down实验Figure 6 Pull down experiment of PuEBF1 and PuEIN3 interaction
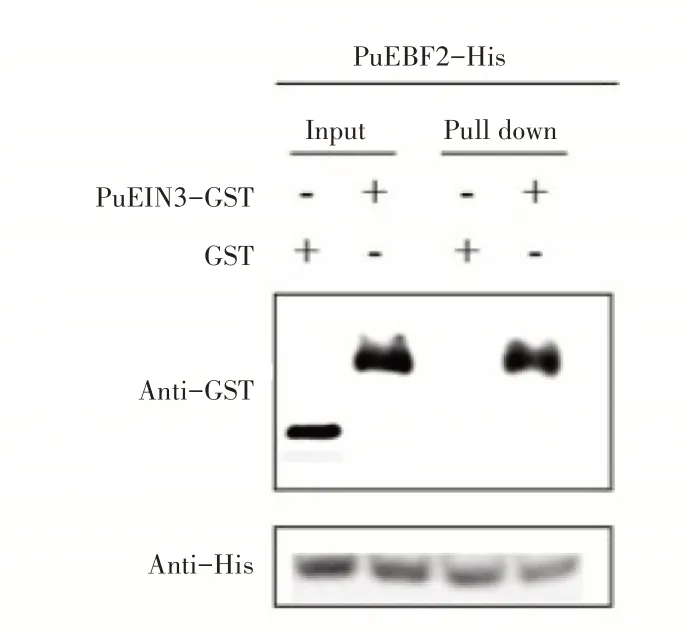
图7 PuEBF2与PuEIN3互作的Pull down实验Figure 7 Pull down experiment of PuEBF2 and PuEIN3 interaction
3 讨论与结论
乙烯作为一种重要的激素参与植物生长发育的众多过程,南果梨是典型的呼吸跃变型果实,其成熟过程主要受乙烯调控。EIN3是乙烯信号转导途径的重要的转录因子,但是其表达模式以及是否受泛素化途径调控在南果梨中仍无相关报道。
EIN3属于EIL(EIN3-like)转录因子家族,在植物的生长发育过程中发挥重要作用[22]。CHAO等[5]首次从乙烯不敏感拟南芥突变体中鉴定得到EIN3,不同的物种中其家族基因的数目也不尽相同,如拟南芥中有6个,而在烟草、番茄和水稻中分别含有5个、4个和6个[23-25]。有研究发现,当EIN3和EINL1基因同时被突变掉之后,拟南芥在黄化苗时期和成年植株期都表现出对乙烯不敏感,说明EIN3在乙烯反应过程中起到正调控作用[6]。梨的栽培种非常多,主要栽培种有白梨、沙梨、秋子梨和西洋梨。目前,针对白梨、沙梨和西洋梨典型的栽培品种已完成全基因组测序[26-28]。但是呈现的测序结果中并无关于EIL家族基因的信息,而且南果梨属于秋子梨品种,与其他3个种遗传背景差异非常大,因此如若参考其他梨的基因组会存在一定的偏差。鉴于此种情况,准确的鉴定南果梨中是否存在多个EIL基因急需对南果梨进行全基因组测序,目前我们正在开展南果梨基因组的测序工作,后续会展开相应的分析。
不同植物中的EIN3和EILs的表达模式存在一定的差异。猕猴桃的AdEIL2和AdEIL4的表达量随着果实成熟不断升高,并且受到乙烯的诱导[29]。在受到250mg·L-1乙烯利处理后,葡萄VvEIL6的表达量显著上升,而VvEIL2和VvEIL5的表达却在乙烯抑制剂的处理下显著增加[30]。香蕉的MA-EIL2随着果实成熟表达量逐渐升高,并且受到乙烯的诱导[31]。黄金梨中的PpEIN3b在果实中大量表达,并且受到ACC(1-aminocyclopropane-1-carboxylic acid)处理的促进和水杨酸的抑制[32]。南果梨中的EIN3的转录表达水平在果实贮藏期基本不发生变化,同样也不受乙烯的调控。这点与黄金梨中的PpEIN3b存在一定的差异,推测可能是因为南果梨中存在其他与PpEIN3b表达模式相同的基因。
泛素化是一种普遍存在于生物中的蛋白质翻译后修饰方式,参与众多生命活动[33]。目前的研究认为,作为乙烯信号转导途径的重要转录因子,EIN3蛋白水平的变化主要受泛素化途径的调控。拟南芥中EIN3的mRNA的表达水平不受乙烯的调控,但蛋白水平受到ACC处理的诱导[3],这为EIN3受泛素化途径调控提供了直接证据。南果梨中EIN3的表达模式与拟南芥中类似,推测PuEIN3的蛋白水平变化同样受泛素化途径的调控,但仍需要检测PuEIN3的蛋白水平变化来进一步验证。
拟南芥中的研究表明在乙烯信号途径中负责与EIN3识别的有2个F-box基因,分别为EBF1和EBF2[4]。EBF1和EBF2在蛋白水平能够与EIN3互作,并且在EBF1和EBF2突变的拟南芥植株中EIN3的蛋白表达水平大幅度升高;而当过表达EBF1和EBF2时,几乎检测不到EIN3的蛋白表达[3-5]。这为EIN3被标记泛素并被26S蛋白酶体降解进一步提供了理论依据。南果梨中同样存在2个EBF蛋白,PuEBF1和PuEBF2。酵母双杂交实验和Pull down实验验证PuEBF1和PuEBF2能够分别与PuEIN3在蛋白水平互作,这为PuEIN3能够被泛素化降解提供了初步的理论依据。
PuEIN3的表达水平在果实贮藏期基本不发生变化,并且能够与PuEBF1和PuEBF2在蛋白水平互作,推测其受泛素化途径调控,但仍需进一步验证。本研究为从分子水平调控果实成熟提供一定的理论依据。

