超声引导下RISS阻滞对胸腔镜手术患者术后镇痛的影响
刘慧,刘玉林,唐霓
(西南医科大学附属医院 麻醉科,四川 泸州646000)
随着胸科手术微创技术的发展,胸腔镜手术被证明可降低术后疼痛、改善肺功能[1],但仍有约78%患者存在中、重度疼痛[2]。疼痛不仅影响呼吸功能,且对免疫系统、心血管系统、胃肠系统、血液系统、认知功能等均有不利影响[3]。近年来由于多模式镇痛的倡导和超声技术的发展,新兴的筋膜平面阻滞发展潜力不容忽视。RISS 阻滞是2018年由ELSHARKAWY 等[4]提出的一种新的胸壁和上腹部镇痛方法,国外研究表明RISS 平面阻滞可用于开胸手术、肺移植、上腹部手术、乳腺手术等术后镇痛[4-7],但仅有个案报道。切口局部麻醉(以下简称局麻)简单、安全,但用于胸科手术术后镇痛仍差强人意。为进一步评估RISS 平面阻滞在胸外科手术中的安全性和有效性,本研究比较了超声引导下RISS 阻滞联合静脉自控镇痛(patient-controlled intravenous analgesia, PCIA)与切口局麻联合PCIA 的临床疗效,为临床胸外科手术患者术后镇痛提供新的选择。
1 资料与方法
1.1 一般资料
选取2019年7月—2019月11月于西南医科大学附属医院择期行胸腔镜手术的患者60 例。患者年龄18~70 岁,美国麻醉医师协会(ASA)分级Ⅰ级、Ⅱ级。排除标准:严重心肺基础疾病史,严重肝、肾功能障碍,麻醉药物及局麻药过敏史,严重精神病史,脊柱胸廓畸形,凝血功能障碍,穿刺局部感染,长期服用镇痛药物,既往有肺部手术史,不能正常沟通交流,患者中转开胸,术后转入重症监护室,观察20 min 无麻醉平面。根据不同麻醉方法将患者分为RP 组和LP 组,RP 组患者采用RISS 阻滞联合PCIA,LP 组患者采用切口局麻联合PCIA,各30 例。本研究获得医院伦理委员会批准(伦理号:KY2019140),并在中国临床试验注册中心注册(注册号:ChiCTR1900022272),患者均知情同意。
1.2 方法
术前1 天指导患者正确使用视觉模拟评分(visual analogue scale, VAS)。患者入手术室后,行常规心电监护,开通静脉通路。RP 组患者行超声引导下的RISS 平面阻滞,操作方法:嘱患者侧卧位,皮肤消毒后,将高频线阵探头在T4/5水平沿着肩胛骨内侧缘呈斜矢状位放置,在超声图像上由浅入深依次为:斜方肌、菱形肌、肋间肌、胸膜及肺(见图1)。采用平面内技术由内向外的方向进针,当针尖到达菱形肌与肋间肌之间,回抽无血、无气体后注入3 ml 生理盐水,确认位置并撑开筋膜后注入0.4%罗哌卡因20 ml。然后将超声探头向下外侧移动至T7/8水平,即肩胛下角远端腋后线后方,超声图像上由浅入深依次为:背阔肌、前锯肌、肋间肌、胸膜及肺(见图2),以同样方法进针,当针尖到达前锯肌与肋间肌之间,回抽无血、无气体后注入3 ml 生理盐水,确认位置后注入0.4%罗哌卡因20 ml。观察20 min 后,用针刺测试患者锁骨中线水平疼痛感觉并记录麻醉平面。随后行麻醉诱导,对照组不行神经阻滞,仅在手术结束缝合切口时由手术医生用0.4%罗哌卡因5 ml 行切口局麻。

图1 菱形肋间肌平面阻滞超声图

图2 经前锯肌下平面阻滞超声图
麻醉诱导和维持:盐酸戊乙奎醚0.01 mg/kg,舒芬太尼0.4μg/kg,丙泊酚2.0~2.5 mg/kg,顺阿曲库铵0.2 mg/kg,到达麻醉深度后插入双腔支气管导管,经纤支镜确认位置后妥善固定连接麻醉机控制通气。患者麻醉维持均采用七氟烷(1.5%~4%)吸入,瑞芬太尼[0~0.2 μg/(kg·min)]、顺阿曲库铵[2~3 μg/(kg·min)]泵注。麻醉深度维持在40~60,呼气末CO2维持在35~45 mmHg。术中根据平均动脉压(MAP)上下波动≤20%,调整七氟烷和瑞芬太尼用量。如MAP 波动>20%基础值,则调整七氟烷和瑞芬太尼剂量及输液速度,经以上处理后若无改善且持续约3 min,则予以血管活性药物(多巴胺、去甲肾上腺素等)。心率<50 次/min 时给予阿托品0.3~0.5 mg 静脉注射。患者手术结束前30 min 均停止泵注肌松药,手术结束前20 min 给予舒芬太尼5 μg+地佐辛5 mg+托烷司琼4.48 mg 静脉注射。在缝合切口时停止所有麻醉药物。术毕常规给予新斯的明(0.02 mg/kg) 和阿托品(0.01 mg/kg)拮抗残余肌松药。待患者潮气量达到6 ml/kg,呼吸频率>12 次/min 且呼之能睁眼,能按指令活动后拔出气管导管,将患者转运至麻醉后监测治疗室(post-anesthesia care unit,PACU),连接PCIA。PCIA 配制:舒芬太尼100μg+地佐辛15 mg+托烷司琼13.44 mg+生理盐水共200 ml 泵注,背景剂量为3 ml/h,自控追加剂量2 ml/次,锁定时间为15 min。PACU 期间若患者VAS 评分>4 分,则给予舒芬太尼5μg/次。回病房后VAS 评分>4 分,若患者要求给予额外镇痛药物,则肌内注射地佐辛5 mg作为补救镇痛。
1.3 观察指标
术中舒芬太尼、瑞芬太尼用量;血管活性药物使用情况;入PACU 时及术后2 h、6 h、12 h、24 h 的静息和咳嗽时的VAS 评分及各时间点咳嗽能力评分;24 h 内舒芬太尼消耗总量;镇痛泵按压次数;术后24 h 内给予补救性镇痛情况;术后PACU停留时间;术后首次活动时间;引流管拔除时间;术后住院时间;术后患者的满意度;术后不良反应如恶心、呕吐、皮肤瘙痒、呼吸抑制、低血压及神经阻滞相关并发症等。
咳嗽能力评分0 分:嘱患者咳嗽,患者无咳嗽动作;1 分:可听见气流经过人工气道,但未听见咳嗽声音;2 分:可听见较弱的咳嗽声音;3 分:较清楚的咳嗽声音;4 分:较强的咳嗽声音;5 分:连续多次较强的咳嗽声音[8-9]。本研究定义咳嗽能力0~1 分为差,2~3 分为中等,4~5 分为强。
患者术后满意度1 分:非常不满意;2 分:不满意;3 分:满意;4 分:非常满意。
1.4 统计学方法
数据分析采用SPSS 23.0 统计软件,计量资料以均数±标准差(±s) 或中位数和四分位数[M(P25,P75)]表示,比较用t检验、重复测量设计的方差分析或秩和检验;计数资料以构成比或率(%)表示,比较用χ2检验。P<0.05 为差异有统计学意义。
2 结果
RP 组患者均顺利完成神经阻滞,20 min 后用针刺测试疼痛感觉确定麻醉平面。以锁骨中线为准,RP 组患者的麻醉平面上端达T3/4,下端达T8/9。
2.1 两组患者一般情况比较
两组患者性别构成、年龄、身高、体重、ASA分级构成、手术时间、输液量及失血量比较,差异无统计学意义(P>0.05)。见表1。
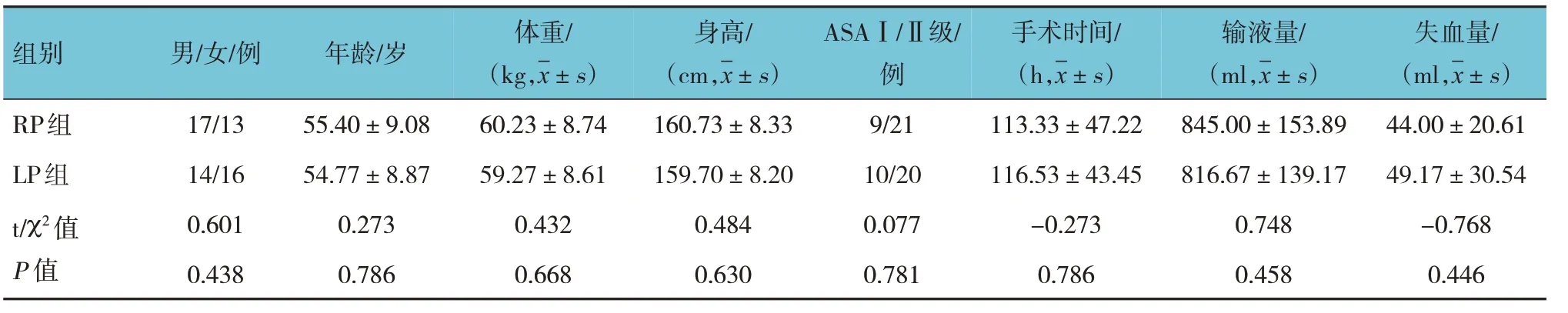
表1 两组患者一般情况比较 (n=30)
2.2 两组患者手术类型及术中用药情况比较
两组患者手术方式、单/双孔构成比、舒芬太尼用量及血管活性药物使用率比较,差异无统计学意义(P>0.05);两组患者瑞芬太尼用量比较,差异有统计学意义(P<0.05),RP 组较LP 组低。见表2。

表2 两组患者手术类型及术中用药情况比较 (n=30)
2.3 两组患者各时间点VAS评分比较
两组患者入PACU时及术后2 h、6 h、12 h及24 h静息状态下VAS评分比较,经秩和检验,差异有统计学 意 义(Z=-4.426、-4.197、-4.254、-2.444 和-1.966,P=0.000、0.000、0.000、0.015 和0.049),RP组均低于或等于LP 组。两组患者入PACU 时及术后2 h、6 h、12 h 及24 h 咳嗽时VAS 评分比较,差异有 统计学意义(Z=-3.085、-3.021、-3.599、-2.255 和-2.094,P=0.002、0.003、0.000、0.024 和0.036),RP 组均低于或等于LP 组。RP 组患者入PACU 时及术后2 h、6 h、12 h及24 h咳嗽时与静息状态下VAS 评分比较,差异均有统计学意义(Z=-3.602、-5.755、-6.089、-5.879 和-5.688,均P=0.000),咳嗽时较静息状态下高。LP 组患者入PACU 时及术后2 h、6 h、12 h 及24 h 咳嗽时与静息状态下VAS 评分比较,差异均有统计学意义(Z=-3.353、-4.695、-5.987、-5.580和-5.382,P=0.001、0.000、0.000、0.000 和0.000)。咳嗽时较静息状态下高。见表3。

表3 两组患者各时间点VAS评分比较 [n=30,M(P25,P75)]
2.4 两组患者咳嗽能力评分比较
两组患者在入PACU 时及术后2 h、6 h、12 h及24 h 的咳嗽能力评分比较,经重复测量设计的方差分析,结果:①不同时间的咳嗽能力评分无差异(F=0.760,P=0.556);②两组患者咳嗽能力评分有差异(F=19.753,P=0.000);③两组患者咳嗽能力评分变化趋势无差异(F=2.365,P=0.064)。见表4。
表4 两组患者咳嗽能力评分比较 (n=30,±s)
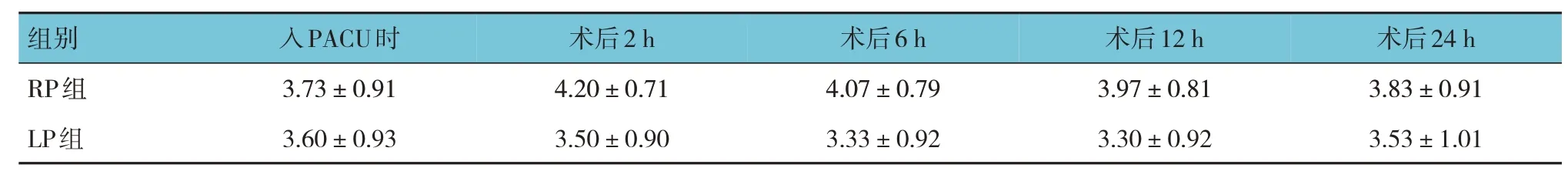
表4 两组患者咳嗽能力评分比较 (n=30,±s)
组别RP组LP组入PACU时3.73±0.91 3.60±0.93术后2 h 4.20±0.71 3.50±0.90术后6 h 4.07±0.79 3.33±0.92术后12 h 3.97±0.81 3.30±0.92术后24 h 3.83±0.91 3.53±1.01
2.5 两组患者术后镇痛药物使用情况及满意度比较
两组患者术后舒芬太尼用量、24 h 镇痛泵按压次数、补救性镇痛及满意度比较,差异有统计学意义(P<0.05),RP 组术后舒芬太尼用量、24 h 镇痛泵按压次数较LP 组少,补救性镇痛较LP 组低,满意度较LP 组高。见表5。
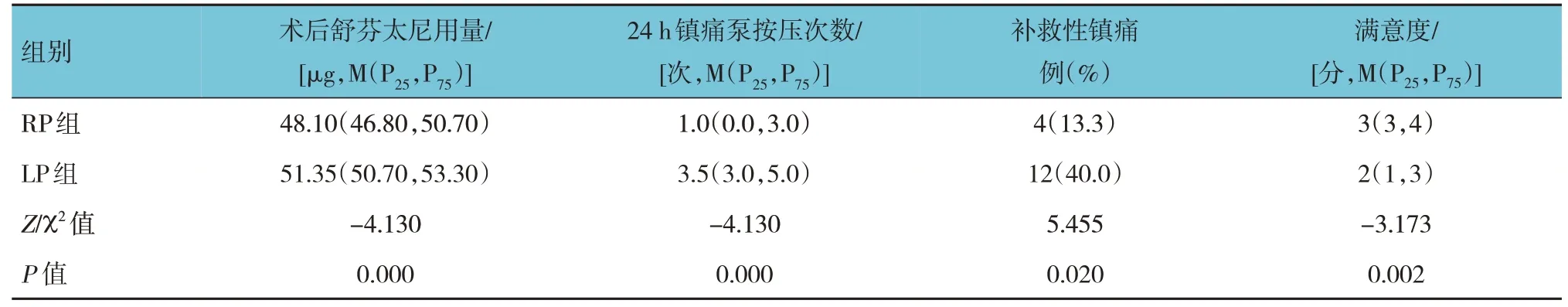
表5 两组患者术后镇痛药物使用情况及满意度比较 (n=30)
2.6 两组患者术后恢复情况比较
两组患者术后PACU 停留时间、首次下床活动时间比较,差异有统计学意义(P<0.05),RP 组较LP 组短;两组患者引流管拔除时间、住院时间比较,差异无统计学意义(P>0.05)。见表6。
表6 两组患者术后恢复情况比较 (n=30,±s)
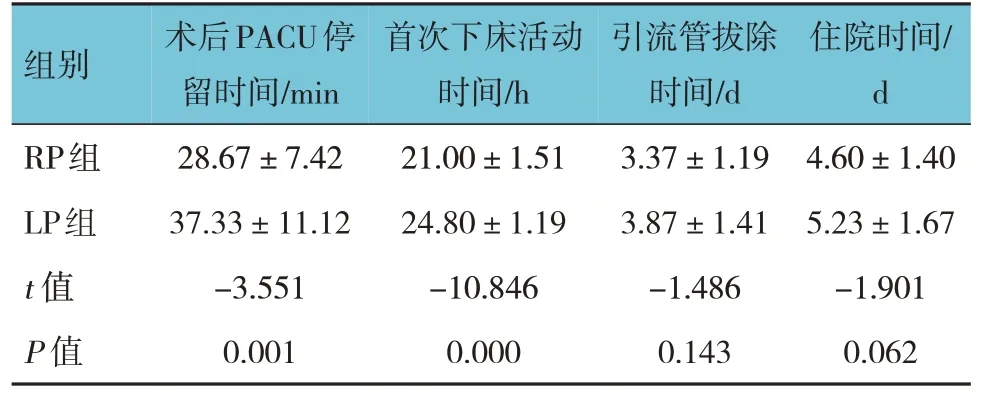
表6 两组患者术后恢复情况比较 (n=30,±s)
组别RP组LP组t 值P 值术后PACU停留时间/min 28.67±7.42 37.33±11.12-3.551 0.001首次下床活动时间/h 21.00±1.51 24.80±1.19-10.846 0.000引流管拔除时间/d 3.37±1.19 3.87±1.41-1.486 0.143住院时间/d 4.60±1.40 5.23±1.67-1.901 0.062
2.7 不良反应
RP 组术后1 例(3.3%)发生头晕,LP 组为2 例(6.7%)。RP 组2 例(6.7%)发生恶心、呕吐,LP 组为8 例(26.7%)。两组各发生低血压1 例(3.3%),两组均无呼吸抑制、皮肤瘙痒;RP 组没有发生神经阻滞相关并发症(局麻药中毒、血肿、气胸等)。
3 讨论
胸科手术后急性疼痛使患者不敢主动咳嗽和深呼吸,易发生肺部感染、肺不张、呼吸衰竭等并发症[10]。急性疼痛控制不良,也易增加慢性疼痛的发生率[11],甚至诱发患者的精神心理疾病[12-13]。由于阿片类药物有呼吸抑制、恶心、呕吐甚至耐受等不良反应[14],目前主张减少阿片类药物甚至无阿片类药物的辅助镇痛方法[14-15]。
超声引导下筋膜平面阻滞可大大降低阿片类药物用量。RISS 阻滞是一种新的筋膜平面阻滞方法,将局麻药分别注射在菱形肌与肋间肌之间和前锯肌与肋间外肌之间,药物通过筋膜间隙扩散阻滞T3~9肋间神经外侧皮支。其主要优点在于穿刺部位远离手术切口,不干扰手术区域,方便置管行连续术后镇痛[4]。
本研究结果显示RISS 阻滞不增加血管活性药物的用量,可减少术中瑞芬太尼用量。瑞芬太尼是超短效的阿片类药物,是术中镇痛的主要药物,但其呈剂量依赖性,会降低血压和心率。因此较小剂量瑞芬太尼辅助神经阻滞剂可以起到较好的镇痛作用,也能够保证血流动力学稳定。超声可视化技术提高操作安全性,患者很少发生神经阻滞相关并发症。
本研究结果表明RISS 阻滞与切口局麻相比镇痛效果更优,可降低术后24 h 内患者静息状态下和咳嗽时的VAS 评分,减少阿片类药物用量,提高术后咳嗽能力,缩短术后下床活动时间,提高患者的满意度。国外相关研究表明RISS 阻滞单次注药的持续时间约为16 h[5]。恶心、呕吐是术后常见并发症,发生率为25%~35%[16]。本研究中RP 组患者恶心、呕吐发生率降低,可能归因于术后阿片类药用量少,从而减少阿片类药物引起的恶心、呕吐,以及早期下床活动对胃肠功能有改善。两组术后引流管拔除时间及术后住院时间无统计学差异,可能由于样本含量的限制,其次单次神经阻滞的效果无法延续至术后更长时间,而留置胸腔引流管引起的疼痛仍持续存在。
本研究的局限性:仅观察了术后24 h 内的疼痛情况,未对更长时间的疼痛情况做进一步分析;两组局麻药物剂量不同,可能对试验结果产生一定影响。笔者将进一步评估RISS 阻滞与前锯肌平面阻滞、竖脊肌平面阻滞等的临床效果以及单次或置管持续镇痛的适宜剂量和浓度。
综上所述,超声引导下RISS 阻滞是安全有效的,在胸腔镜手术中具有补充镇痛的优势,可作为胸腔镜手术术后镇痛的一种辅助技术。但由于国内外总体研究较少,尚需大量高质量临床研究验证。

