胸腔积液IGRA、ADA、CEA值联合检测在结核性胸膜炎患者诊断鉴别中的应用
张光照
河南省胸科医院胸部微创外科,河南省郑州市 450003
胸腔积液是一种常见疾病,通常由结核性胸膜炎(Tuberculous pleurisy,TPE)和癌症等引起渗出性积液,一般采用侵入式措施进行诊断良性及恶性积液,但是对于有禁忌证的患者不适宜[1]。由于TPE和恶性胸腔积液的治疗及预后存在较大差异,因此早期的明确鉴别尤为重要[2]。腺苷脱氨酶(Adenosine deaminase,ADA)是一种有效的TPE标记物,广泛存在于全身组织中,TPE发生时胸液中淋巴细胞破坏产生大量ADA,但其在其他疾病如肺炎、淋巴瘤中也明显上升,因此需联合其他指标诊断TPE[3]。γ干扰素释放试验(Interferon-gamma re-lease assay,IGRA)是以T细胞为免疫基础的检测方法,采用刺激抗原刺激胸腔积液单核细胞(Pleural effusion mononucleus,PEMCs)或结核病变局部的免疫细胞,分泌抗原特异性IFN-γ,提示有结核分枝杆菌的感染,具有较高的特异性[4]。癌胚抗原(Carcinoma-embryonic antigen,CEA)是成熟的肿瘤标志物,在恶性肿瘤细胞侵犯胸膜时,胸水中CEA会明显上升[5]。因此本文通过胸腔积液IGRA、ADA、CEA联合检测来鉴别TPE患者,研究其诊断价值,报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2016年1月—2020年1月因胸腔积液来我院就诊的患者116例,其中诊断为TPE患者64例作为结核组,恶性肿瘤患者52例作为恶性组。结核组男35例,女29例,年龄20~75岁,平均年龄(46.35±5.12)岁。结核组纳入标准:(1)确诊为TPE[6];(2)HIV阴性。结核组排除标准:(1)排除其他原因所致胸腔积液;(2)未进行抗结核治疗;(3)伴有免疫系统疾病或恶性肿瘤患者;(4)伴有严重心脏、肾脏疾病患者;(5)无法抽取胸腔积液患者。恶性组男28例,女24例,年龄23~76岁,平均年龄(47.14±5.09)岁;肺癌24例,乳腺癌转移11例,胃肠道癌转移16例,前列腺转移1例。恶性组纳入标准:经病理学及影像学确诊为恶性肿瘤,存在恶性胸腔积液。恶性组排除标准:(1)排除其他原因所致胸腔积液;(2)既往存在结核感染史。两组患者的性别、年龄比较,差异均无统计学意义(P>0.05)。本研究经医学伦理委员会同意。
1.2 检测方法 IGRA试验采用酶联免疫斑点(Enzyme-linked immunospot detection technology,Elispot)法:采取所有患者胸腔积液30ml,用PBS重悬,调整细胞浓度为2.0×106个/ml。采用Oxford Immunotec公司的T-SPOT.TB试剂盒检测,该实验设置4个孔,分别为阴性对照孔、阳性对照孔以及早期分泌的抗原靶蛋白(Early secretory antigenic target 6,ESAT-6)及培养过滤蛋白-10(Culture filtrate protrin 10,CFP-10)的2个实验孔,后用Elispot读板仪记录斑点数。结果判定[7]:(1)当阴性对照孔斑点数为0~5,ESAT-6或CFP-10孔斑点数减去阴性对照孔斑点数≥6,结果判断为阳性;(2)当阴性对照孔斑点数为6~10个,ESAT-6或CFP-10孔斑点数≥2倍的阴性对照孔斑点数,结果为阳性(TPE),不符合上述标准且对照孔正常则为阴性。阴性对照孔斑点数<10,阳性对照孔斑点数>20,方认为本实验结果有效。采用化学发光免疫分析仪检测胸腔积液中CEA,ADA采用AU5400仪器,过氧化物酶法进行检测,以ADA>45U/L,CEA<10ng/ml诊断为TPE。
1.3 观察指标 记录所有受试者ADA、CEA值及采用IGRA试验的ESAT6和CFP10刺激的IFN-γ-Elispot数值。
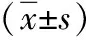
2 结果
2.1 两组胸腔积液中IGRA、ADA、CEA比较 结核组胸腔积液中用ESAT6和CFP10刺激的IFN-γ-Elispot数值及ADA均明显高于恶性组,CEA低于恶性组(P<0.05),结果见表1。
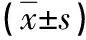
表1 两组胸腔积液中IGRA、ADA、CEA比较
2.2 ESAT6、CFP10与ADA、CEA的相关性 ESAT6、CFP10与ADA均呈正相关(P<0.05),ESAT6、CFP10与CEA均呈负相关(P<0.05),结果见表2。

表2 ESAT6、CFP10与ADA、CEA的相关性
2.3 IGRA、ADA、CEA诊断TPE的ROC曲线 在诊断TPE时,CEA的AUC最高为0.942,优于IGRA、ADA(P<0.05),结果见表3、图1。

表3 IGRA、ADA、CEA诊断TPE的ROC曲线

图1 IGRA、ADA、CEA诊断结核性胸膜炎的ROC曲线
2.4 IGRA、ADA、CEA鉴定TPE的诊断价值 三项指标联合鉴定TPE的灵敏度、特异度、准确率均较单一检测IGRA、ADA、CEA高(P<0.05),结果见表4。
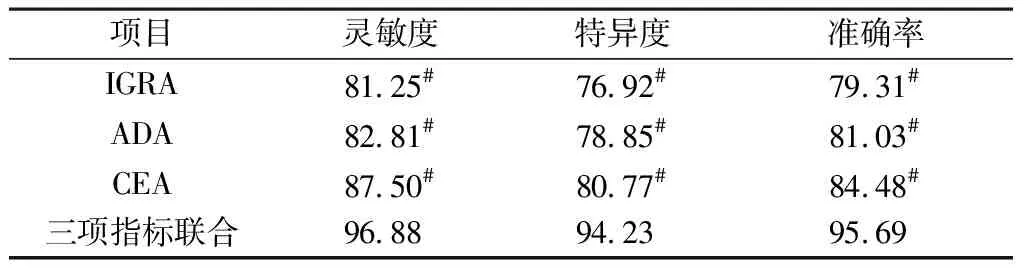
表4 IGRA、ADA、CEA鉴别TPE的诊断价值(%)
3 讨论
TPE与恶性胸腔积液难以鉴别,易造成误诊,影响患者预后[8]。TPE由结核分枝杆菌(Mycobacteri-um tuberculosis,MTB)感染引起,MTB检测是诊断TPE的金标准,但胸水中的MTB检出率很低,有较高的假阳性,容易漏诊,且培养时间较长[9]。而IGRA试验采用的刺激抗原ESAT-6、CFP10是MTB特有的,不受卡介苗和机体免疫影响,提高了特异性,避免了非结核杆菌和卡介苗对结果的影响[10]。本研究中,结核组的胸腔积液中用ESAT6和CFP10刺激的IFN-γ-Elispot数值及明显高于恶性组,由于MTB抗原特异性CD4T细胞聚集在感染部位,并聚集更多MTB抗原特异性IFN产生细胞,因而产生较高IFN-γ水平[11]。ESAT6和CFP10的AUC分别为0.877、0.896,说明检测胸腔积液中IGRA能有效鉴别TPE和恶性肿瘤患者,其灵敏度及特异度分别为81.25%、76.92%,与前人研究结果相似。由于我国是发展中国家,潜伏性结核感染占20%~30%,这是导致IGRA低特异度的主要原因[12]。同时有研究[13]表明免疫功能不全及高龄会影响IGRA的灵敏度。也有研究表明IGRA无法区分活动性结核与潜伏性结核感染,临床结果中阴性结果更有意义,因而IGRA试验还需和其他指标一起联合检测。
ADA是核酸分解代谢酶类,能催化腺苷脱氨生成肌苷,广泛存在于全身组织中,淋巴细胞内ADA的含量是红细胞的10倍[14]。本研究中结核组中胸腔积液中ADA明显高于恶性组,当发生TPE时,宿主通过细胞免疫抵抗MTB感染,胸膜的淋巴细胞明显增多,活性增强,故ADA在胸腔积液中含量明显增高[15]。而肿瘤胸腔积液中ADA上升也是以淋巴细胞升高为主,但ADA水平不高可能与恶性肿瘤时T细胞增殖受抑制有关[16]。ADA的AUC为0.917,灵敏度及特异性分别为82.81%、78.85%,说明ADA能作为鉴别TPE的有效标志物。也有研究[17]表明TPE早期胸腔积液的ADA水平较低,因部分TPE患者初期淋巴渗出液水平较低,需进行动态检测。还有研究[18]表明在间皮瘤、肺脓肿等患者胸腔积液中ADA水平较高,因而在检测时还需排除其他疾病因素。
CEA是肿瘤细胞自身产生的膜结合糖蛋白,是直肠癌、食管癌、肺癌的肿瘤标志物,已有研究证明正常细胞和某些良性疾病包括结核病只能少量合成或分泌[19]。当细胞恶性变时,细胞内的构成发生改变,其中CEA等物质通过转换、分泌、脱落增加释放入血循环和胸腔积液中[20]。本研究中结核组中胸腔积液中CEA明显低于恶性组,其AUC最高为0.942,其灵敏度及特异度分别为87.50%、80.77%。说明CEA能有效鉴别TPE与恶性肿瘤。但也有研究[21]认为脓胸中CEA水平也明显升高,因此需结合其他资料并动态观察患者病情,警惕恶性胸水可能。ESAT6、CFP10与ADA均呈正相关,与CEA均呈负相关,说明IGRA试验与ADA、CEA具有相关性,联合三种指标检测TPE,能提高检测灵敏度及特异度,因此可联合这三种指标进行检测,从而更加有效确定TPE。
综上,IGRA、ADA、CEA在鉴别TPE中均有其优缺点,应将三者联合使用,来提高鉴别的准确性。

