双能CT虚拟单能量图像在放疗计划系统中的应用研究
【作 者】李京,肖青,张祥斌,戴谷宇,柏森,钟仁明
四川大学华西医院 放疗科,成都市,610041
0 引言
双能CT的特点是高低两种能量同源、同时、同向进行扫描,一次扫描后可以重建不同千电子伏特(keV)对应的虚拟单能量图像,重建原理是将原始图像分离成两种基础物质(通常用水和碘)并获取物质密度投影数据对,通过在给定keV处线性组合质量密度图来合成虚拟图像[1],能提供准确的CT值[2],有替代常规图像进行放疗靶区勾画和剂量计算的可能。
与常规图像相比,VMI可以改善软组织对比度和对比噪声比(contrast-to-noise ratio,CNR)[3]。高keV图像可以减少金属伪影,改善金属伪影对靶区及危及器官勾画和剂量计算的不良影响[4]。已有研究证明:VMI在40 keV时可显著提高胰腺癌肿瘤对比度和CNR[5],实现大肠癌肝转移的最佳定量和定性病变描述[6],改善腹部恶性淋巴瘤的病变轮廓显示[7];在60 keV时能获取更好的头颈部肿瘤对比度和CNR[8],可用于在深度学习网络中[9]自动勾画头颈部危及器官;在75 keV时对肺癌患者的肿瘤显示和CNR最佳[10],用140 keV重建并使用MARS(metal artifact reduction software)能很好地降低金属伪影,且改善剂量计算问题[11]。
剂量计算是放疗计划的重要环节,治疗计划系统将图像的CT值转换成相对电子密度后才能进行剂量计算。因此VMI应用于放疗的前提是探究其图像能否被TPS识别,CT值转化成相对电子密度后剂量计算结果的准确性。多项实验使用DECT完成模体CT值到电子密度的转化[12-14],但是VMI实际应用于放疗计划的剂量学研究尚不完善。笔者使用已获得放疗医生和物理师批准的计划,将相同的计划参数移植到VMI和常规图像上,探究剂量分布的差异。
1 材料和方法
1.1 模体选择
本研究采用CIRS-062电子密度参考模体、仿真头模和成年女性体模进行剂量学研究。CIRS-062电子密度模体,内含电子密度已知的人体各组织模拟插件(见图1),用于测量不同keV参数重建图像对应的CT值,并与常规图像进行对比。仿真头模和成年女性体模用于剂量分布验证。
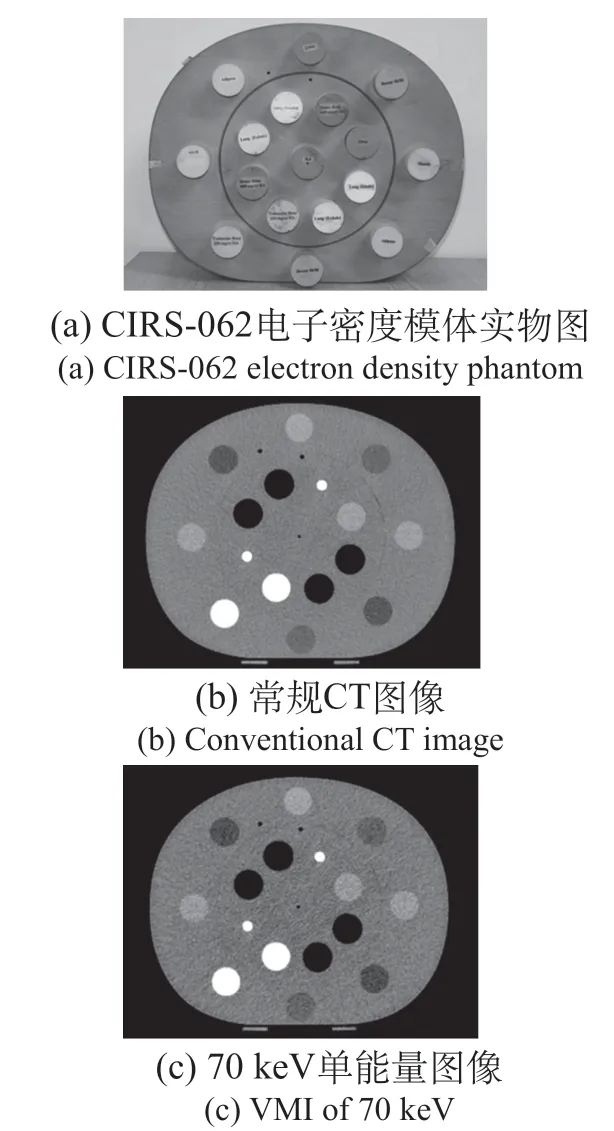
图1 CIRS-062电子密度模体图像Fig.1 Images of CIRS-062 electron density phantom
1.2 图像获取
在GE Revolution CT扫描仪上分别对三个模体进行CT扫描和图像重建。放疗常规使用峰值电压(kilovolt peak,kVp)为120 kV的混合能量成像,其扫描参数为:管电压120 kV,管电流180~540 mA,螺距0.992,层厚0.625 mm,重建图像层厚3 mm,设为对照组。GSI[15]扫描参数为:管电压80 kV/140 kV,管电流280 mA,螺距0.992,层厚0.625 mm,扫描后以10 keV为间隔从40 keV到140 keV重建出11组虚拟单能量图像,重建层厚3 mm,设为试验组。
1.3 CT值获取
将获得的CIRS-062电子密度模体的12组图像导入治疗计划系统Eclipse(Version 13.5,Varian Medical System Inc.,Palo Alto,CA),选择圆形感兴趣区(range of interest,ROI)测量每组图像上各插件CT值(致密骨插件ROI取38.05 mm2,其他插件取502.45 mm2,ROI与插件半径之间留1 mm边缘)[16-17],即为人体各组织对应的CT值,比较不同图像CT值的差异。
1.4 计划选择与验证
在Eclipse中导入仿真头模和体模的对照组和试验组CT图像,选择临床使用的标准CT值-电子密度曲线(常规120 kVp扫描获取)进行CT值到电子密度的转化。选取经放疗医生和物理师批准的3例不同类型的放疗计划(见表1),将其计划参数、计划靶区体积(planning target volume,PTV)分别移植到12组图像上,重新计算后得到剂量分布[18]。在放疗计划中,靶区需要接受足够剂量的照射,因此PTV的剂量体积直方图(dose volume histogram,DVH)是评估剂量分布的重要指标。从Eclipse获取DVH,统计SBRT计划中覆盖100%体积的剂量(D100),IMRT和VMAT计划中覆盖95%体积的剂量(D95),并计算VMI 与常规图像上的标准化剂量差(δD=|DVMI-D120kVp|/Dprescription)[19]。将Eclipse的验证计划、PTV结构、剂量分布和CT图像导入3DVH(Version 3.3.1,Sun Nuclear Corporation,Melbourne,FL,USA)三维剂量验证系统,重建靶区的剂量分布,调整γ通过率参数(标准2%/2.000 mm,阈值0.001%)后可分析VMI和常规图像每个体素的剂量差值[20]。

表1 三例放疗计划的基本信息Tab.1 The basic information of the 3 treatment plans
2 结果
2.1 CT值比较
通过对CIRS-062电子密度模体扫描和测量,各插件对应组织的CT值列于表2。致密骨在不同图像上CT值变化最大,70 keV、80 keV图像与常规图像差值仅有70~80 Hu,40 keV图像则高达1 212 Hu。梁骨差异略小,差值范围在20~365 Hu之间。脂肪、乳腺差异均在100 Hu以内,呼气肺、吸气肺、肌肉和肝脏在不同图像上的CT值变化小于40 Hu。水的CT值变化均在3 Hu以内。不同单能量图像间CT值比较发现,40 keV图像与常规图像CT值的差值高于其他虚拟单能量图像,70 keV、80 keV图像的差值最小。
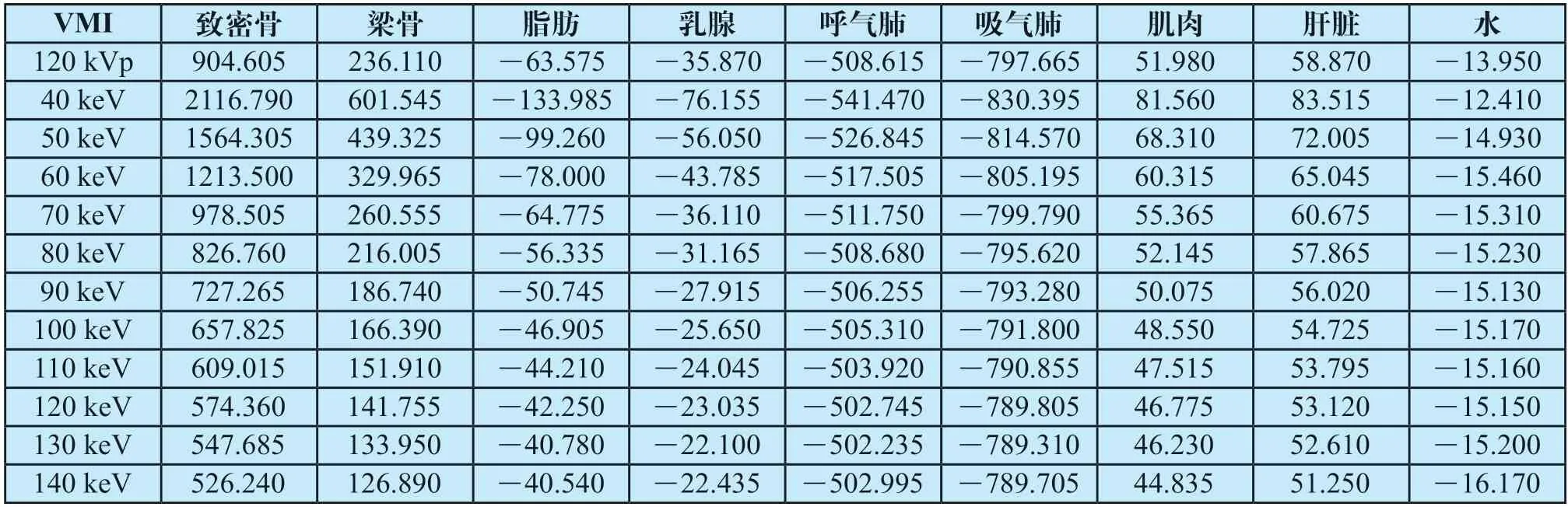
表2 不同图像上测得的各组织CT值(Hu)Tab.2 CT value of tissues measured on different images
2.2 剂量分布
三例计划表现出的靶区剂量分布差异一致:在40 keV图像上,DVH与常规图像差异最大;在40~70 keV图像上,差异随能量增加而逐渐减小;在70~140 keV图像上差异较小。部分VMI与常规图像的局部DVH比较,如图2所示。
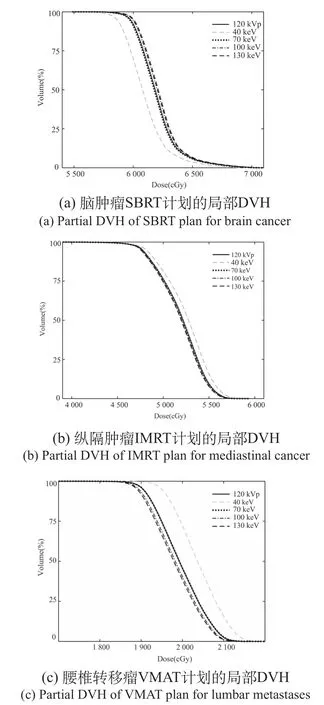
图2 VMI和常规图像验证计划中PTV的局部剂量体积直方图Fig.2 Partial DVH of PTV in VMI and normal image verification plan
从常规图像的靶区DVH中读取剂量学特征值作为对照,试验组VMI的DVH特征值及其与对照组的比较如表3所示。所有单能量图像的标准化剂量差均在2%以内,其中70 keV的特征值与对照组最相似,δD接近于0%。

表3 靶区剂量(Gy)及标准化剂量差(%)统计Tab.3 Statistics of target dose (Gy) and standardized dose difference (%)
将常规图像的剂量分布作为对照组,统计其与VMI剂量分布在每个体素的差值(见表4)。以70 keV为例,体素的剂量差统计直方图如图3所示,在±0.1 Gy以内的频数最高,较大剂量差值的频数很低。

表4 体素剂量差值统计(Gy)Tab.4 Statistics of voxel dose difference (Gy)
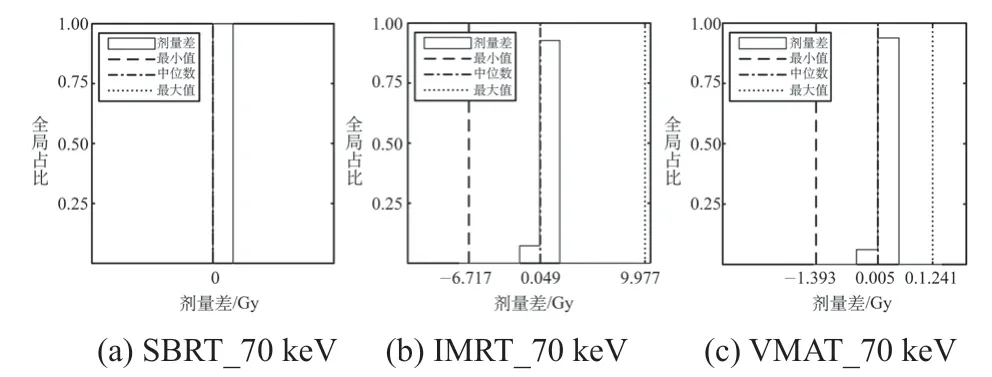
图3 三例计划在70 keV与对照组中体素剂量差的统计直方图Fig.3 Statistical histogram of voxel dose difference between 70 keV and control group for the three plans
3 讨论
虚拟单能量图像对肿瘤病灶显示有很大优势,高keV图像还能有效减少金属伪影及其产生的剂量学效应[4]。与放疗常规成像方式相比,双能CT在更低或相等的辐射剂量下获取补充重建[8],可改善放疗流程中的靶区勾画和剂量计算。研究使用CIRS电子密度模体和人体仿真模体,测量不同VMI的CT值并在将其应用于TPS中,对6 MV光子计划的剂量学差异进行了初步研究。
各组织在不同VMI中CT值与常规图像有不等的差别,例如致密骨在40 keV时CT值的差别高达1 212 Hu,水的CT值在各单能量图像上均低于3 Hu。CT值的差异取决于各组织相应的衰减系数μ,μ随射线能量、物质的有效原子序数和电子密度而变化[21],常规成像得到峰值电压为120 kV的混合图像,VMI则是双源峰值电压80 kV和140 kV扫描后重建的单能量图像,且各组织的物理性质不同,因此表现出不同程度的CT值差异。但两种成像方式获得的CT值经过TPS中标准曲线(常规120 kVp扫描)转化成电子密度,以及AAA算法对组织不均匀性的校正后,相同计划参数下获得的剂量分布差异并不大。具体表现为:在体素剂量差值统计中,差值集中分布在0 Gy,且全局剂量γ通过率(2%/2 mm)均为100.0%,剂量差异非常细微。在靶区剂量评估中,试验组和对照组的剂量差在处方剂量2%以内,是临床上可以接受的误差,70~140 keV图像的DVH曲线与对照组很接近,证明累计剂量差异也在临床可接受的范围。
本研究证实了双能CT扫描后重建的虚拟单能量图像可采用已有的标准CT-电子密度曲线直接应用于TPS中,且70~120 keV图像与常规120 kVp图像6 MV光子计划的剂量分布基本一致。在此前提下,可以探究不同部位肿瘤在临床上图像质量最佳的虚拟单能量图像以用于精确的靶区勾画,再将靶区结构移植到70 keV图像上,基于TPS标准CT值-相对电子密度曲线进行放疗计划设计。也可以探究去金属伪影效果最佳的高keV图像,直接应用于TPS中进行CT值和相对电子密度的转换并设计治疗计划。

