南苕溪溶解性有机质光谱特性及其与水质参数的相关性研究*
徐兵兵
(上海太和水环境科技发展股份有限公司,上海 200433)
溶解性有机质(DOM)普遍存在于水域环境中,是水域生态系统中重要的化学组分。自然水体中的DOM含有丰富的碳、氮、磷等营养元素,能够参与多种物理、化学和生物过程,在水体生态系统物质循环、污染物迁移转化、生物降解等方面扮演着重要的角色[1]。因此,关于DOM的组成及其特征的研究,对于明晰水体生态系统物质循环、水环境保护、水体生物地球化学等具有重要意义[2]。DOM中能够吸收紫外光和低波长可见光并着色的部分,主要由腐殖酸、富里酸、脂肪族及芳香烃类物质组成,称为有色溶解性有机质(CDOM),部分CDOM在吸收紫外光后发射长于激发波长的荧光,称为荧光溶解性有机质(FDOM)[3-4]。
紫外—可见吸收光谱及三维荧光光谱因具有灵敏度高、成本低、操作简便、测量快速等优点[5],被广泛应用于河流[6]、湖泊[7]、河口[8]、海洋[9]等天然水体中DOM的结构、组成以及来源等信息的表征。为此,人们开始越来越多地了解到DOM的特征,并据此追溯DOM的来源,识别其性质的改变。鉴于DOM在水体生态环境系统中的重要作用,DOM的性质常常被用来作为监测水体污染的重要表征,如DOM的三维荧光特性能够便捷地反映水体水质、外源污染、内源污染等[10-12],DOM的光谱特性也可以便捷地表征BOD5、COD等指标的浓度,且与其他相关的生物地球化学变量存在相关性[13]。目前国内外学者已经运用三维荧光光谱等技术对DOM组成、分布特征及来源等做了大量研究,但主要集中在一些富营养化湖泊水体(水库)以及大江大河中,在源头溪流中的报道还十分有限,尤其是位于山区的天然河流系统。
源头溪流是河流、湖、库水系统的重要组成部分,是汇水区物质汇集和向下游水体传输的重要载体和通道。各等级小河流携带的泥沙、有机质、木质残体和营养物经逐级汇流、传输,最终进入更高等级河流或湖、库、海湾中,影响这些水体的生态学特征[14]。苕溪是太湖最大的入湖河流,其上游支流南苕溪位于浙西丘陵区,是杭嘉湖平原的重要饮用水源,而且是太湖的上游发源地。因此,研究该流域的水质状况对居民健康及太湖富营养化防治具有重要意义。为了解源头溪流DOM的特征和来源,本研究选择南苕溪作为研究对象,运用紫外—可见吸收光谱、三维荧光光谱测定及平行因子分析,结合水体理化特征,阐释南苕溪水体DOM的组成及来源,初步揭示其与水质的相关性,以期为源头溪流水质监测及污染预警提供有益的参考。
1 材料与方法
1.1 研究区概况
南苕溪是东苕溪的主源,东苕溪是太湖最大入湖水系之一。南苕溪属山溪性河流,87%的水域分布于浙江临安境内,境内段长55 km,流域面积620.8 km2。南苕溪有浪口溪、南溪、锦溪3条主要支流,南流浪口溪经里畈水库至浪口汇南溪后汇入南苕溪,东流穿过临安城区于青龙口汇锦溪后入青山水库。浪口溪和南溪河段地处浙西山丘区,河道坡降较大,土地利用类型也存在差异,浪口溪以天然林覆被为主,南溪沿岸雷竹林广泛分布。锦溪河段地势相对平坦,依次流经上游农业区、玲珑工业区、临安城区。流域地处亚热带季风气候区,温和湿润,降水丰沛,多年平均气温15.8 ℃,多年平均降水量约为1 460 mm,降水量年内分配不匀,受地形、气候诸多因素制约。
1.2 样品采集与测试
对南苕溪全流域实地考察后,于南苕溪干流以及主要支流布设16个采样点,其中浪口溪布设4个采样点(记为L1~L4),南溪布设4个采样点(记为N1~N4),锦溪布设6个采样点(记为J1~J6),南苕溪干流布设2个采样点(记为S1、S2)(见图1),自2013年4月至12月逐月(8月和11月未采样)进行水样采集。为消除暴雨事件对DOM迁移的影响,在基流期采集水样,共得到样品112个。南苕溪上游各支流水浅(水深<1.5 m)、河窄(宽度<5 m),于溪流中心采集水样;下游河道变宽,采集河道中心及两侧的水样按等比例混合。现场采用SensION 156型多参数水质分析仪(美国哈希)测定并记录水温、pH、溶解氧(DO)、电导率(EC)等理化指标,用Phyto-PAM型浮游植物叶绿素荧光仪(德国Walz)测定叶绿素a(Chl-a)含量。采集到的水样在冷藏条件下运回实验室,进行营养盐分析以及紫外—可见吸收光谱、三维荧光光谱测试。

图1 南苕溪水系采样点布设Fig.1 Sampling sites in the South Tiaoxi River
1.2.1 营养盐分析
原水用于测试总氮(TN)和总磷(TP)浓度。取适量原水经0.45 μm醋酸纤维滤膜过滤后,滤液用于测定溶解性有机碳(DOC)、溶解性总氮(DTN)、氨氮、硝态氮、亚硝态氮、溶解性总磷(DTP)、溶解性正磷酸盐(SRP)的浓度。TN、DTN采用碱性过硫酸钾分光光度法测定;硝态氮采用紫外吸收法测定;氨氮采用纳氏试剂分光光度法测定;亚硝态氮采用重氮偶合分光光度法测定;TP、DTP、SRP采用钼酸铵分光光度法测定。利用TOC-VCPN型总有机碳分析仪(日本岛津)测定DOC浓度,由于水样中DOC浓度较低,采用不可吹脱有机碳法测定。溶解性有机氮(DON)和溶解性有机磷(DOP)浓度采用差减法求得,其中,DON为DTN与3种无机氮(氨氮、硝态氮、亚硝态氮)之差,DOP为DTP与SRP之差。
1.2.2 紫外—可见吸收光谱分析
用TU-1901型双光束紫外—可见分光光度计对样品进行吸收光谱扫描,使用5 cm石英比色皿,扫描范围为200~800 nm,步长1 nm。为校正仪器波动,每个波长下的吸光度需减去680~700 nm的吸光度平均值,根据式(1)计算吸收系数,根据式(2)计算比吸收系数。
aλ=2.303×Aλ/r
(1)
SUVAλ=aλ/cDOC
(2)
式中:aλ为波长λnm处的吸光系数,m-1;Aλ为校正后波长λnm处的吸光度;r为比色皿厚度,m;SUVAλ为波长λnm处的比吸收系数,L/(mg·m);cDOC为DOC质量浓度,mg/L。
参考文献[15],采用波长355 nm处的吸收系数(a355)表示CDOM含量;参考文献[16],采用波长254 nm处的比吸收系数(SUVA254)反映芳香性碳的含量,SUVA254越大表明DOM的芳香性越强。
1.2.3 三维荧光光谱测定及平行因子分析
用AquaLogTM型荧光光谱分析仪(法国HORIBA)对水样进行三维荧光光谱扫描,扫描范围为:激发波长(Ex)240~400 nm,步长3.00 nm ;发射波长(Em)300~550 nm,步长3.34 nm;积分时间1 s。样品光谱数据经过内滤效应校正[17],扣除空白和拉曼归一化处理后,运用平行因子分析模型PARAFAC识别不同的荧光组分[18]。参考文献[19]、[20]计算水样荧光指数(FI)、腐殖化指数(HIX)和生物源指数(BIX)。FI用于识别DOM的来源,FI <1.4时表明DOM来源于陆源(外源);FI >1.9时表明DOM来源于微生物源(内源)[19]。HIX用于表征DOM的腐殖化程度,HIX越大表明DOM腐殖化程度越高,当HIX>16时认为DOM具有强腐殖质化特征或陆源贡献显著; HIX介于6~10时,认为DOM腐殖化特征较明显且新近自生源成分较弱;HIX介于4~6时认为腐殖化特征较弱且新近自生源成分显著;HIX<4时表明DOM为生物或水生细菌来源。BIX可用于衡量新近自生源对DOM的贡献,BIX越大表明新近自生源对DOM的贡献越大,BIX为0.6~0.7时表明新近自生源DOM较少;BIX为>0.7~0.8时表明新近自生源DOM中等;BIX为>0.8~1.0时表明新近自生源DOM较多;BIX>1.0时表明DOM来源为生物或水生细菌[20]。
1.3 数据处理
数据分析前,利用Z分数标准化法对数据中的异常值予以剔除,并将各参数标准化。各参数之间的相关分析采用Pearson相关系数及双尾显著性检验,显著性水平为p<0.05;采用多元回归分析建立水质参数与CDOM含量及荧光组分的回归方程,为避免回归模型中变量间的共线性,检验模型的条件指标值(CI),当CI小于30时,认为变量间不存在共线性。数据处理和统计分析采用SPSS 16.0软件,绘图采用Origin 8.5软件。
2 结果与讨论
2.1 南苕溪水体理化性质
南苕溪水体呈中性偏弱碱性,pH为7.89±0.69;DO质量浓度相对较高,为(9.92±1.94) mg/L,表明水体的有氧状态占主导地位。水体EC为(223.58±109.37) μS/cm,标准偏差较大,且上游源头EC(45.30 μS/cm)明显低于下游河段(495.00 μS/cm),与南苕溪下游流经临安城区,城镇生活污水、工业废水排放有关[21];Chl-a质量浓度为(7.10±7.74) μg/L,低于其下游东苕溪及太湖[22-23];DOC为(2.53±1.14) mg/L,高于DON和DOP,与MATTSSON等[24]在芬兰、丹麦、英国和法国等国家多条河流的监测结果相似。南苕溪水体氮含量总体偏高,DTN为(3.15±1.47) mg/L,平均值为《地表水环境质量标准》(GB 3838—2002)Ⅴ类限值的1.5倍,硝态氮是最主要的氮形态,平均质量浓度为(2.41±1.28) mg/L,占DTN的77%(质量分数,下同),DON和氨氮分别占DTN的12%、7%,与其受纳水体太湖中氮素比例一致[25]。南苕溪水体磷含量总体偏低,DTP平均质量浓度为(0.08±0.06)mg/L,介于GB 3838—2002的Ⅰ~Ⅱ类,SRP和DOP占DTP的比例分别为68%、32%。
2.2 南苕溪水体DOM的光谱特征
对112个样品的三维荧光光谱数据进行平行因子分析,共识别出4种组分,包括两个类蛋白组分(记为C1、C2)和两个类腐殖质组分(记为C3、C4),4个组分的三维荧光光谱见图2。荧光峰类型与已报道的其他水域环境相似[26-27],组分C1(Ex/Em为273 nm/320 nm)具有单一激发峰和发射峰,为类酪氨酸荧光峰,对应传统组分的T峰。组分C2(Ex/Em为<240 nm/340 nm和282 nm/340 nm)具有2个激发峰和1个发射峰,为类色氨酸荧光峰。组分C3(Ex/Em为<240 nm/402 nm和321 nm/402 nm)具有2个激发峰和1个发射峰,可以被归类为陆源类腐殖质A峰(Ex/Em为230~260 nm/380~460 nm)和海源类腐殖质M峰(Ex/Em为290~310 nm/370~420 nm)。先前的研究表明,该组分可能来源于陆源,或者在水域环境中利用陆源有机质产生的自生源[28]。组分C4(Ex/Em为275/471 nm和365 nm/471 nm)同样具有2个激发峰和1个发射峰,代表从陆源输出的腐殖质物质,该组分与传统的陆源类腐殖质C峰相似。相对于C3组分,C4组分的荧光峰发生了红移,表明其具有更高程度的芳香性缩聚作用和更大的化学稳定性。不同水域荧光峰值位置和强度的差异暗示了不同水域DOM来源和组成的差异。每个组分的荧光强度由其最大荧光强度(Fmax)表示,每个组分的相对贡献由各个组分的Fmax在所有组分的荧光强度之和中的占比计算而得。C1~C4组分的荧光强度平均值分别为0.17±0.27、0.22±0.28、0.21±0.11、0.11±0.06,以类色氨酸荧光峰最强,陆源类腐殖质A峰次之,内源生产的类蛋白组分相对贡献略高于外源输入的类腐殖质组分。然而,类蛋白组分的标准偏差较大,说明其在时空上存在较大差异,与流域从上游河源到下游河口土地利用类型由天然林、经济林变迁为城镇,及其相应污染梯度变化特征有关。
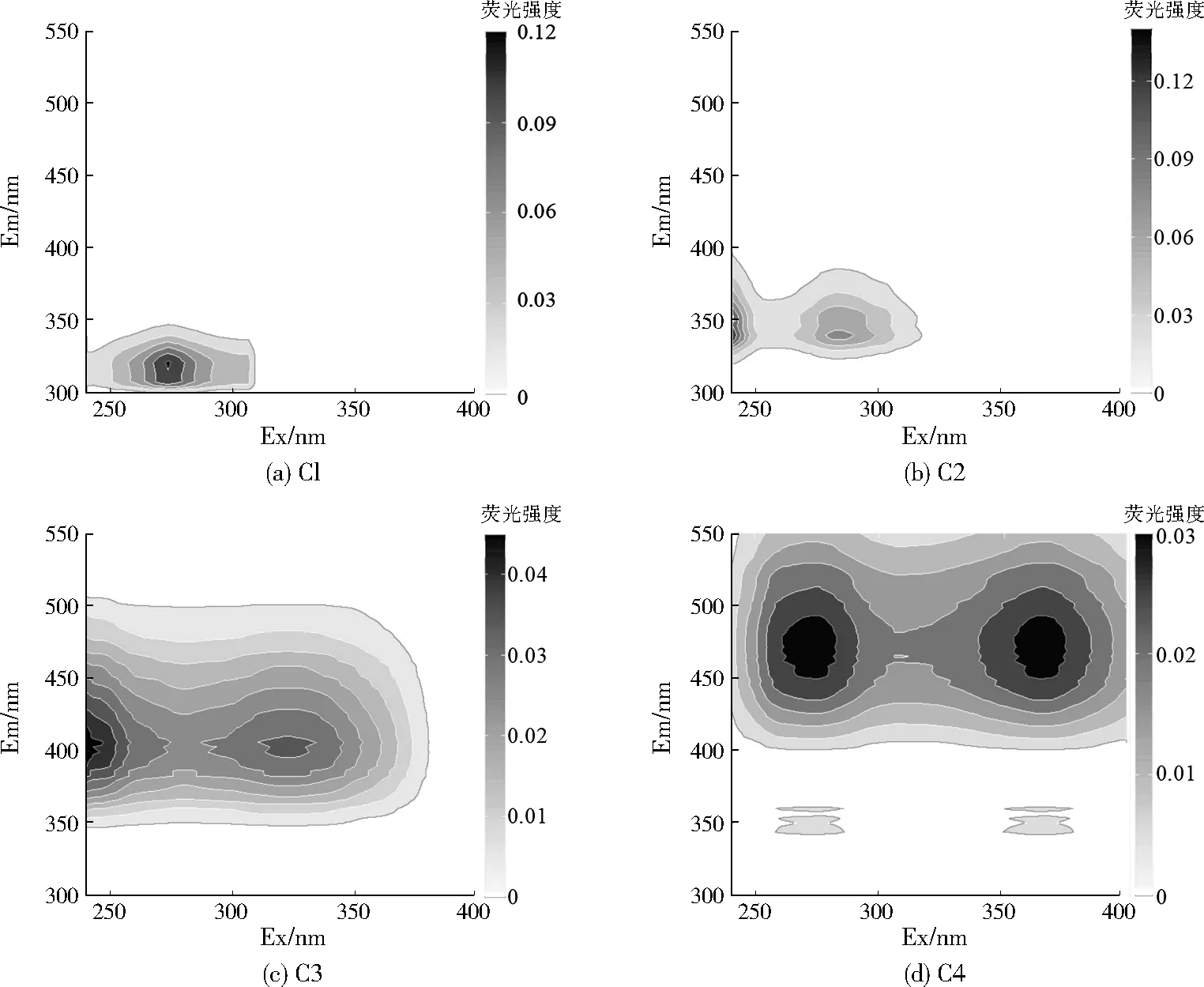
图2 PARAFAC模型鉴别出的4个荧光组分Fig.2 Four fluorescent components identified by PARAFAC model
南苕溪水体a355的变化范围为0.13~6.84 m-1,平均值为(1.46±0.88) m-1。用水样在275~295 nm的光谱斜率(S275-295,nm-1)判断CDOM来源和组成。南苕溪水体S275-295的变化范围为0.007 6~0.019 6 nm-1,平均值为(0.013 2±0.002 7) nm-1。S275-295的变化一般来自于CDOM组成的差异,水样S275-295较低,且其标准偏差较小,表明CDOM中陆源组分的比例较高,且各子流域CDOM组成相似[29]。FI的变化范围为1.59~2.11,平均值为1.83±0.10,可见DOM介于微生物源特征和陆源特征之间,表明南苕溪DOM的来源既有植物枯枝落叶、根系分泌物及人类活动等陆源输入,又有内部微生物活动参与。HIX的变化范围为0.14~8.96,平均值为4.19±2.05,表明南苕溪水体DOM腐殖化特征较弱且新近自生源成分显著。BIX的变化范围为0.64~1.63,平均值为0.88±0.20,表明南苕溪水体新近自生源DOM较多。综合3个荧光参数,说明在基流期,南苕溪水体DOM表现出腐殖化程度低,新近自生源高的特点。
2.3 光谱特征与水质参数的相关分析
分别以水温、DO为自变量,水体DOM荧光参数及组分为因变量进行相关分析,对具有显著相关性的参数进行汇总(见表1)。BIX与水温和DO均呈显著正相关关系,表明在高温或富氧环境下,水域中微生物的活性较强,DOM的内源生产过程较强。a355、C3、C4与水温呈显著正相关关系,与DO呈显著负相关关系。研究区域雨热同期,水温高的时期,往往流量越大,DOM的外源输入过程也越强。外源DOM的输入,刺激微生物活动,从而消耗水体中的DO。由此推断,外源DOM的输入也是导致水体DO含量减少的原因之一[30]。分别用4月、6月、10月、12月代表春、夏、秋、冬季,4个典型月CDOM吸收系数与浮游植物Chl-a浓度回归结果见图3。4个典型月Chl-a浓度与a355均呈显著线性相关,表明CDOM的浓度受到浮游植物的影响。浮游植物产生的DOM多数不具有荧光特性,但是在水体微生物作用下可转化为具有荧光特性的DOM,会产生类腐殖质荧光信号[31]。张运林等[32]观测到梅梁湾和大太湖夏季水华暴发期CDOM吸收系数与Chl-a浓度存在正相关,李素菊[33]在巢湖Chl-a浓度较高时,也观测到相似结果。本研究中,尽管南苕溪Chl-a质量浓度较低(<35 μg/L),同样观测到CDOM吸收系数与Chl-a浓度存在正相关。在2013年10月,“菲特”台风引起的暴雨径流携带大量陆源物质输入河流,河流藻类浓度较低(Chl-a小于6 μg/L),亦观测到相同趋势,说明南苕溪浮游植物降解对水体中CDOM有重要贡献,浮游植物残体腐烂降解的产物是水体中CDOM的重要来源。

表1 荧光参数及组分与水温和DO的相关关系

图3 a355与Chl-a质量浓度的关系Fig.3 Correlations between a355 and Chl-a mass concentration
将水质理化参数与荧光参数作为逐步回归方程的自变量,建立与a533及荧光组分的回归方程,结果见表2。共筛选出3个对a355有显著影响的限制因子,分别为SUVA254、DOC和C3,且都为正相关。在河口与海洋研究中,众多结果观测到CDOM的吸收系数与DOC浓度之间存在着较强的线性正相关,并据此建立线性模型反演DOC浓度[34-35]。虽然DOC作为第2限制因子入选回归方程,本研究中并未发现DOC和a355间存在明显相关性(p>0.05),这可能和无色DOM组分在DOM中所占比例较不稳定有关[36]。通常,来自河流携带的陆源物质含有更多的CDOM,而浮游植物释放的有机质含有更多的无色DOM。其一,南苕溪位于上游源头,生长着大量附着在河床底部砾石上的生物膜,其中的微生物作用使有机质矿化或分解成小分子无色DOM,还可以将无色DOM转化为CDOM,从而使得a355与DOC浓度相关性明显下降。其二,紫外辐射的光降解也是无色DOM增多的原因,尤其是夏季到达水面的紫外辐射较强,CDOM吸收紫外辐射后产生光降解将丧失颜色,增加无色DOM成分。其三,南苕溪不同支流DOM受农业经营活动、城市生活污水及工业废水等不同陆源输入的影响,使非荧光物质在DOM中所占的比例存在差异,也是导致DOC与a355之间相关性较差的原因。

表2 a355及荧光组分的多元回归方程1)
BIX作为第1限制因子入选两类类蛋白(C1、C2)组分的回归方程,且氨氮作为第2限制因子入选C1组分的回归方程。可见,除了藻类生产来源外,生活、工业和农业污水的输入同样是南苕溪水体中类蛋白组分的重要来源。来源于污水的DOM中通常含有大量由微生物活动产生的类蛋白物质,通过对类蛋白物质的追踪有助于了解污水对受污染河流的影响[37]。在英格兰城市河流两次污染事件中,均观测到河水中类蛋白荧光与氨氮呈显著正相关,并出现同时剧烈增加的现象。对污染物进行追踪后,这种现象被认为是由未经处理的污水直接排入河道导致的[38]。
a355和DTP均作为限制因子入选两类类腐殖质(C3、C4)组分的回归方程。普遍认为磷在土壤中易被固定吸持,而且难以向水体迁移[39]。但陆源DOM的存在能够明显改变土壤中磷的行为,阻碍土壤对磷的吸附,并导致土壤径流液中磷的含量显著增加[40]。陆源DOM主要由陆地的植物凋落物、富含有机质的土壤降解产物和外源有机物料组成,含有大量的功能基团且具有较高的化学活性,对Fe、Al、Ca、Zn和Mg等金属离子有着很强的亲和力,能够形成DOM-金属-磷络合物,在增加金属离子水溶性和迁移能力的基础上降低了金属离子对磷的固定作用[41]。此外,陆源DOM还可以直接与磷酸根竞争土壤表面吸附位或与磷酸根发生络合、溶解作用,进而增强了土壤中磷的迁移能力和生物有效性。因此在陆源DOM丰富的地区,土壤磷的淋失和迁移风险会明显提高,进而对藻类的生长产生影响。
3 结 论
南苕溪DOM主要由两个类蛋白组分和两个类腐殖质组分组成,具有内源生产和外源输入的双重特征,且以内源生产为主,外源输入为辅。DOM的荧光特征表现为新近自生源特征更加明显,腐殖化程度较低;研究区雨热同期,水温高的时期,DOM的外源输入过程也越强,而外源DOM的输入会刺激微生物活动,从而消耗水体中的DO;在高温或富氧环境下,水域中微生物的活性较强,DOM的内源生产过程有所增强;尽管Chl-a浓度较低,浮游植物残体腐烂降解的产物是水体中CDOM的重要来源。
BIX和氨氮浓度能够较好地表征类蛋白组分,说明除了藻类生产来源外,生活、工业和农业污水的输入同样是南苕溪水体中类蛋白组分的重要来源。而a355和DTP浓度能够较好地表征类腐殖质组分,表明在陆源DOM丰富的地区,磷素的淋失和迁移风险会明显提高。

