基于耳石微化学特征的大麻哈鱼生境履历分析及其在群组鉴别中的应用*
王继隆,刘 伟,杨文波,李培伦,唐富江,鲁万桥,杨 健,姜 涛
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070;2.农业农村部黑龙江流域渔业资源环境科学观测实验站,黑龙江 哈尔滨 150070;3.中国水产科学研究院农业农村部渔业遥感科学观测实验站,北京100141;4.中国水产科学研究院资源与环境研究中心,北京100141;5.中国水产科学研究院淡水渔业研究中心,长江中下游渔业生态环境评价与资源养护重点实验室,江苏 无锡 214081)
大麻哈鱼(Oncorhynchusketa)属溯河洄游性鱼类,其广泛分布于北太平洋及其沿岸的淡水河流中。我国境内大麻哈鱼分为4个地理种群,即黑龙江、乌苏里江、绥芬河和图们江群体。每年春季大麻哈鱼幼鱼降河进入海洋生活阶段,秋季发育成熟后的大麻哈鱼上溯至出生河流产卵繁殖[1]。目前我国对大麻哈鱼的研究多集中在回归群体数量结构[2]、生物学特征[3-4]、种群划定[5]等方面,由于研究区域限制,对其生活史方面的研究非常少见。通过对鱼类生活史特征的研究能够更全面的掌握其生态习性并能对不同群体进行有效区分[6-9],还可为鱼类资源保护工作提供科学依据。
耳石微化学分析技术可以有效反演洄游性鱼类的生境履历,在鱼类生活史研究方面的应用较为广泛。Dou和 Yang 等采用耳石Sr、Ca元素分析研究了刀鲚的生活史特征及生态类型划分[10-11],王继隆等通过耳石微化学分析首次证实了乌苏里白鲑具有江海洄游的生活史特征[12],Sukyung 采用耳石微量元素分析研究了北美、韩国水域大麻哈鱼种群鉴定和江海洄游的生活史特征[13]。此外,耳石微化学还应用于鱼类标记放流工作中并取得较好效果[14-15]。我国大麻哈鱼增殖放流工作已持续开展三十多年,增殖放流效果评估工作在逐渐开展[16]。大麻哈鱼增殖群体和自然野生群体间的鉴别是增殖放流效果评估工作开展的前提和基础。
目前大麻哈鱼增殖放流群体和自然野生群体的鉴别主要依赖所采取的标记方法,因各种方法都具有一定的优缺点,尚未形成统一的标记方法。根据大麻哈鱼个体早期生活史的差异而进行群体间的辨别具有较好的应用前景。目前关于我国大麻哈鱼生活史方面的研究尚未见报道。因此,本研究采用X射线电子探针微区分析技术(EPMA)分析大麻哈鱼耳石锶、钙元素的变化规律,分析大麻哈鱼关键生活史特征,同时利用大麻哈鱼不同群体间生境的差异性探讨不同生活史群组间的辨别方法。这将为大麻哈鱼的生活史特征分析及增殖放流工作中群体鉴别提供一种有效的研究方法。
1 材料与方法
1.1 实验材料
本研究大麻哈鱼样本分为4组:自然野生组、人工增殖放流锶标记组、物理标记组和人工养殖组。其中自然野生组由在绥芬河、乌苏里江等水域中捕获的大麻哈鱼自然野生个体的回归群体组成;人工增殖放流锶标记组由在汤旺河水域放流的锶标记群体的回归个体组成,锶标记方法为在受精卵发眼后至出膜期间在培育水体中(平列槽中流动水体)添加氯化锶水溶液(Sr2+初始浓度为30 mg/L),每隔12 h加入一次,持续3 d;人工增殖放流物理标记组由在汤旺河、绥芬河水域放流的物理标记群体(剪脂鳍)的回归个体组成,人工增殖放流苗种的亲鱼均来自各河流的回归群体;人工养殖组由人工养殖的大麻哈鱼个体组成,大麻哈鱼亲本采自乌苏里江回归群体,经人工繁殖的受精卵发眼后转运至烟台东方海洋渔业公司,受精卵先在淡水中孵化,待幼鱼培育至体叉长7~10 cm后转移至盐度为28的海水工厂化车间养殖,养殖期间投喂人工饵料。
本研究大麻哈鱼样本共计15尾,其中自然野生组5尾,人工增殖锶标记组2尾,人工增殖物理标记组5尾,人工养殖组3尾(见表1)。其中大麻哈鱼自然野生组及人工增殖组样本于2016和2018年采捕于绥芬河东宁段、乌苏里江虎头镇江段以及汤旺河汤原段(见图1),江河样本采捕方式为刺网(网目大小10 cm)。对采捕的大麻哈鱼样本现场测量体叉长、称量体质量。人工养殖组大麻哈鱼样本来自于2014和2015年大麻哈鱼受精卵转运至烟台东方海洋渔业公司的养殖群体,并于2016年10月采集于该公司的养殖车间。所有实验样品带回实验室测量、解剖,取出矢耳石,经去离子水清洗、室温干燥后待用。

图1 样品采集点Fig.1 Sampling sites
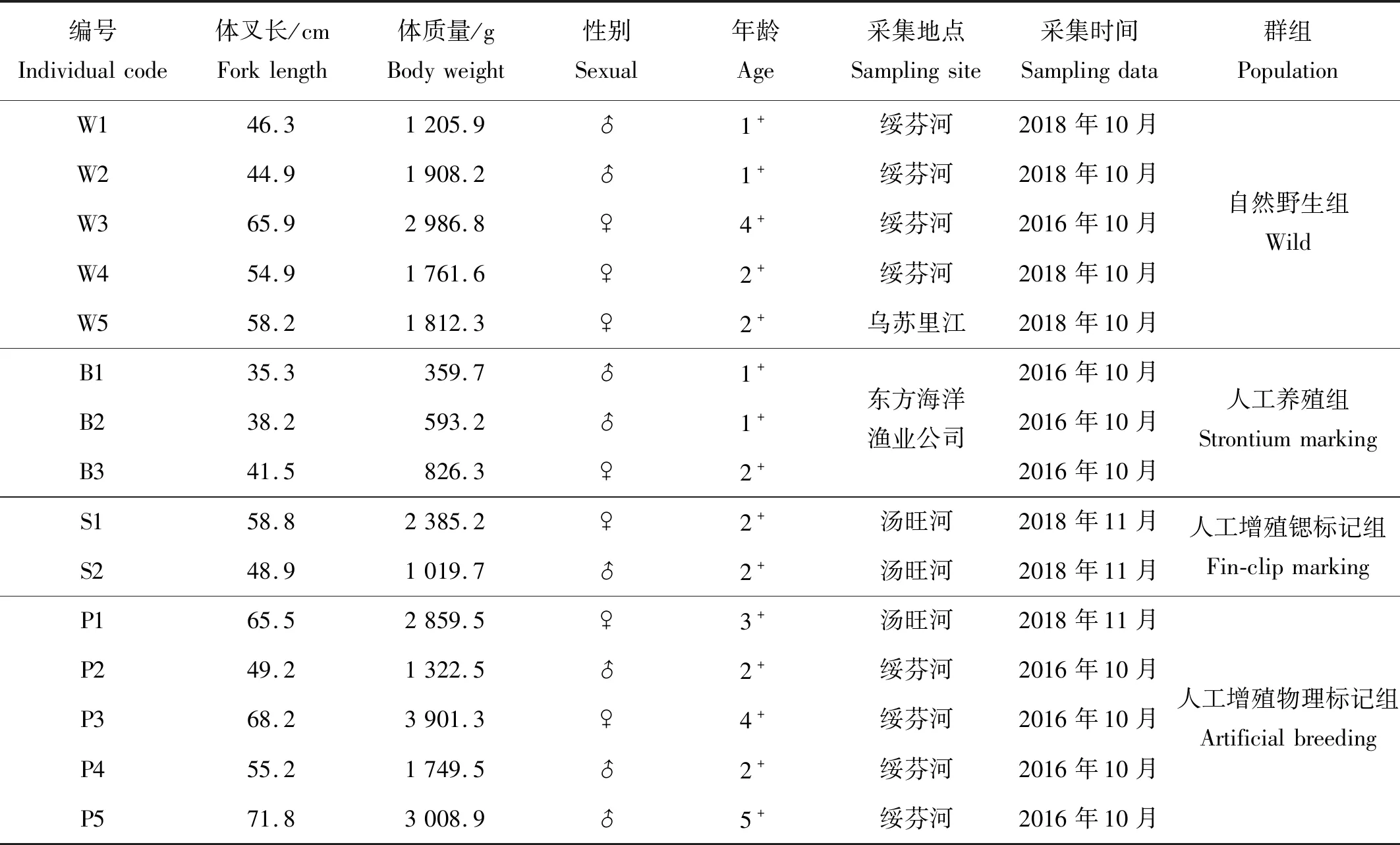
表1 大麻哈鱼样本基本信息Table 1 Basic information of Oncorhynchus keta samples
1.2 耳石微化学方法
元素微化学分析统一选用左矢耳石为实验材料,使用环氧树脂将耳石样品包埋、固定,用切割机、磨抛机将耳石切割、打磨,精磨至耳石核心区域,采用有机织布抛光盘抛光,使耳石核心完全暴露且表面无明显划痕。将处理后的耳石树脂块放入MQ水中超声清洗5 min,室温晾干24 h。完全晾干后将样品置于真空镀膜机(JEE-420,日本JEOL公司)中蒸镀碳膜(36A,25S)。采用EPMA(JXA-8100,日本JEOL公司)对样本进行Sr、Ca元素分析。
定量线分析 标准样品使用碳酸钙CaCO3和钛酸锶SrTiO3;机器条件为加速电压15 kV,电子束电流2.0×10-8A,每点驻留时间为15 s。此外分析束斑直径和间距分别为5和10 μm。检测时沿着垂直于耳石头、尾部连线且过耳石核心的直线,从耳石核心至耳石背部边缘进行耳石Sr/Ca值的定量线分析。
面分布分析 机器条件为加速电压15 kV,电子束电流5.0×10-7A,每点驻留时间为30 ms;束斑直径5 μm,像素7 μm×7 μm。
1.3 淡水系数RC
根据Jiang等的公式[17],大麻哈鱼的淡水系数RC=Rf/RT,式中Rf为自耳石核心沿定量分析线方向至对应淡水生境(低Sr/Ca值)区域结束时的径长,RT为沿定量分析线从耳石核心至边缘的耳石径长。该系数反映了洄游性鱼类早期生活在淡水环境中的时间占整个生活史时间的比例,也体现了洄游性鱼类对淡水生境的依存程度。
2 结果
2.1 大麻哈鱼耳石Sr/Ca值的定量线分析
大麻哈鱼样本体叉长范围为35.3~71.8 cm,体质量范围为359.7~3 901.3 g,年龄范围为1+~5+龄,样本的其他基本信息见表1。大麻哈鱼耳石样本定量线分析结果显示(见图2),耳石Sr/Ca值波动明显,Sr/Ca值范围为0.6×103~21.5×103。Sr/Ca值显著变化反映其生境转换,据此可将各组大麻哈鱼的生活史阶段进行划分(见表2)。大麻哈鱼自然野生组的生活史分为四个阶段:第一个阶段Sr/Ca值平均为4.201×103,为受精卵发眼期至卵黄囊吸收完前期;第二个阶段Sr/Ca值平均为2.577×103,为Sr/Ca值的低值区,该阶段为卵黄囊吸收完至降海前期;第三个阶段Sr/Ca值平均为6.154×103,为海洋生活阶段;第四个阶段Sr/Ca值平均为5.421×103,为溯河洄游至淡水河流生活阶段。同理,根据Sr/Ca值可将人工增殖锶标记组、人工增殖物理标记组、人工养殖组大麻哈鱼生活史分别划分为6个、4个和3个阶段(见表2)。可见,根据耳石微化学特征分析的各组大麻哈鱼具有相似的生活史特征,但也存在一定的差异性。

表2 大麻哈鱼耳石径长Sr/Ca值变化及对应生活史阶段Table 2 Sr/Ca value of otolith diameter length and corresponding life stages of Oncorhynchus keta

(图中红色虚线和数字表示年轮位置和编号。The red dotted line and numbers in the figure indicate the location and the number of the annual ring.)图2 大麻哈鱼耳石Sr/Ca值定量线分析Fig.2 Fluctuation of otoliths Sr/Ca concentration ratios along line transects from the core (0 μm)to the edge in otoliths of Oncorhynchus keta
根据大麻哈鱼耳石微化学分析结果计算大麻哈鱼不同生活阶段的耳石径长参数。如图3所示,RT为大麻哈鱼耳石核心至边缘的径长、Rf1为早期淡水生活阶段时的耳石径长、Rf2为上溯至淡水河流生活阶段时的耳石径长、RL为大麻哈鱼卵黄囊吸收完至幼鱼降海前期的耳石径长跨度。结果显示大麻哈鱼自然野生组与其他3组(人工增殖锶标记组、人工增殖物理标记组和人工养殖组)之间耳石的径长参数(Rf1和RL)差异显著。为了便于表述,下文将上述3组统称为人工增养殖组。由表3可知,自然野生组:120 μm≤Rf1≤200 μm,20 μm≤RL≤30 μm,0.06≤RC≤0.10;人工增养殖组:240 μm≤Rf1≤470 μm,80 μm≤RL≤200 μm,0.15≤RC≤0.29。可见两组间Rf1、RL和RC值的范围无交集,差异显著,可作为大麻哈鱼群组间鉴别的依据。
根据大麻哈鱼体叉长与耳石径长的正比例关系,结合耳石径长参数可推算各阶段的体叉长(见表3)。由Rf1推算大麻哈鱼幼鱼降海期的体叉长(L0),自然野生组:33.27 mm≤L0≤47.83 mm;人工增养殖组:75.27 mm≤L0≤165.63 mm。可见,人工增养殖大麻哈鱼降海期幼鱼的体叉长显著高于自然野生组。
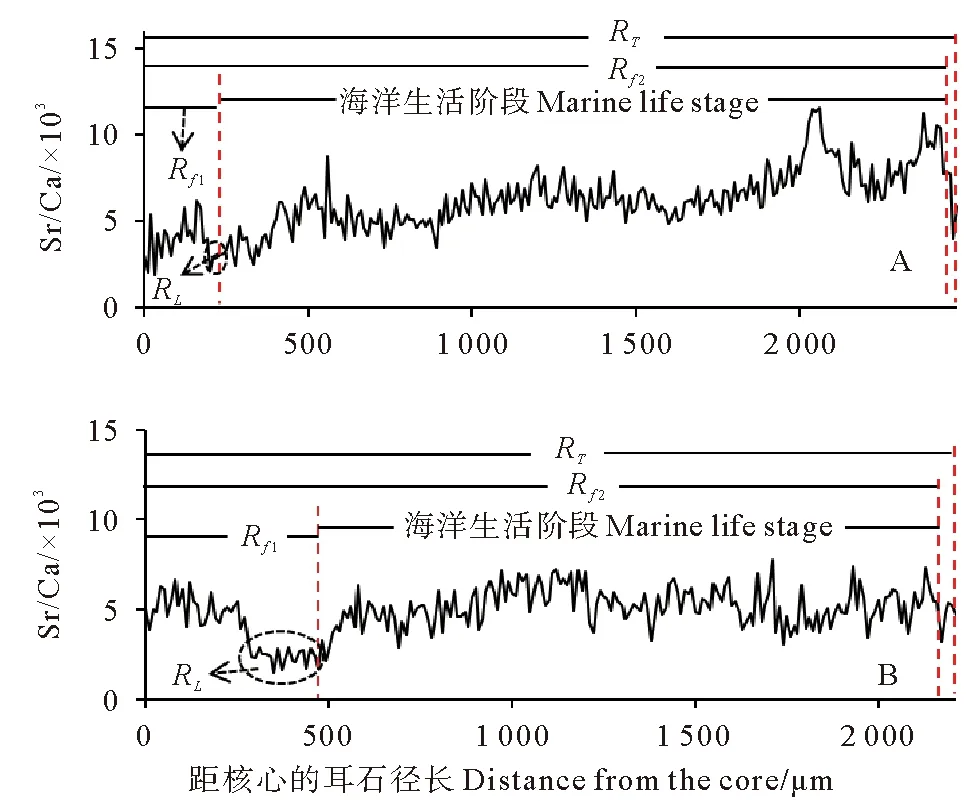
(A为自然野生组,B为人工增养殖组。A stand for wild group,B stand for artificial group.)图3 大麻哈鱼自然野生组与人工增养殖组不同生活阶段耳石径长(距耳石核心的长度)参数特征Fig.3 Characteristics of otolith length parameters (distance from the core)in different life stages of wild and artificial groups of Oncorhynchus keta

表3 大麻哈鱼耳石径长内锶和钙微化学及微结构变化Table 3 Fluctuation of Sr and Ca microchemistry and microstructure in otoliths of Oncorhynchus keta
2.2 大麻哈鱼耳石Sr含量的面分布
耳石Sr含量的面分析更能直观的展示鱼类个体的生境特征。由图4可知,大麻哈鱼样本耳石剖面均包含3种颜色:蓝、黄、红,这3种颜色分别代表锶含量浓度值依次递增。除耳石锶标记个体外其余样本耳石中心区域均呈现黄色,自核心区域向外扩展呈现黄色、蓝色及黄、红色区域等交替出现。说明耳石锶元素含量先下降,后增加,随后在高值区波动。耳石锶标记组个体在早期标记阶段区域呈现红色的高锶环,这是有别于其他非标记组个体的主要特征。其他区域锶含量的变动规律和非锶标记群体基本一致。可见,耳石锶元素面分析的分布规律和定量线分析中Sr/Ca值的结果一致。

图4 大麻哈鱼耳石锶含量的面分析(图片编号同表1)Fig.4 Otolith Sr content of Oncorhynchus keta with X-ray intensity mapping analysis(The picture number is the same as that in table 1)
3 讨论
3.1 大麻哈鱼生活史特征
对大麻哈鱼生活史的研究能更全面的掌握其生态习性,有助于对其资源的保护。由于研究区域限制我国境内仅能对河流中的大麻哈鱼回归群体和降海幼鱼进行调查,无法了解其海洋阶段的生活史。耳石微化学分析为鱼类生活史特征研究提供了一种新的有效的研究手段[6,18]。鱼类将体内吸收的元素沉浸在耳石中而不会被分解,通过耳石元素分析能够反演鱼类生境特征信息[19-20]。其中耳石中锶元素浓度与水体的盐度成正相关关系[21-23],通过耳石锶元素浓度及Sr/Ca值能够反演其栖息水体的盐度[24-27],分析其关键生活史特征。本研究中大麻哈鱼自然野生组耳石样本核心区Sr/Ca值约为4×103,随着径长的增加该值逐渐下降((2~3)×103),形成Sr/Ca值的低值区,随后该值逐渐升高,此后Sr/Ca值在高值区波动,最后阶段呈下降趋势。这主要因为大麻哈鱼受精卵在发眼期形成耳石核心[28],在其受精卵发眼期至卵黄囊吸收完期间,耳石元素主要来源于母体的卵黄囊,卵黄囊吸收完之后耳石中的Sr元素主要受淡水环境的影响。卵黄囊的形成主要在海洋生活阶段,其锶元素的含量高于淡水环境。故耳石核心区的Sr浓度以及Sr/Ca值高于其后的纯淡水生活阶段[14]。大麻哈鱼幼鱼降海进入咸水后Sr/Ca值逐渐升高,在海洋生活阶段大麻哈鱼Sr浓度及Sr/Ca值在高值区波动,这主要是由不同海域水体环境以及大麻哈鱼自身生理因素的影响所致[13]。
根据Sr/Ca值定量线分析可将大麻哈鱼生活史划分为早期淡水孵化阶段、海洋生活阶段、溯河洄游至淡水阶段等,结合耳石微结构分析可推测大麻哈鱼各生活阶段的体叉长等信息以及大麻哈鱼在各生长阶段栖息环境信息。表2显示了大麻哈鱼自然野生组幼鱼降海进入咸水区的体叉长范围为33.27~47.83 mm,据调查大麻哈鱼野生群体降海期幼鱼的体叉长为3~4 cm,可见大麻哈鱼顺水流降河迁移入海期间时间较短,在河流中不做长时间停留。这种现象在大麻哈鱼幼鱼降海行为的观察实验中得到证实[29]。大麻哈鱼溯河洄游阶段耳石锶元素受海洋生活环境的滞后效应和溯河期淡水环境的双重影响,在此阶段内的大部分耳石样本的Sr浓度及Sr/Ca值呈下降趋势,但个别样本由于进入淡水环境的时间较短,这种现象并不显著。
大麻哈鱼人工增殖锶标记组个体在其早期淡水孵化阶段由于锶标记的影响,耳石Sr浓度以及Sr/Ca值(约17×103)显著高于其他未标记组(Sr/Ca值为(2~4)×103)。这也体现了锶标记组个体具有在高锶环境中的生活史。锶元素在耳石上的沉积具有滞后性[15,30],本研究中锶标记的滞后期对应耳石径长上的距离大概为20 μm。该组个体在锶标记后的耳石微化学特征和其他组相似,体现了大麻哈鱼组间的个体在降海、海洋中的迁移等相似的生活史特征。人工增殖物理标记组个体所划分的生活史阶段以及Sr/Ca值范围和自然野生组相似。人工养殖大麻哈鱼和其他群组相比没有上溯至淡水河流的生活阶段,仅体现其淡水-海水之间生境变化的特征。可见,除锶标记组之外,其他组间个体的生活史特征相似,但是大麻哈鱼耳石径长参数(如Rf1和RL)在人工增养殖和自然野生群组个体之间存在显著的差异,这也体现两群组间个体早期生活环境的不同。综上所述,耳石微化学分析能够成功反演大麻哈鱼的生境履历,揭示其关键生活史特征。
3.2 大麻哈鱼不同群组间的鉴别
大麻哈鱼人工增殖群体与自然野生群体的鉴别是增殖放流效果评估工作的前提,标记技术在群体鉴别工作中发挥重要作用。大麻哈鱼人工增殖放流苗种的标记方法主要有物理标记(剪脂鳍)、耳石锶标记和温度标记等[15-16,31]。其中耳石锶标记方法安全、高效,在鱼类增殖放流工作中应用广泛[14,32]。本研究中大麻哈鱼锶标记组中的个体通过在流动孵化水体中加入SrCl2·6H2O水溶液(每日两次)进行锶标记,Sr2+初始浓度为30 mg/L。分析结果表明大麻哈鱼耳石标记区Sr/Ca值约为17×103左右,虽低于在静置水体中标记方法的值[15],但该方法足以将标记和非标记群组有效区分。锶标记方法可根据Sr2+浓度梯度、标记时期及时间跨度的不同而将不同放流批次的群体进行有效的区分,能够实现对不同批次、不同地点放流群体辨别的目的。
除锶标记组外,本文基于耳石微化学分析方法利用自然野生组和人工增养殖组个体在早期淡水孵化环境的差异来进行群组间的鉴别。人工培育的大麻哈鱼受精卵在流水中孵化,水源为地下水,水温恒定,较自然野生组孵化水体(河流)的水温高,发育更快。人工培育大麻哈鱼放流时期和自然野生组幼鱼降海期(4—5月)基本一致(作者调查数据,未发表),故人工增养殖组大麻哈鱼卵黄囊吸收完至降海期间的淡水生长阶段长于自然野生组。因此,大麻哈鱼人工增养殖组耳石径长参数Rf1、RL和淡水系数RC显著高于自然野生组,据此可有效区分两群组。此鉴别方法不需对放流苗种进行特定的标记,仅利用两群组间个体早期孵化环境的不同而进行区分。但此方法仅能对大麻哈鱼自然野生组和人工增养殖组间个体鉴别,不能区分不同放流批次的个体,且该方法仅适用于大麻哈鱼等溯河洄游性鱼类,对其他非淡、海水间洄游的鱼类并不适用。
本文通过耳石微化学手段分析大麻哈鱼不同组间样本耳石Sr浓度及Sr/Ca值,反演了各组个体的生境履历。根据大麻哈鱼不同组间个体在淡水孵化阶段栖息环境的差异,采用耳石微化学、微结构分析将自然野生和人工增养殖个体进行有效的区分。为探究大麻哈鱼洄游生活史特征及其生态意义提供重要参考,为大麻哈鱼群体鉴别及增殖放流效果评估工作提供重要的研究手段。

