不同CT-RED校准曲线对肿瘤靶区和危及器官剂量分布的影响研究
杨彦举,钟 阳,胡伟刚,高大地,赵 俊
复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
临床放疗中,使用治疗计划系统(treatment planning system,TPS)计算肿瘤靶区和周围正常组织的剂量分布是基于精确计算机体层成像值-相对电子密度(computed tomography value to the relative electron density,CT-RED)校准曲线进行的,因此建立一条准确的CT-RED曲线进行组织不均匀性校准对放疗尤为重要。将CT值与相对电子密度建立关联通常是对已知物理密度的组织替代物校准模体进行CT扫描得到的[1-3]。由于剂量在组织中的累积与组织的RED密切相关,CT值与RED值的不准确匹配将直接导致TPS计算得到的剂量分布与实际治疗时差异较大,严重时会导致肿瘤局部控制率下降和正常组织出现并发症风险升高[4]。
因此,在建立CT-RED校准曲线时应严格遵循TPS验收标准,不同机构给出相应的CT校准曲线和公差精度。国际原子能机构(International Atomic Energy Agency,IAEA)将范围从肺部到软组织再到骨骼的CT容差值设为±20。对于高密度骨骼,英国医学物理与工程学会(Institute of Physics and Engineering in Medicine,IPEM)、欧洲放射治疗与肿瘤学学会和瑞士放射生物学与医学物理学学会的CT容差值为±50;对于软组织,IPEM指南给出±10的容差值;对于肺部组织,因其特殊的组织结构,IPEM报告仅给出±4的容差值[5-8]。关于建立CT-RED曲线的影响因素已有大量团队研究,如扫描电压和电流、图像采集的层厚、扫描模体、扫描床板、扫描场的大小及图像重建算法等[9-14]。为保证TPS中剂量计算的准确性,建立与每台CT机和扫描协议相对应的CT-RED校准曲线是必要的。随着放疗技术的快速发展,在某些放疗中心存在不同厂家CT定位机的情况,需要根据不同型号CT模拟机及不同部位临床扫描协议建立多条CT-RED校准曲线。这给物理师在设计放疗计划时选择CT-RED曲线带来较大困扰,若选择错误可能会导致临床治疗中的剂量累积差异较大。
因此,有必要探究使用不同CT-RED校准曲线对计算靶区剂量分布的影响。本研究主要在3种典型病例(鼻咽癌、肺癌和宫颈癌)中评估不同CT-RED校准曲线对计算肿瘤靶区和危及器官(organ at risk,OAR)中剂量分布的影响。为降低选择不匹配校准曲线的风险,本研究将多条CT-RED曲线优化为一条,并通过剂量学评估使用改良CT-RED曲线替代原始校准曲线的可行性。
1 材料和方法
1.1 实验设备及CT-RED曲线建立
本研究使用CIRS-062型电子密度模体(美国CIRS公司),其整体横断面为椭圆形(长短轴分别为33和27 cm),中心内嵌圆柱(直径18 cm),分别模拟人体的躯干和头部。模体的基底材料为等效固体水(密度为1.00 g/cm3),嵌入两层呈对侧排布的8对已知电子密度的圆柱形模体插件(直径3 cm),中心为固体水插件,分别模拟人体肌肉、肺、脂肪、肝、乳腺、疏松骨密质骨和水等。使用的CT定位机有两台,分别为荷兰Philips公司的Brilliance TM Big Bore CT和德国Siemens公司的Somatom Definition AS CT。
对CIRS-062模体扫描前,本研究对实验中的两台CT机按装机验收流程进行机械和能量质控,使其符合标称值;摆位时,使用三维激光定位系统对准模体两侧和顶部定位标志;扫描时,为与临床工作状态保持一致,对两台CT定位机分别使用不同的临床扫描协议(头部、腹部和胸部协议)。根据不同CT机和扫描协议,获取插件的CT值并建立6条CT-RED校准曲线,分别为飞利浦头部协议(Philips head protocol,PHP)、飞利浦胸部协议(Philips thorax protocol,PTP)、飞利浦腹部协议(Philips abdomen protocol,PAP)、西门子头部协议(Siemens head protocol,SHP)、西门子胸部协议(Siemens thorax protocol,STP)和西门子腹部协议(Siemens abdomen protocol,SAP)。最后将以上校准曲线导入Pinnacle3 TPS(version 8.0,荷兰Philips公司)中用于剂量计算。
除直接扫描CIRS-062模体建立的CT-RED曲线外,本研究还优化出一条综合6条校准曲线的改良CT-RED校准曲线。CT值和RED值取决于物质密度,它改变了X射线与物质之间康普顿散射、光电效应和电子对效应的占比,CT值会随组织模体插件的密度增大而增大,但不呈线性关系[15-16]。在CT-RED校准曲线优化过程中,根据插件的质量密度不同,本文将其分为3个密度范围:A≤0.5 g/cm3,0.5 g/cm3<B≤1.16 g/cm3,C>1.16 g/cm3,详见图1。不同的扫描协议在图像重建时使用的优化策略不一,对同一密度插件可能产生20%的CT值偏差,最终影响剂量积累[17]。因此,在低密度区域(A)中,优化时剔除头部扫描协议获得的CT值;在中等密度区域(B)中,不同协议间CT值差异很小,对6条曲线取平均值;在高密度区域(C)中,去除胸部扫描协议获得的CT值,以减少其对牙齿和骨骼等高密度物质CT值的影响。
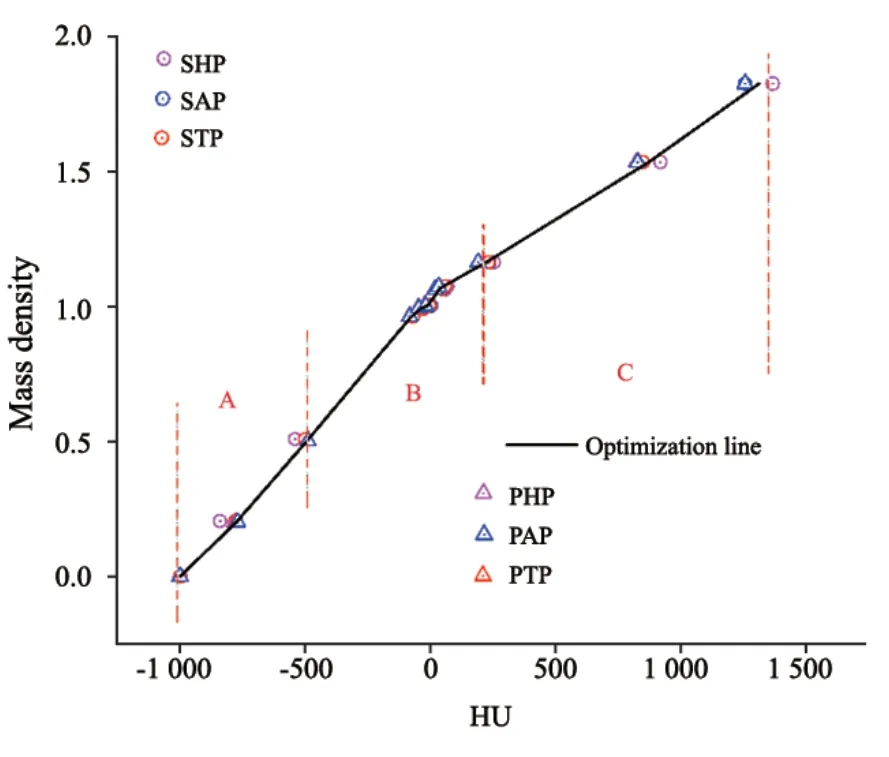
图1 基于不同协议对CIRS-062电子密度模体扫描建立的CTRED曲线Fig.1 The CT-RED curve of CIRS-062 electronic density phantom scanning based on different protocols
1.2 放疗计划制定及数据评估
本研究分别选取16例头颈部、胸部及腹部肿瘤患者,放疗计划均采用静态调强放疗技术在Pinnacle3 TPS中使用6 MV光子线基于自适应卷积算法进行剂量计算,剂量网格为3 mm。表1给出统计各计划靶区(planning target volume,PTV)和OAR的评价指标。用RayStation Research 4.7.5.4进行剂量信息的统计,并采用Wilcoxon配对符号秩检验在SPSS 22.0软件中对剂量学差异进行评估,采用MIM软件进行剂量学3D gamma分析。

表1 各计划统计指标和OARTab.1 The statistical indicators and OAR of each plan
患者的放疗处方如下:
①头颈部肿瘤:均为鼻咽癌患者,70.4 Gy(2.2 Gy×32次)7例,70 Gy(2 Gy×35次)7例,66 Gy(2 Gy×33次)2例,每个计划均为9个照射野。
② 胸部肿瘤:均为肺癌患者,60 Gy(2 Gy×30次)6例,剩余病例处方剂量为30~63 Gy不等,每个计划5~9个照射野。
③腹部肿瘤:均为宫颈癌患者,50.4 Gy(1.8 Gy×28次)9例,其余7例辅助性放疗或姑息性放疗处方剂量为45.0~57.6 Gy不等,每个计划7~9个照射野。
2 结果
2.1 CT值
在两台CT定位机工作性能符合验收标准的条件下,使用Philips和Siemens各自头部、胸部和腹部扫描协议对CIRS-062模体进行扫描,获得各插件平均CT值(表2)。根据前文提到的优化策略得到改良CT-RED校准曲线如图1中黑线所示。若以Philips定位机CT值为基准,两台CT定位机之间的HU值差异如图2所示。同一台CT定位机不同协议间对同一插件产生的差异较小,不同CT间差异稍大,主要存在于肺和骨插件中。胸部和腹部协议之间的CT值差异在调试指南范围内,但在头部协议中,最大HU偏差达到105.1,由此可见,不同厂家机器对低密度和高密度材料的响应存在差异。
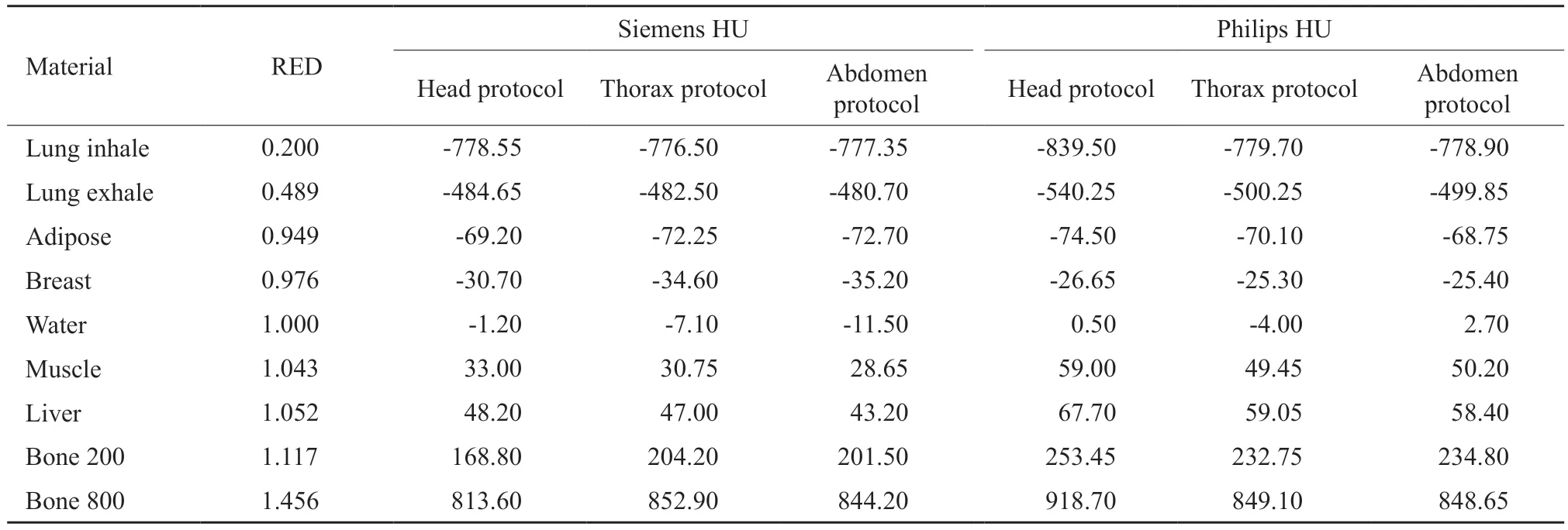
表2 CIRS-062型电子密度模体各插件的CT值Tab.2 CT values of each plug-in unit of CIRS-062 electronic density module
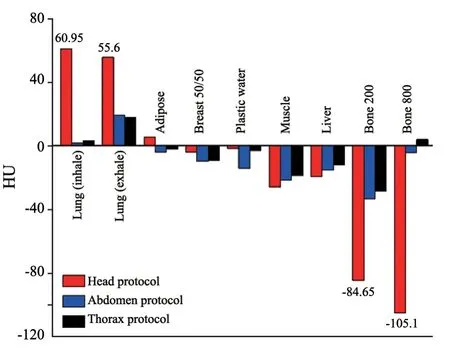
图2 各插件CT值在Philips和Siemens CT定位机头部、腹部和胸部协议中的差异Fig.2 The differences of CT values of each plug-in unit in Philips and Siemens CT with the protocols of head,abdomen and chest
2.2 头颈部肿瘤剂量学评估
鼻咽癌患者的放疗计划首先使用PHP校准曲线参与剂量计算,计划完成后再选择另外5条基于不同CT和扫描协议建立的CT-RED校准曲线进行计算。在RayStation TPS中分别获得基于各CT-RED校准曲线的相对剂量及绝对剂量与基准剂量的差异分布图(图3),其中以PHP得到的剂量为基准。从图3中可看出,剂量差异较大的位置是牙齿,最大差异达到1.36%(90cGy);基于Philips CT定位机不同扫描协议获得的剂量累积没有明显差异,但基于SiemensCT定位机的剂量累积在牙齿和体表边缘偏高或偏低。为进一步分析各OAR的剂量差异,对16例鼻咽癌患者PTV和OAR剂量的均值进行统计(图4)。由于配对数据差值不满足正态分布,所以本研究选择Wilcoxon配对符号秩和检验。图4中标红的为使用当前校准曲线与PHP校准曲线计算得到的剂量具有显著差异。从总体来看,基于不同CT定位机获取的校准曲线计算的剂量在PTV上没有显著差异,但在某些OAR上具有一定差异,且主要存在于不同机器间。
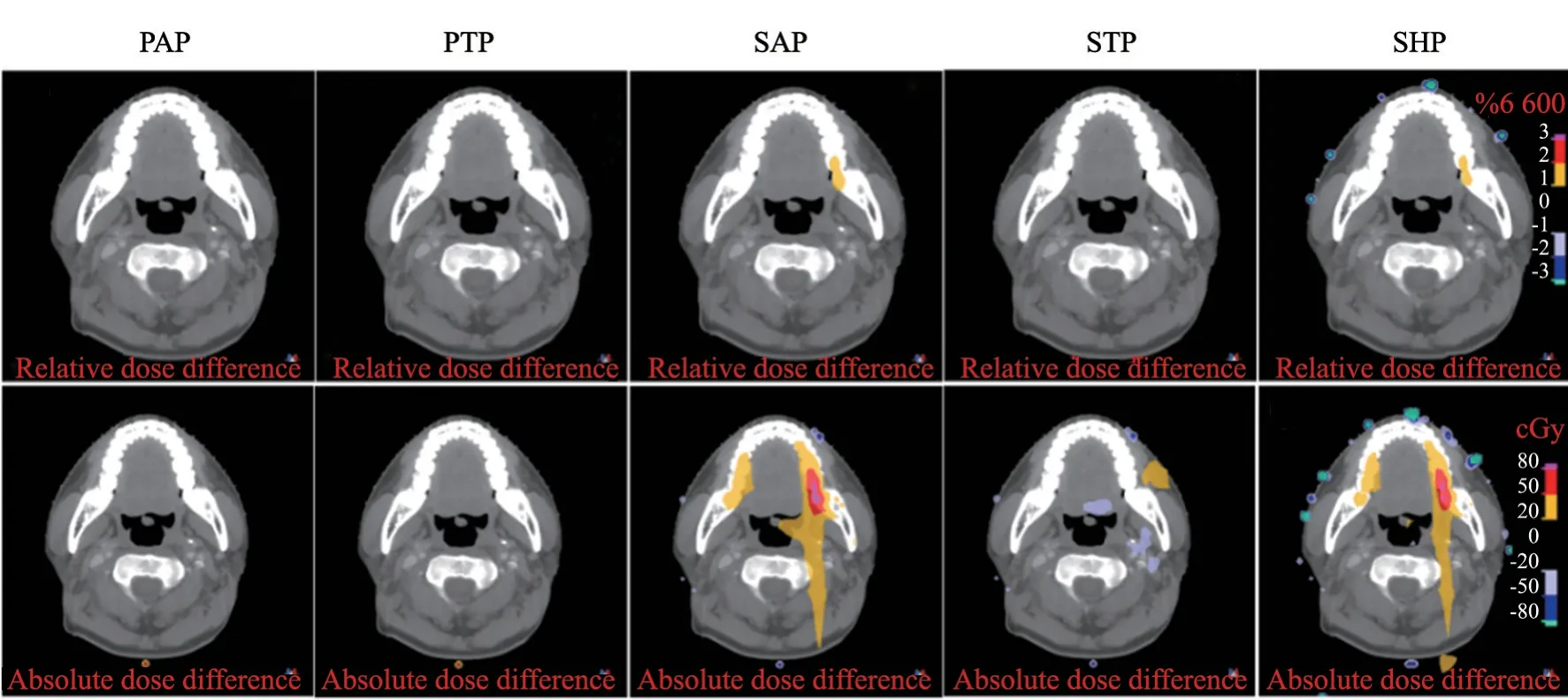
图3 基于不同扫描协议计算的鼻咽癌相对和绝对剂量与基准剂量之间差异分布图Fig.3 The distribution of the difference between the relative or absolute dose and the reference dose of nasopharyngeal carcinoma calculated based on different scanning protocols
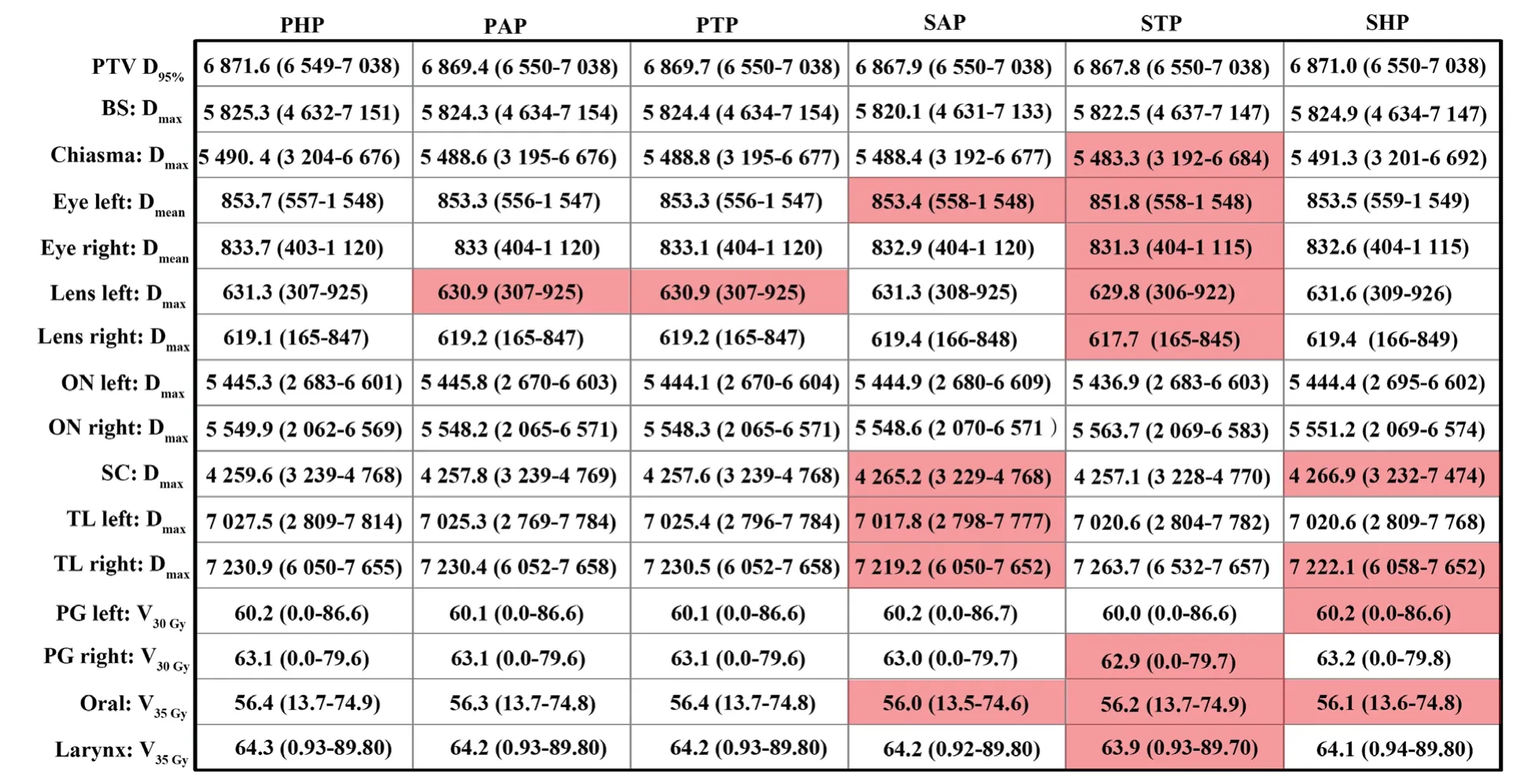
图4 16例鼻咽癌患者基于6条CT-RED校准曲线的剂量累积均值Fig.4 The mean dose of 16 nasopharyngeal carcinoma patients based on 6 CT-RED calibration curves
2.3 胸部肿瘤剂量学评估
为探究不同CT-RED校准曲线对肺癌剂量分布的影响,以PTP校准曲线为剂量计算参考基准,再使用其余CT-RED参与剂量计算。图5展示了1例基于各校准曲线获得的相对和绝对剂量与基准剂量之间的差异分布图。从图5中可看出,只有在采用SHP协议时剂量分布有明显差异,最大剂量差异达到2.5%(150 cGy),基于其他扫描协议的剂量分布差异可以忽略。图6展示了16例肺癌患者PTV和各OAR的剂量信息。PTV的剂量积累在使用Philips定位机的CT-RED曲线时没有差异,但在使用STP和SHP协议时存在显著差异。此外,左右肺V5Gy的剂量在其他5个协议中均有显著差异,脊髓在较多协议间也出现差异,说明胸部组织的剂量累积对CT-RED校准曲线较敏感。这主要是因为胸部的特殊空腔结构,脊髓位于周围骨性结构的包围中,CT值变化锐利,剂量累积对RED值偏差较敏感。
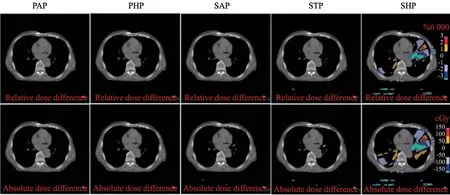
图5 基于不同扫描协议肺癌剂量与基准剂量差异的分布图Fig.5 The distribution of lung cancer dose based on different scanning protocols

图6 16例肺癌患者基于6条CT-RED校准曲线的剂量累积均值Fig.6 The mean dose of 16 lung cancer patients based on 6 CT-RED calibration curves
2.4 腹部肿瘤剂量学评估
对于腹部肿瘤,本研究选择16例宫颈癌病例进行剂量学分析。对每例宫颈癌患者的放疗计划首先使用PAP参与剂量计算,然后再使用其余5条CT-RED进行计算。图7展示了基于各CTRED校准曲线获得的相对和绝对剂量与基准剂量之间的差异分布图,以PAP作为参考标准。从图7中可看出,不同CT-RED校准曲线对宫颈癌剂量分布影响较小,最大绝对剂量差异不到1%(30 cGy)。图8展示了PTV和各OAR的剂量统计信息。统计结果显示,在膀胱V45Gy的剂量累积在使用其他扫描协议的CT-RED校准曲线时有显著差异,在脊髓、直肠和肾等OAR没有或仅有一条校准曲线出现显著差异。说明两台CT定位机对腹部的图像重建基本一致,因此,各部位剂量累积未出现较大差异。
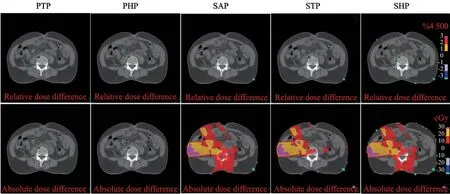
图7 基于不同扫描协议计算的宫颈癌剂量与基准剂量之间的差异分布图Fig.7 The distribution of the difference between the doses of cervical cancer based on different scanning protocols
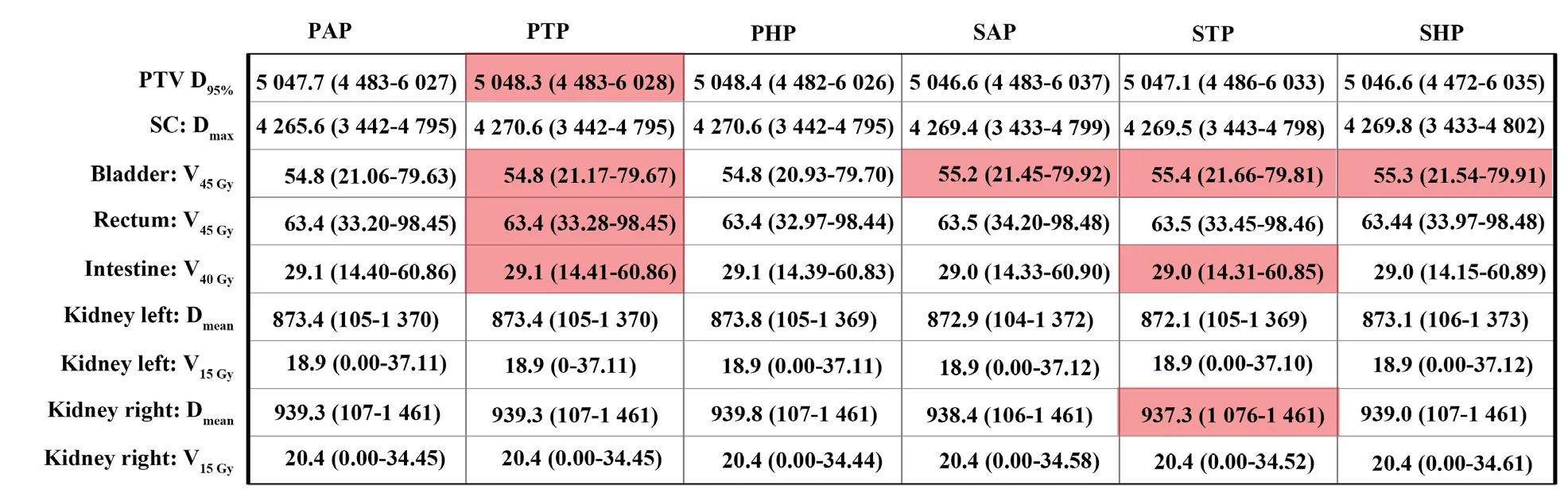
图8 16例宫颈癌患者基于不同CT-RED校准曲线的剂量累积均值Fig.8 The mean dose of 16 patients with cervical cancer based on different CT-RED curves
2.5 基于改良CT-RED校准曲线的剂量学评估
本研究选取头颈部、胸部和腹部3个部位肿瘤各5例使用优化后的CT-RED校准曲线进行剂量计算,然后与基于对应PHP、PTP和PAP建立CT-RED曲线得到的剂量进行比较,得到相对和绝对剂量的差异分布图(图9),并进一步统计出各病例PTV和OAR的剂量差异(图10)。结果显示,基于改良CT-RED校准曲线得到PTV和OAR的剂量与相应基线剂量差异均小于1%,其中各指标的差异平均值均在±0.3%内,该偏差满足IAEA对TPS的容差值(1%~2%)[5],充分证明本中心建立的改良CT-RED校准曲线对各部位肿瘤的剂量计算稳定可靠。为进一步说明改良CT-RED曲线与原始临床方案校准曲线之间的剂量学差异,本研究分别选取鼻炎癌和肺癌病例使用MIM软件进行了3D gamma剂量学分析。基于改良CT-RED的剂量分布与基于PHP和PTP校准曲线之间的剂量分布比较,鼻咽癌gamma通过率(1%和1 mm)为100.0%;肺癌gamma通过率(1%和1 mm)为99.9%。以上结果表明,本研究优化的CT-RED可以替代原始测量的CT-RED曲线用于Pinnacle3 TPS进行剂量计算。
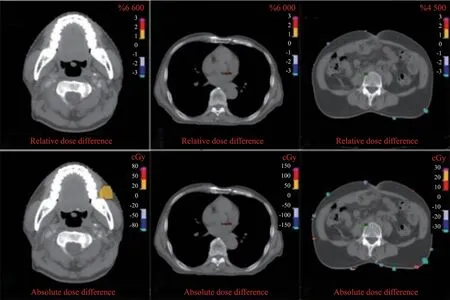
图9 基于优化后CT-RED校准曲线与各部位标准CT-RED校准曲线计算的相对和绝对剂量差异分布图Fig.9 The distribution of relative and absolute dose differences calculated based on optimized CT-RED calibration curve and standard CTRED calibration curve of different cancer
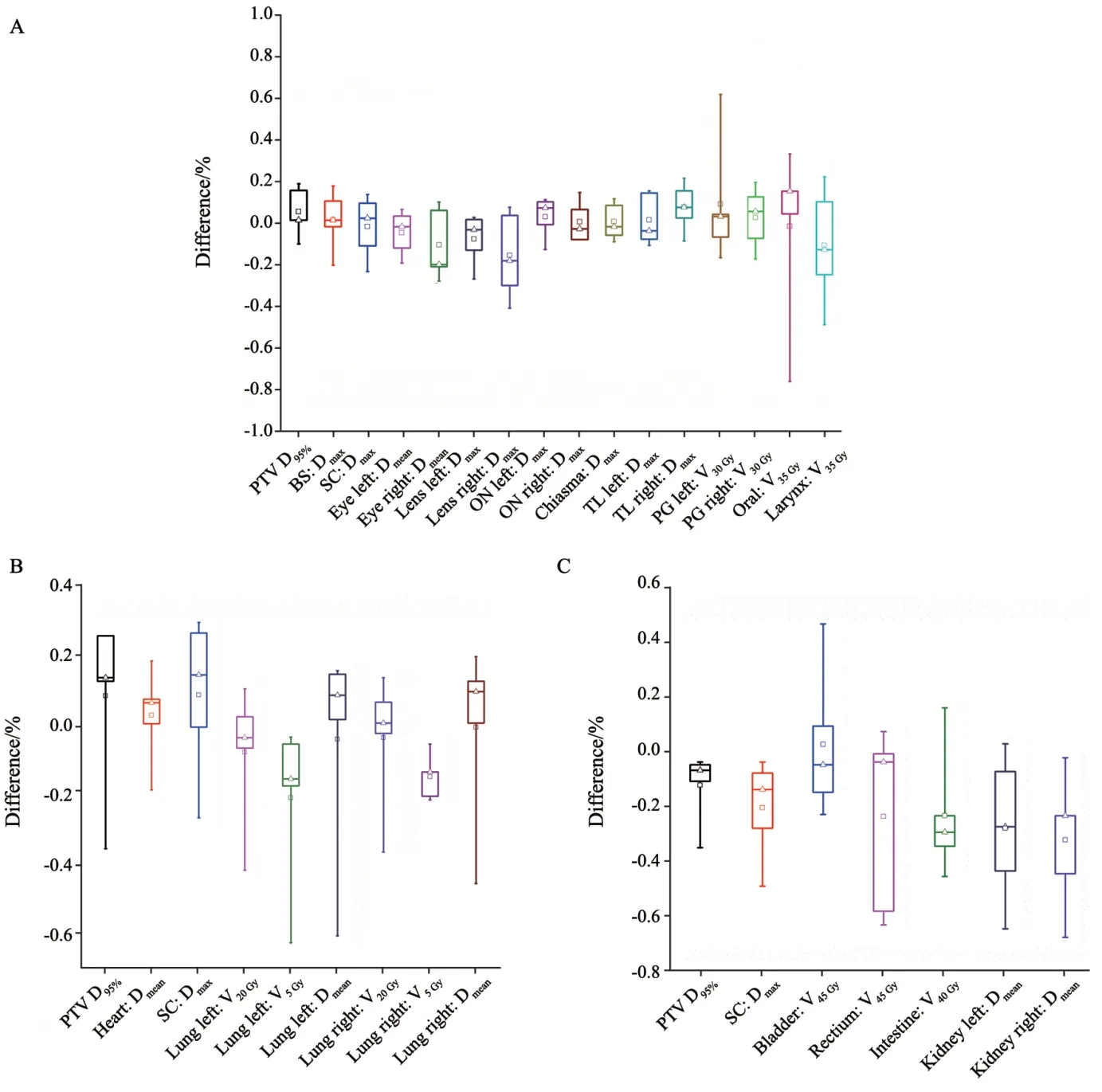
图10 15例不同肿瘤PTV和OAR的剂量差异图Fig.10 The dose difference of PTV or OAR in 15 cases with different cancers
3 讨 论
创建CT-RED组织不均匀校准曲线的常规方法是将已知电子密度材料的不连续CT值导入TPS。多项研究[10-12]表明,不同CT定位机的CT校准曲线有所不同,特别是物理密度较大的材料,CT值的变化程度取决于CT设备、扫描参数(管电流、工作电压和重建算法)和扫描模体,但不同校准曲线对各肿瘤放疗计划的剂量影响还没有定量描述。当前国内获得临床使用许可的TPS对组织剂量的计算误差都在IAEA和IPEM等机构的要求范围内,所以要通过放疗计划提高组织剂量计算的准确性,关键在于准确地获得CT值。因此,对拥有多台CT定位机的放疗中心来说,在日常放疗工作较繁忙的情况下,优化出个性化的CT-RED校准曲线对于精确计算剂量和减少流程误差是一种可选择的方案。本研究已验证其可行性,意义等同于不同直线加速器间的束流匹配。
本研究首先进行基于不同CT定位机和扫描协议获得的多条CT-RED校准曲线,分析不同扫描协议间对同种物理密度材料获得CT值的差异。本研究结果显示,不同CT间的差异主要存在于头部协议,可能因为头部存在大量密质骨,导致CT值波动较大,该协议不适合用于其他部位的扫描,这一结论在很多研究[9-13]中均有验证。此外,在多病种放疗计划的剂量学评估中,根据对PTV和正常组织OAR的剂量学评估结果可知,剂量学的差异主要存在于不同CT定位机间;同台CT机基于不同扫描协议计算得到的剂量差异主要存在于胸部,而其他OAR剂量差异较小。若以Philips扫描协议为基准,头部和胸部在使用STP建立的CT-RED校准曲线计算的剂量在很多OAR中的差异均有统计学意义,而在腹部的剂量学差异较小。因此,在物理师进行放疗计划设计过程中,人为因素导致的CT-RED校准曲线选择错误,会导致剂量分布有较大偏差。基于这个角度,对现有的多条校准曲线进行优化非常有必要。如何设计满足临床要求的改良校准曲线成为本研究的重点,通过不同肿瘤的研究发现,鼻咽癌的剂量分布在使用肺部协议时会导致高密度牙齿部分出现超过3%处方剂量偏差。对比图1可知,使用胸部扫描协议对高密度物质CT的重建偏差较大,最后导致TPS中剂量偏差严重,最大达到150 cGy(2.5%),大大超出了TPS验收标准。由头部、胸部和腹部各部位的剂量学分析可知,不同部位的剂量分布对CT-RED校准曲线的敏感程度不同,因此不能简单地取平均值来优化CT-RED校准曲线,而需要根据各部位的结构特点采取不同的优化策略。基于该分析,本研究用不同的优化策略将CT-RED曲线分为3个部分,如图1中所示的A、B、C。在低密度区域(A)中,本研究在进行优化时剔除使用临床头部协议扫描获取的已知材料密度CT值,这样可以减少CT值差异导致CT-RED校准曲线的偏差;同样在高密度区域(C)中,本研究取平均值时剔除使用肺部协议扫描获取高密度的CT值;在中等密度区域(B)中,由于6条校准曲线剂量相对差异小于处方的1%,中间部分直接对6条曲线取平均值即可。最后本研究对基于本中心优化的CT-RED校准曲线计算的PTV和OAR进行剂量学评估,结果显示,在头部和胸部与基于标准协议获得的剂量分布保持超高的一致性,与原始校准曲线计算得到的剂量差异平均值均在±0.3%内,距离基线1 mm内1%容差的gamma通过率分别达到100.0%和99.9%。
综上所述,不同的CT-RED校准曲线会导致PTV覆盖范围和OAR剂量的差异。利用本研究优化出的适用于不同CT机及扫描协议的改良CTRED校准曲线算出的剂量与原始校准曲线的差异均在1%内,证明使用一条改良CT-RED校准曲线对不同CT机获得的图像进行剂量计算是可行的。

