多西他赛联合胸腺肽α1对大鼠乳腺癌免疫微环境中Treg数量的影响及其机制研究
曹爱玲,曹 喆,周 剑
咸宁市中心医院/湖北省科技学院第一临床医学院肿瘤科,湖北 咸宁 437000
乳腺癌是常见的女性恶性肿瘤之一,目前,中国乳腺癌的发病率逐年上升,且发病年龄呈现年轻化趋势,严重威胁女性的生命健康[1]。乳腺癌常规的治疗手段包括手术、放疗、化疗及内分泌治疗等。随着治疗手段的进步和女性健康意识的增强,乳腺癌的死亡率基本保持平稳[2],但乳腺癌类型中的三阴性乳腺癌仍是临床治疗的难题,其预后较差,转移复发的风险较高,无法有效控制病情[3]。因此,寻求一种新型、有效、安全的治疗方法对乳腺癌患者有重要的临床意义。近年来,肿瘤的免疫治疗成为研究热点。临床研究[4-5]显示,多种恶性肿瘤(如乳腺癌、胃癌等)患者体内存在免疫失衡,表现为免疫负性因子调节性T细胞(regulatory T cell,Treg)数量异常升高,提示Treg在肿瘤免疫中有重要作用,可能促进肿瘤进展,并抑制肿瘤特异性免疫。多西他赛(docetaxel,DCT)是第二代紫杉烷类化疗药物,对于乳腺癌治疗的临床效果较好[6]。胸腺肽α1(thymosin α1,Tα1)是一种免疫增强剂,可诱导T细胞的发育和成熟,增强患者的免疫功能[7]。宋晓丹等[8]研究显示,将免疫调节剂乌司他丁与DCT联用,可通过调节肿瘤微环境中Treg数量,抑制小鼠乳腺癌的生长。但DCT联合Tα1用于乳腺癌的报道较少,本研究旨在探究DCT联合Tα1对大鼠乳腺癌免疫微环境Treg数量的影响及其相关机制,为乳腺癌的临床用药提供实验依据。
1 材料和方法
1.1 细胞株和动物
SHZ-88大鼠乳腺癌细胞株购自美国ScienCell公司。无特定病原体(specific pathogen free,SPF)级SD大鼠由中国科学院上海实验动物中心提供[动物许可证号:SCXK(沪)2019-0010],6~8周龄,雌性,体重180~220 g,常规饲养1周,使其适应环境。
1.2 试剂和仪器
DCT注射液购自江苏恒瑞医药股份有限公司(国药准字H20080366,规格:1.5 mL∶60 mg),胸腺肽肠溶片购自吉林康乃尔药业有限公司(国药准字H20065576,规格:15 mg×12片),原位末端转移酶标记(TdT-mediated dUTP nick end labeling,TUNEL)试剂盒购自瑞士Roche公司(批号11772465001),流式细胞术用试剂购自美国Beckman Coulter公司,白介素10(interleukin 10,IL-10,批号KE1435)、转化生长因子-β(transforming growth factor-β,TGF-β,批号KE1443)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自美国Immonoway公司,程序性死亡受体-1(programmed death receptor-1,PD-1,批号为018L3521)兔单克隆抗体、程序性死亡受体-1配体(programmed death ligand 1,PD-L1,批号为018L3018)兔单克隆抗体购自美国Abcam公司。
1.3 分组、造模与干预
将60只SD大鼠随机分为模型组、DCT组(剂量为10 mg/kg)、Tα1组(剂量为0.8 mg/kg)及3个DCT+Tα1组(DCT剂量为10 mg/kg,Tα1剂量分别为0.2、0.4、0.8 mg/kg),每组10只。以含有10%胎牛血清的RPMI-1640培养基培养SHZ-88细胞,收集生长状态良好的SHZ-88细胞,待细胞密集成片时加入胰蛋白酶进行传代培养,取对数生长期细胞制成2×107个细胞/mL的细胞悬液,于大鼠第4对乳腺处皮下注射50 μL SHZ-88细胞悬液,构建乳腺癌大鼠模型[9],对照组以等量0.9%NaCl溶液替代。观察并记录大鼠一般情况和肿瘤生长情况,10 d左右可在注射部位触及肿块,经H-E染色判断是否为肿瘤细胞。成瘤后,DCT组、Tα1组及DCT+Tα1组分别腹腔注射相应剂量的DCT、Tα1,给药周期均为20 d,1次/d;对照组和模型组以0.9%NaCl溶液替代。
1.4 样本采集与处理
干预结束后,采用颈椎脱臼法处死大鼠,剥离肿瘤组织,冻存于液氮罐中备用。肿瘤生长抑制率=(模型组肿瘤体积-治疗组肿瘤体积)/模型组肿瘤体积×100%。
1.4.1 TUNEL染色
将肿瘤组织固定于4%甲醛溶液中过夜,石蜡包埋后切片,参照TUNEL试剂盒说明书进行操作,在光镜下观察肿瘤细胞的凋亡情况并计数,细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.4.2 流式细胞术检测
提取肿瘤组织中的淋巴细胞,分管作抗体标记,加入染色缓冲液洗涤细胞后再加入固定剂和穿膜剂,避光条件下温育30 min;加入穿膜缓冲液洗涤后,重悬于染色缓冲液中,采用流式细胞术进行检测,以CD4+CD25+Foxp3+细胞/CD4+CD25+细胞反映Treg数量。
1.4.3 ELISA检测
将肿瘤组织冰上匀浆,以10000 r/min离心10 min,分离上清液,参照ELISA试剂盒说明书进行操作,检测肿瘤组织中IL-10、TGF-β的表达。
1.4.4 蛋白质印迹法(Western blot)检测
提取肿瘤组织中的总蛋白,取60 μg变性蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE);β-actin、PD-1、PD-L1一抗以1∶1000比例稀释,4 ℃下反应过夜;第2天,HRP标记二抗以1∶8000比例稀释,37 ℃下反应40 min;最后进行电化学发光(electrochemical luminescence,ECL)成像,以β-actin为内参,计算PD-1及PD-L1的相对表达量。
1.5 统计学处理
采取SPSS 20.0统计学软件进行数据分析,计量数据以表示,采用单因素方差分析进行多组间比较,组间两两比较采用q检验,P<0.05为差异有统计学意义。
2 结果
2.1 DCT联合Tα1对乳腺癌大鼠肿瘤组织形态学的影响
H-E染色显示,所取肿块组织中有椭圆形或圆形癌细胞,大小不一,染色质、核仁着色深,可见病理性核分裂象,细胞排列紊乱,呈弥漫性片状实性分布(图1),表明该组织为癌变组织,乳腺癌大鼠模型复制成功。与模型组相比,其他给药组细胞增大,肿瘤细胞开始坏死,且伴随有淋巴细胞和白细胞浸润,以DCT+0.8 mg/kg Tα1组肿瘤细胞抑制效果最显著。
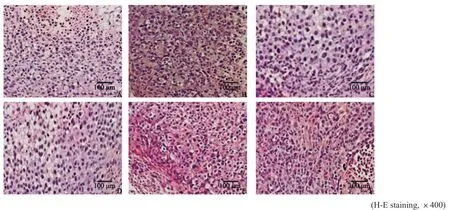
图1 DCT联合Tα1对乳腺癌大鼠肿瘤组织形态学的影响Fig.1 Effects of DCT combined with Tα1 on morphology of tumor tissues in breast cancer rats
2.2 DCT联合Tα1对乳腺癌大鼠肿瘤生长的影响
药物干预组均可显著抑制肿瘤的生长,DCT+0.8 mg/kg Tα1组抑制效果最显著,显著高于DCT组和0.8 mg/kg Tα1组(P<0.05,图2、3)。TUNEL染色结果见图4,各组肿瘤细胞凋亡率的差异有统计学意义(P<0.05),与模型组相比,药物处理组均可显著促进肿瘤细胞凋亡(P<0.05),其中DCT+0.8 mg/kg Tα1组细胞凋亡率显著高于DCT组和0.8 mg/kg Tα1组(P<0.05)。
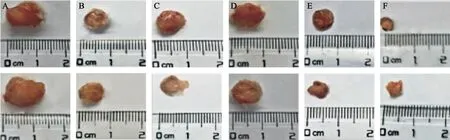
图2 各组乳腺癌大鼠剥离肿瘤组织Fig.2 The stripped tumor tissues of breast cancer rats in each group
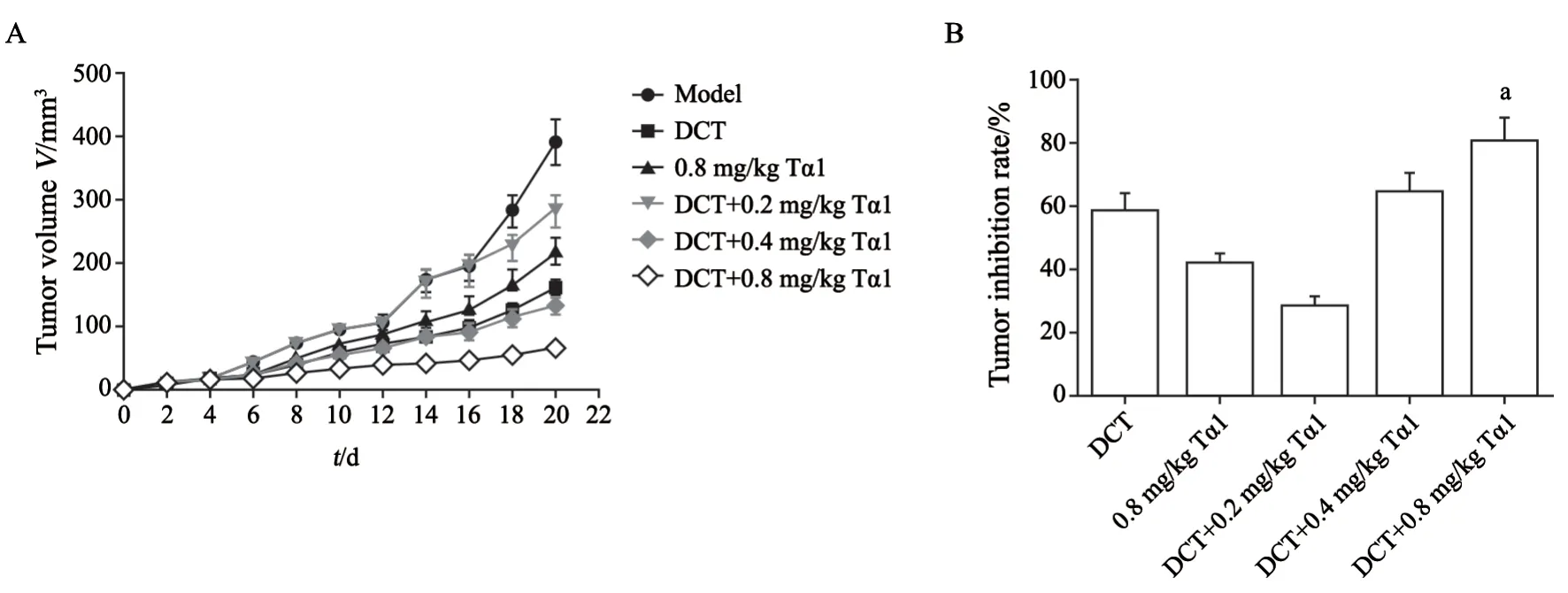
图3 DCT联合Tα1对乳腺癌大鼠肿瘤体积的影响Fig.3 Effects of DCT combined with Tα1 on tumor volume of breast cancer rats
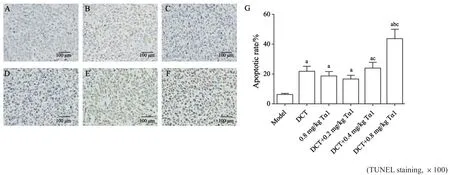
图4 DCT联合Tα1对乳腺癌大鼠肿瘤细胞凋亡的影响Fig.4 Effects of DCT combined with Tα1 on tumor cells apoptosis in breast cancer rats
2.3 DCT联合Tα1对肿瘤组织中Treg数量的影响
流式细胞术检测结果显示,各组肿瘤组织中CD4+CD25+Foxp3+Treg数量差异有统计学意义(P<0.05),与模型组相比,药物干预组均可显著下调CD4+CD25+Foxp3+Treg数量(P<0.05),其中DCT+0.8 mg/kg Tα1组下调作用最显著,显著低于DCT组和0.8 mg/kg Tα1组(P<0.05,图5)。

图5 DCT联合Tα1对肿瘤组织中Treg数量的影响Fig.5 Effects of DCT combined with Tα1 on number of Treg in tumor tissues
2.4 DCT联合Tα1对肿瘤组织中IL-10、TGF-β水平的影响
与模型组相比,药物处理组均可显著下调IL-10、TGF-β水平(P<0.05),其中DCT+0.8 mg/kg Tα1组IL-10、TGF-β水平显著低于DCT组和0.8 mg/kg Tα1组(P<0.05,图6)。

图6 DCT联合Tα1对肿瘤组织中IL-10和TGF-β水平的影响Fig.6 Effects of DCT combined with Tα1 on levels of IL-10 and TGF-β in tumor tissues
2.5 DCT联合Tα1对肿瘤组织中PD-1、PD-L1表达的影响
各组大鼠肿瘤组织中PD-1、PD-L1表达的差异有统计学意义(P<0.05),与模型组相比,药物干预组均可显著下调PD-1、PD-L1表达(P<0.05),其中DCT+0.8 mg/kg Tα1组下调作用最显著(图7、8)。
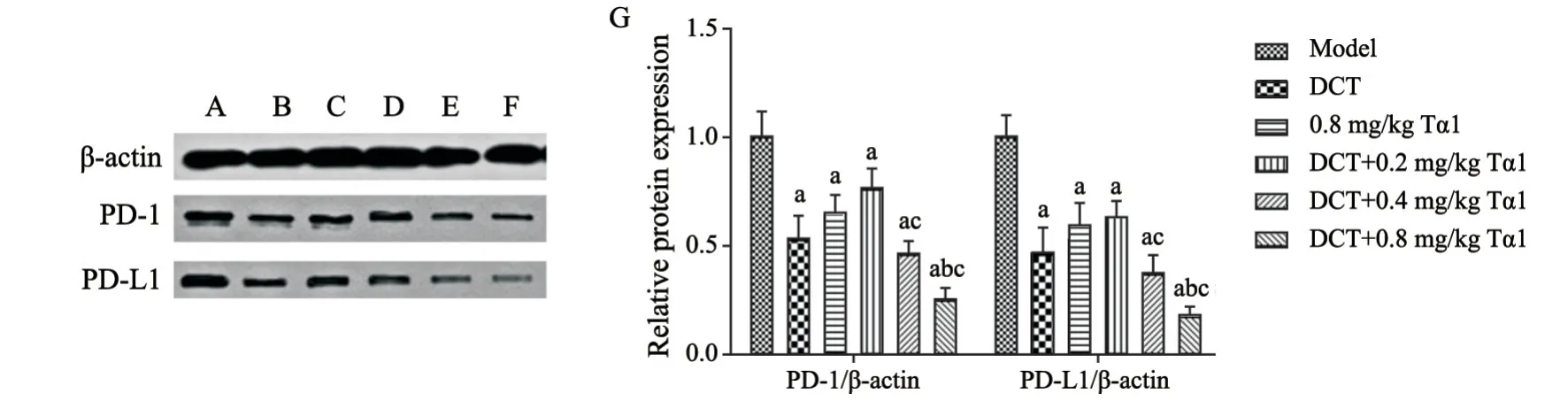
图7 DCT联合Tα1对肿瘤组织中PD-1和PD-L1表达的影响Fig.7 Effects of DCT combined with Tα1 on the expressions of PD-1 and PD-L1 in tumor tissues
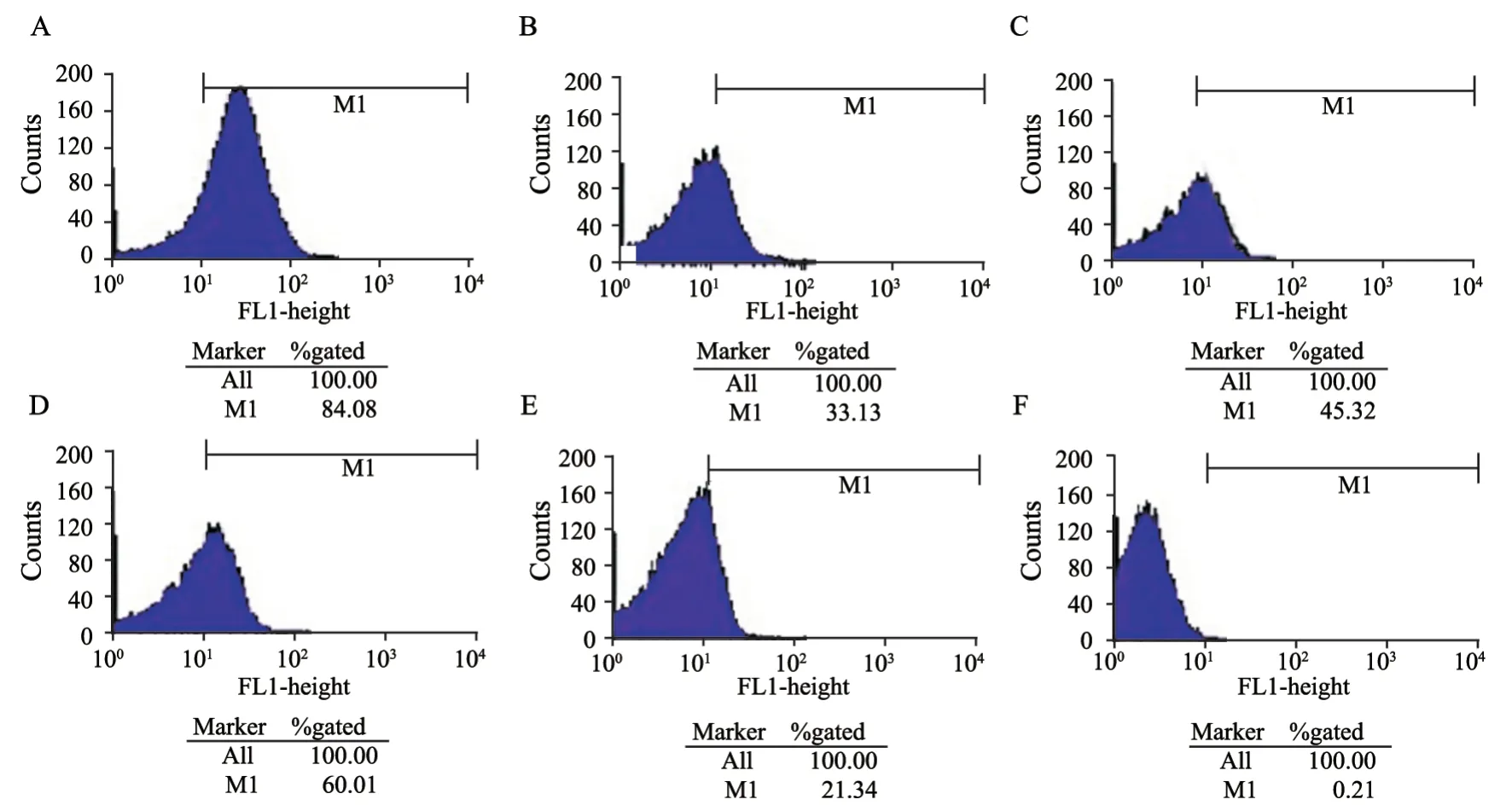
图8 各组表达PD-1的Treg数量的比较Fig.8 Comparison of the number of Treg with PD-1 expression among all groups
3 讨 论
本研究通过给雌性SD大鼠接种大鼠乳腺癌细胞系SHZ-88,建立移植瘤模型,10 d左右注射部位可触及肿块组织,H-E染色结果显示为癌组织,提示乳腺癌大鼠模型复制成功。Tα1可通过调节炎症反应水平对机体免疫功能产生影响,临床已应用于癌症、感染、免疫缺陷等疾病的治疗。Vladimirova等[10]研究显示,应用Tα1辅助治疗晚期乳腺癌患者的效果较好,可抑制肿瘤血管的生成。Guo等[11]研究指出,Tα1可通过PTEN介导PI3K/AKT/mTOR通路抑制乳腺癌细胞增殖,并诱导其凋亡。本研究发现,Tα1组可控制大鼠肿瘤组织体积,抑制其生长,同时促进肿瘤细胞的凋亡,与Wang等[12]的研究结果相似,提示Tα1可能通过解除免疫抑制状态,增加对肿瘤细胞的免疫力。而DCT联合Tα1对肿瘤的抑制效果更好,提示联用Tα1可增强DCT的抗肿瘤效果,Tα1可以改善免疫功能,增强对肿瘤的抑制作用。
肿瘤微环境内多种因素参与调控肿瘤与免疫系统的相互作用,如局部效应细胞的功能障碍、Treg和T细胞代谢活性的负调节等。最近研究[13]指出,肿瘤微环境的免疫抑制可能削弱免疫治疗的效果。因此,正确调节肿瘤微环境的免疫抑制状态可能成为肿瘤治疗的新方向。Treg是一类负性免疫调控作用的T细胞,可激活TGF-β、IL-10等细胞因子的释放,活化和募集更多的Treg,抑制抗肿瘤的效应T细胞[14]。大量数据表明,TGF-β、IL-10可以通过增强肿瘤细胞运动功能并抑制免疫功能等促进肿瘤的侵袭和转移,参与肿瘤的逃逸和转移过程[15-16]。本研究结果显示,DCT联合Tα1后,CD25+Foxp3+Treg数量、IL-10及TGF-β水平显著下降,提示DCT联合Tα1可能通过降低Treg浸润,减少TGF-β、IL-10的分泌,增强机体对肿瘤细胞的免疫能力。
近年来有研究[17]指出,PD-1/PD-L1信号通路可介导负性免疫调节通路,促进肿瘤免疫逃逸。PD-1分布于Treg表面,是Treg发挥免疫抑制作用的重要分子;而PD-L1可诱导Treg发育和成熟,与TGF-β有协同作用[18]。本研究结果显示,DCT联合Tα1可显著下调肿瘤组织中PD-1、PD-L1表达,提示DCT联合Tα1可能通过抑制PD-1/PD-L1信号通路,降低Treg浸润,从而减轻肿瘤免疫抑制状态,抑制肿瘤的生长。
综上所述,本研究报道了DCT联合Tα1对乳腺癌大鼠肿瘤组织的抑制作用,其中DCT+0.8 mg/kg Tα1效果最佳,初步分析其调控机制可能是通过抑制PD-1/PD-L1信号通路调节肿瘤免疫微环境,不仅为临床DCT和Tα1的联合应用提供了全新的理论依据,同时也为乳腺癌带来新的治疗思路。

