HMGB1与乳腺癌患者临床病理学特征及免疫指标的相关性研究
张小艳,李清祥,刘 勇,李 航,仇丽娟,封欣然,谭立明
1.南昌市第三医院检验科,江西 南昌 330009;
2.南昌大学第二附属医院检验科,江西 南昌 330006
乳腺癌是女性常见的恶性肿瘤之一,也是导致女性死亡的主要原因。该病发病率高、侵袭性强,且在疾病早期就可向远处发生转移,严重威胁着女性健康[1]。高迁移率族蛋白1(high mobility group box 1,HMGB1)是一种DNA结合蛋白,在细胞因子刺激下和细胞死亡时分别以主动和被动形式释放于细胞外,是一种典型的损伤相关分子模式(damage-related molecular patterns,DAMP)分子[2]。据文献[3-4]报道,HMGB1高表达与多种肿瘤的发生、发展及治疗有关,并参与炎症、免疫、增殖、转移和自噬等多种信号转导通路的调节。本研究通过对乳腺癌患者空芯针穿刺活检物HMGB1水平进行检测,分析HMGB1与患者临床资料、细胞和体液免疫指标的相关性及对新辅助化疗效果的预测价值,以探究HMGB1与乳腺癌发生、发展、免疫功能及临床治疗的关系。
1 材料和方法
1.1 研究对象
纳入2019年5月—2020年10月南昌市第三医院确诊并接受新辅助化疗的乳腺癌患者120例,年龄27~80岁,平均年龄(53.98±1.32)岁。其中Ⅱb期68例,Ⅲa期26例,Ⅲb期14例,Ⅲc期12例。所有受试者均自愿参与本研究,并签署患者知情同意书,本研究经医院伦理委员会批准。
1.2 纳入和排除标准
纳入标准:①入选研究者均通过乳腺空芯针穿刺活检或术后病理学检查证实为乳腺癌;② 均为初诊原发性乳腺癌;③患者基础资料翔实;④ 此前从未接受过放疗、化疗及内分泌治疗;⑤ 所有入选患者均符合2019年中国新辅助化疗专家治疗组制定的《中国乳腺癌新辅助治疗专家共识(2019年版)》[5]。排除标准:①合并严重心、肺、肝、肾脏等系统疾病,甲状腺疾病或糖尿病;② 合并有其他恶性肿瘤;③妊娠或哺乳期妇女;④ 中途不耐受化疗退出者。
1.3 新辅助化疗和组织匀浆制备
采取新辅助化疗的入选对象予以3个周期CET或CEP方案的新辅助化疗,化疗结束后再行乳腺癌手术。CET方案为:环磷酰胺500 mg/m2+表柔比星75 mg/m2+多西他赛75 mg/m2,静脉滴注,第1天,21 d为1个周期。CEP方案为:环磷酰胺500 mg/m2+表柔比星75 mg/m2+紫杉醇脂质体150 mg/m2,静脉滴注,第1天,21 d为1个周期。按照试剂使用说明书要求,用预冷磷酸盐缓冲液(phosphate-buffered saline,PBS)(0.01 mol/L,pH=7.4)冲洗穿刺活检物(经病理学检查明确为癌变组织)以及新辅助化疗结束后手术切除组织,称重后剪碎组织。将剪碎组织和PBS按照1∶9的重量体积比(1 g组织对应9 mL PBS)配好后,加入玻璃匀浆器中,置于冰上进行充分研磨,然后将匀浆液以5000×g离心5~10 min,取上清置于-80 ℃冰箱以待检测。
1.4 试剂与方法
通过南昌市第三医院病理科收集患者的临床病理学资料,包括临床分期、术后淋巴结转移、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)和Ki-67增殖指数。采集所有受试者空腹静脉(EDTA-K2抗凝)全血2.0 mL,采用流式细胞仪(型号FACSCanto Ⅱ,美国BD公司)测定CD3+、CD4+、CD8+T淋巴细胞及自然杀伤(natural killer,NK)细胞百分比。采用全自动特定蛋白分析仪(型号IMMAGE 800,美国Beckman Coulter公司)检测体液免疫球蛋白IgG、IgA、IgM以及补体C3、C4;采集非抗凝静脉血3.0 mL,离心分离血清,选用上海江莱生物科技有限公司酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒测定IL-10和TGF-β以及匀浆上清液中HMGB1的含量。
1.5 统计学处理
采用SPSS 22.0软件对数据进行统计学处理。计量资料采用Shapiro-Wilk检验和Levene’s检验分析数据的正态性和方差齐性。正态分布资料以x±s表示,偏态分布以[M(Q)]表示。两组间比较正态分布且方差齐时采用独立样本t检验,否则采用Mann-WhitneyU检验。采用Spearman相关性分析检验各指标间是否存在相关性。P<0.05为差异有统计学意义。
2 结果
2.1 HMGB1与乳腺癌患者临床病理学资料的相关性
将所有研究对象按照年龄、临床分期、淋巴结转移、ER、PR、HER2和Ki-67增殖指数进行分组比较,结果显示,Ⅱb期患者的HMGB1水平低于Ⅲ(Ⅲa、Ⅲb、Ⅲc)期,中位数分别为14.18和41.29 ng/mL,差异有统计学意义(P=0.001)。有淋巴结转移的乳腺癌患者的HMGB1水平显著高于未转移者,中位数分别为36.68和11.13 ng/mL,差异有统计学意义(P=0.001,表1)。
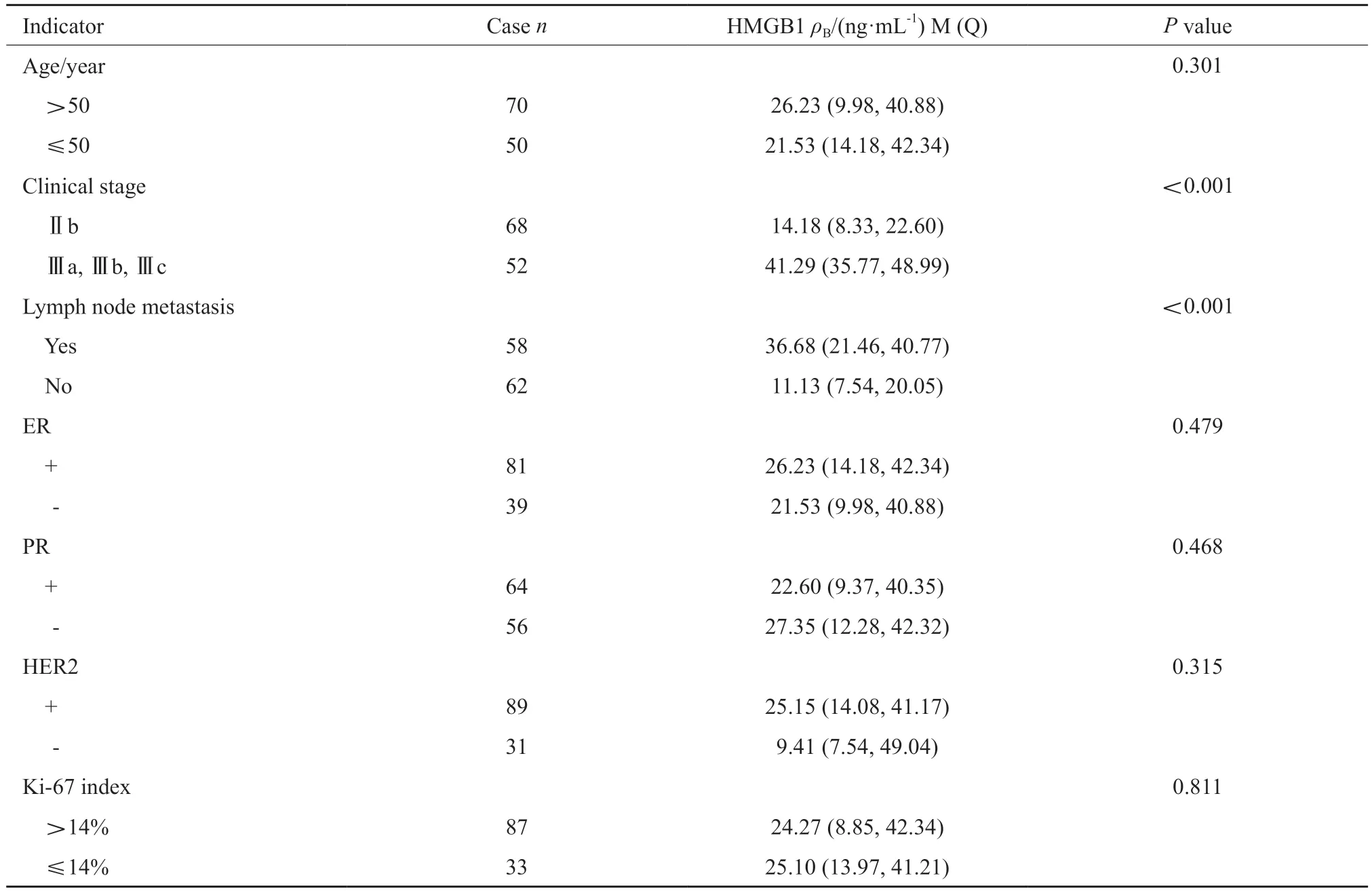
表1 HMGB1和乳腺癌患者临床病理学资料的相关性Tab.1 The correlation between HMGB1 and clinicopathological data of breast cancer patients
2.2 HMGB1水平和乳腺癌患者T淋巴细胞亚群的分析
通过95% CI计算得到HMGB1参考范围为(22.98,31.36)ng/mL,按照参考范围下限将入选的乳腺癌患者分为高水平组(HMGB1>22.98 ng/mL,47例)和低水平组(HMGB1≤22.98 ng/mL,73例),高水平组CD4+T细胞/CD3+T细胞低于低水平组(P<0.001),CD8+T细胞/CD3+T细胞高于低水平组(P<0.001),两组研究对象CD4+T细胞/CD8+T细胞和NK细胞/CD3+T细胞差异无统计学意义(P>0.05,图1)。
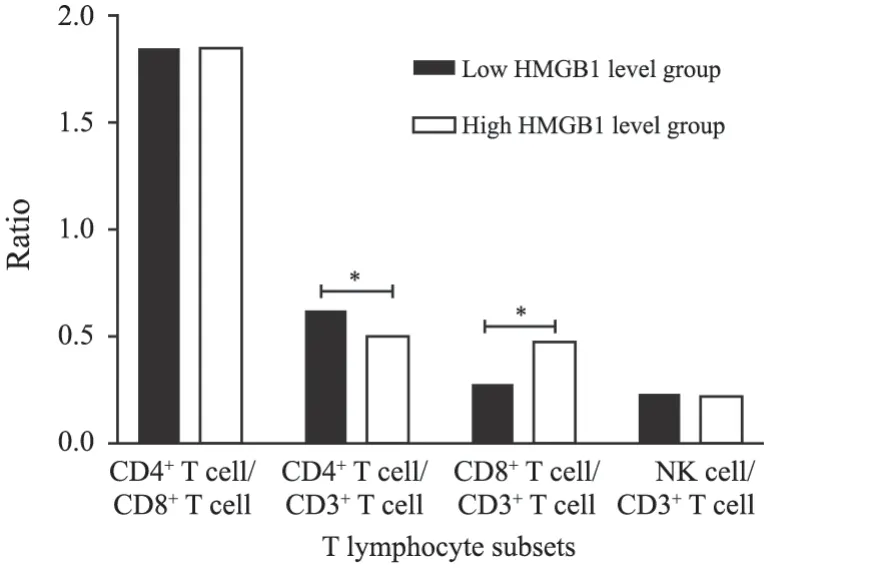
图1 不同HMGB1水平乳腺癌患者NK细胞及T淋巴细胞亚群的比较Fig.1 The comparison of NK cells and T lymphocyte subsets in
2.3 HMGB1水平和调节性T细胞(regulatory T cell,Treg)指标的相关性
经Spearman相关性分析,HMGB1与Treg相关指标IL-10、TGF-β呈显著正相关(r=0.734,P<0.001;r=0.686,P<0.001,图2)。
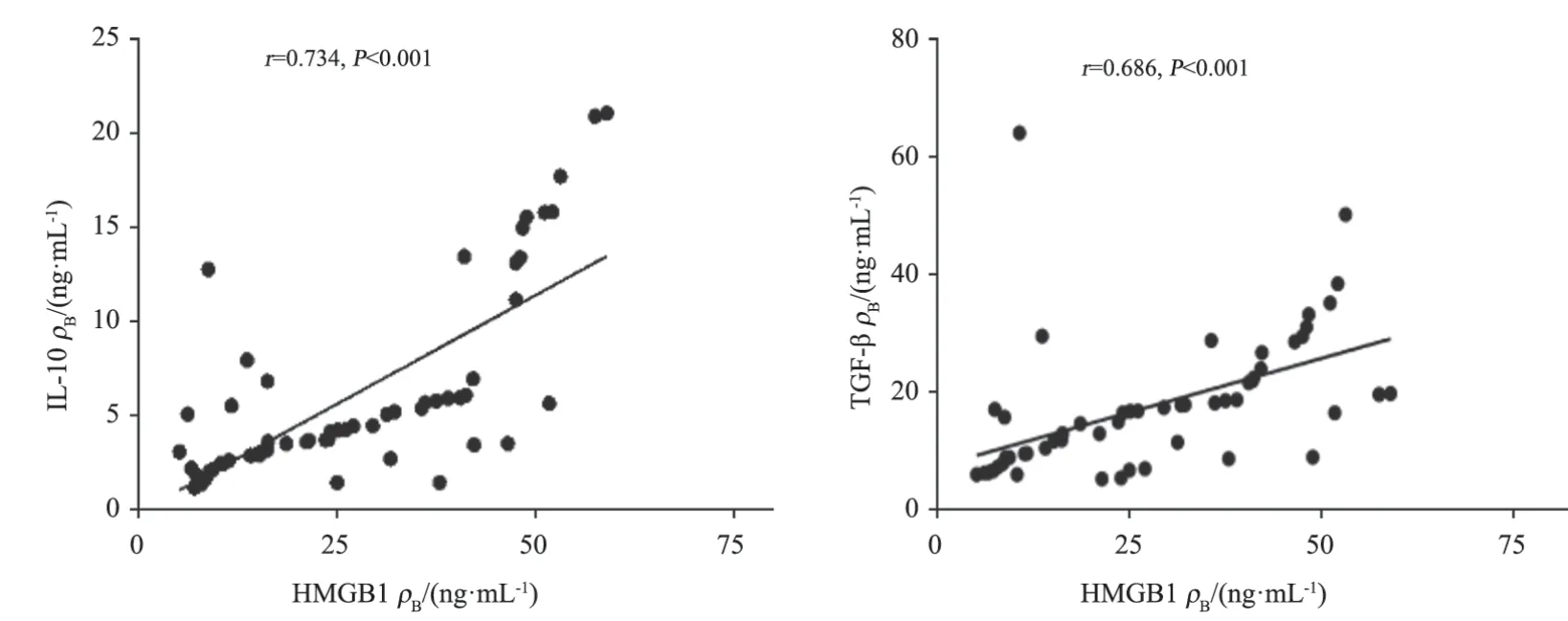
图2 HMGB1和Treg指标的相关性Fig.2 The correlation between HMGB1 and Treg indicators
2.4 HMGB1水平与实验室常规体液免疫分子的相关性
经Spearman相关性分析,HMGB1与体液免疫分子IgG、IgA、IgM以及补体C3、C4均不相关(P>0.05,表2)。
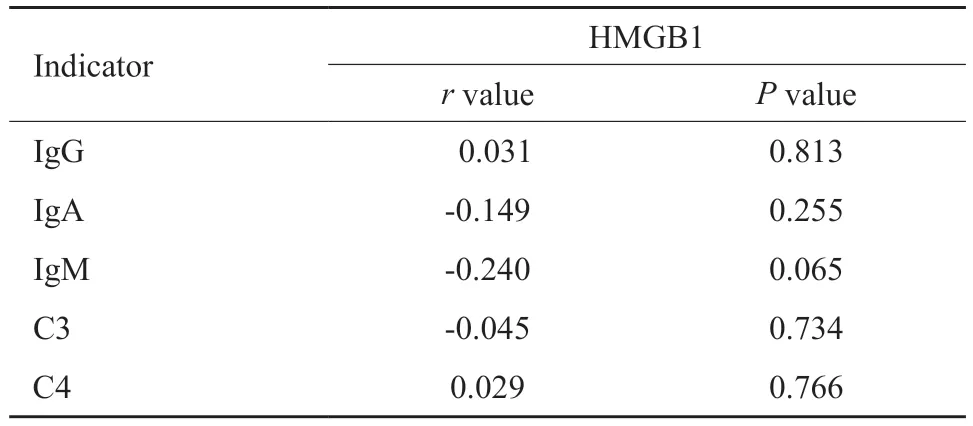
表2 HMGB1和实验室体液免疫分子的相关性Tab.2 The correlation between HMGB1 and laboratory humoral immune molecules
2.5 HMGB1对病理学完全缓解(pathological complete response,pCR)率的预测分析
根据Miller-Payne病理学反应性分级标准,将化疗疗程结束后手术切除癌组织切片和化疗前穿刺活检组织切片对比,比较镜下肿瘤细胞的退缩情况,病理学反应性分5级。G1级:肿瘤细胞较前无变化;G2级:肿瘤细胞密度减少<30%;G3级:肿瘤细胞密度减少31%~90%;G4级:大量肿瘤细胞减少91%以上;G5级(pCR):肿瘤完全消失,镜下未见浸润癌残留(可含有原位癌)。分析比较pCR组(12例)和非pCR组(108例)患者的HMGB1水平,结果显示,pCR组的HMGB1水平显著低于非pCR组(P<0.01,图3)。
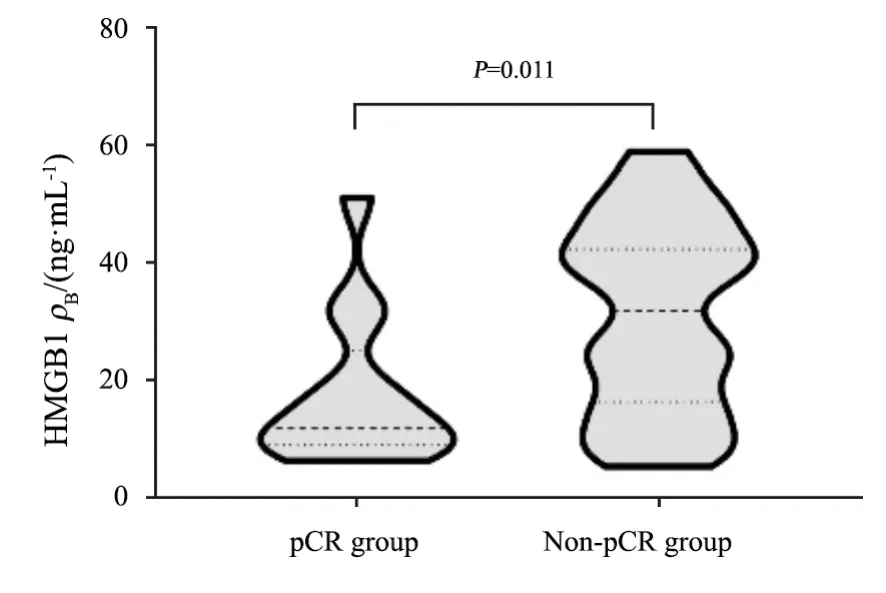
图3 HMGB1水平与新辅助化疗疗效关系Fig.3 The correlation between HMGB1 level and the efficacy of neoadjuvant chemotherapy
3 讨 论
HMGB1是一种存在于几乎所有真核细胞中的核蛋白,在维持基因组结构和稳定性方面发挥着关键作用。当机体受到创伤性损伤时,HMGB1作为触发宿主先天性免疫的警报蛋白释放于细胞外[6-7]。当HMGB1触发的宿主防御得到合理的调控时,HMGB1可以作为保护性因子;否则HMGB1将作为损伤性炎症因子,也可进一步引起器官功能障碍、免疫抑制和肿瘤发生等[8]。已有研究[8-9]证实HMGB1是调节恶性肿瘤发生、增殖和转移的因子,并与多种肿瘤的预后不良有关。本研究中,Ⅲ期乳腺癌患者中位数显著高于Ⅱ期(41.29 ng/mLvs14.18 ng/mL),同时发生淋巴结转移的患者也伴随着HMGB1水平的升高(36.68 ng/mLvs11.13 ng/mL),提示HMGB1与乳腺癌的侵袭和转移有关。由于肿瘤细胞的快速生长导致组织缺氧,从而在肿瘤中心形成了缺氧环境。低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)促进细胞释放HMGB1,然后与线粒体DNA形成复合物,促进肿瘤细胞增殖[10-11]。另外,Ai等[12]研究发现,miRNA-107通过与其靶蛋白HMGB1的相互作用可以抑制乳腺癌细胞自噬、增殖和迁移,也进一步证实HMGB1与乳腺癌的发生、发展密切相关,可作为乳腺癌的治疗靶点。
Treg是一种特殊类型的T细胞亚群,作为主要的免疫调节细胞,可抑制T细胞、B细胞、NK细胞和树突状细胞等多种免疫细胞的功能[13]。在肿瘤发生的病理和生理阶段,Treg主要通过细胞表面分子IL-10、TGF-β的高表达来抑制机体的抗肿瘤免疫[14]。肿瘤细胞释放的HMGB1进入肿瘤微环境,可通过抑制效应T细胞和激活Treg,促进免疫逃逸,使肿瘤生长[15]。本研究发现,HMGB1与Treg相关指标IL-10、TGF-β显著相关,提示HMGB1可能增强Treg的功能,从而促进IL-10、TGF-β分泌。Zhang等[16]在肿瘤模型的研究中发现,对肿瘤来源的HMGB1进行沉默或抑制会削弱Treg的功能。Wild等[17]对头颈部肿瘤患者进行研究发现,HMGB1是Treg的趋化剂,可促进其免疫抑制功能。但Koprivica等[18]在Ⅰ型糖尿病动物模型中却发现,抑制HMGB1可以促使Treg发挥更强的免疫抑制功能,表现为IL-10、TGF-β的大量分泌。其原因可能为HMGB1和Treg之间的相互作用在不同的疾病中存在差异,也可能是因为Treg包括CD4+CD25+Treg、Ⅰ型调节性Treg及Ⅲ型辅助型Treg等,而且目前对不同类型Treg的具体机制仍不清楚,值得今后深入研究。研究[19]发现,HMGB1高水平的乳腺癌患者CD4+、CD8+T细胞与CD3+T细胞的比值分别低于和高于低水平组,由于HMGB1在抑制抗肿瘤免疫中发挥关键作用,可抑制包括初始T细胞和效应T细胞的激活和抗体的产生。也可能因为HMGB1通过信号转导通路调控Treg影响CD4+、CD8+T细胞的功能,从而在细胞免疫抑制中发挥关键作用。本研究中HMGB1与实验室常规体液免疫分子未发现有相关性,提示HMGB1对乳腺癌免疫功能的影响可能主要存在于细胞免疫中。
新辅助化疗是局部进展期乳腺癌的标准治疗。乳腺癌患者新辅助化疗的效果通常通过pCR率和残余肿瘤负荷(residual cancer burden,RCB)评分来评估[20]。本研究对患者HMGB1水平和新辅助化疗术后pCR进行分析,发现HMGB1水平高,新辅助化疗效果较差,提示HMGB1水平对pCR有预测价值,这和Exner等[21]的研究一致。
HMGB1具有潜在的促癌、免疫抑制作用,由于其测定简便安全,因此具有广泛的应用前景。本研究通过分析HMGB1与乳腺癌患者临床病理学特征、免疫指标及新辅助化疗效果的相关性,发现HMGB1与乳腺癌的发生、发展相关,并与患者细胞免疫功能密切相关。对治疗前患者组织进行HMGB1水平检测对预测新辅助化疗效果具有一定价值。但由于本研究存在标本量过小以及单中心研究的问题,本课题组将通过扩大标本量以及加强随访力度进一步研究HMGB1水平改变与患者pCR、RCB的关系,从而为新辅助化疗效果探索更早期、更准确的评价指标。

