胸部超声对慢性阻塞性肺疾病机械通气患者撤机结果的预测价值
宋先斌 朱建刚 沈鹏 王倩倩 蔚文龙 张玲玮 杨茂宪 施云超
机械通气是慢性阻塞性肺疾病(chronic ob⁃structive pulmonary disease,COPD)急性加重期常用救治手段。但长时间机械通气可导致呼吸肌萎缩[1~3],造成脱机困难。目前,多以自主呼吸试验(spontaneous breathing trial,SBT)作为撤机评估手段,但仍有20%~40%的撤机失败率[4]。近年来,超声广泛应用于肺水肿及膈肌功能的评估[5、6],可用以指导非COPD 患者的撤机[7],但以肺部超声及膈肌功能评估预测COPD 患者撤机的研究鲜有报道。本次研究旨在探索胸部超声对COPD 机械通气患者撤机结果的预测价值。现报道如下。
1 资料与方法
1.1 一般资料 采用前瞻性临床观察研究,选取2018 年1 月至2019 年12 月嘉兴市第一医院ICU 收治的50 例需要行气管插管机械通气的COPD 患者,其中男性29 例、女性21 例;年龄55~81 岁,平均年龄(69.28±6.43)岁;有吸烟史15 例。入选标准包括:①符合COPD 的诊断标准[8];②年龄≥18 岁;③机械通气时间≥48 h;④符合撤机筛查标准;⑤血流动力学稳定;⑥有自主呼吸能力、有咳嗽反射。排除标准包括:①气管切开状态者;②第八胸椎以上的截瘫者;③严重心脏疾患者;④肌无力者;⑤妊娠状态;⑥大量胸腔积液、大量气胸者;⑦腹腔高压者。本次研究经本院医学伦理委员会审议及批准。
1.2 方法 对符合撤机筛查条件患者采用持续正压通气(continuos positive airway pressure,CPAP)模式给予SBT,SBT 前及SBT 后60 min 分别行胸部超声检查。超声使用Sonosite M-Turbo 型便携式超声仪(由美国索诺声公司生产)。根据腋前线及腋后线将肺部分为前侧后三个部分,每个部分均分为上下两个区域,总共12 个区域,均行肺部超声评分(lung ultrasound score,LUS)。LUS 及膈肌移动度(diaphragmatic displacement,DD)分区及计分方法参考文献[9]。
根据撤机结果分为撤机成功组与撤机失败组,比较两组临床资料,SBT 前的氧合指数、PaCO2、pH,以及SBT 前、SBT 后60 min 的脑钠肽(N terminal pro-brain natriuretic peptide,NT-proBNP)水平和LUS及DD的差异。撤机成功标准:48 h内无需再次气管插管,无需使用无创呼吸机辅助呼吸,无需使用高流量氧疗。并采用ROC 曲线评价LUS 和DD 对撤机结果的预测价值。
1.3 统计学方法 采用SPSS 23.0 统计软件进行统计分析。计量资料以均数±标准差()表示。计量资料比较采用t检验;计数资料比较采用χ2检验。以肺部及膈肌超声作为诊断评价试验,绘制ROC,同时计算ROC 曲线下面积。设P<0.05 为差异有统计学意义。
2 结果
2.1 50 例患者全部通过SBT,其中拔管成功31 例,拔管失败19 例。撤机成功组和撤机失败组患者临床资料比较见表1。
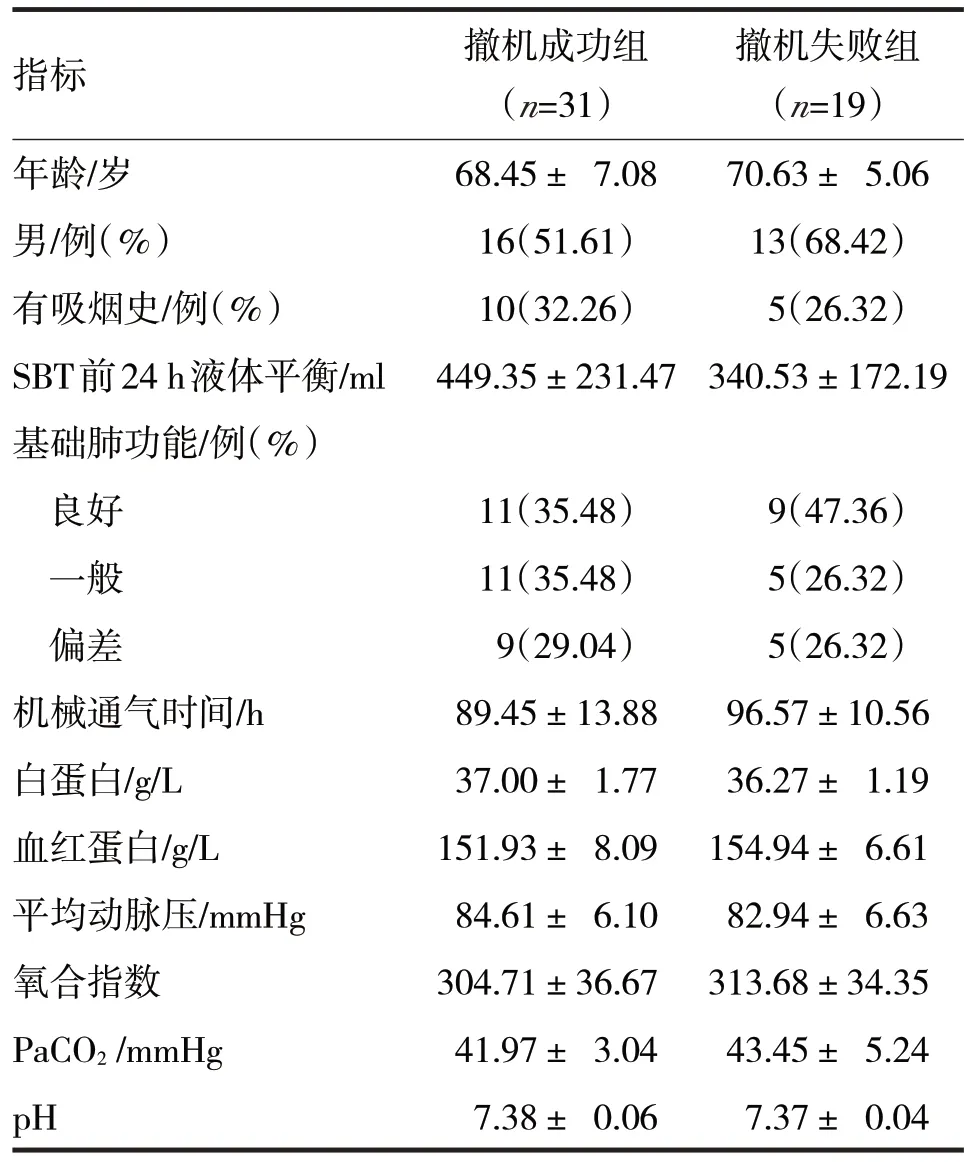
表1 两组患者基本资料和SBT前氧合指数、PaCO2、pH比较
由表1 可见,撤机成功组和撤机失败组患者在性别、吸烟史、基础肺功能、年龄、撤机前24 h 液体平衡、平均动脉压、白蛋白、血红蛋白和SBT 前机械通气时间比较,差异均无统计学意义(χ2分别=1.37、0.19、0.76,t分 别=1.17、1.77、0.91、1.60、-1.37、-1.92,P均>0.05);两组患者在SBT 前氧合指数、PaCO2、pH 比较,差异均无统计学意义(t分别=0.86、-1.26、0.62,P均>0.05)。
2.2 撤机成功组和撤机失败组SBT 前后NT-proB⁃NP水平和LUS及DD比较见表2
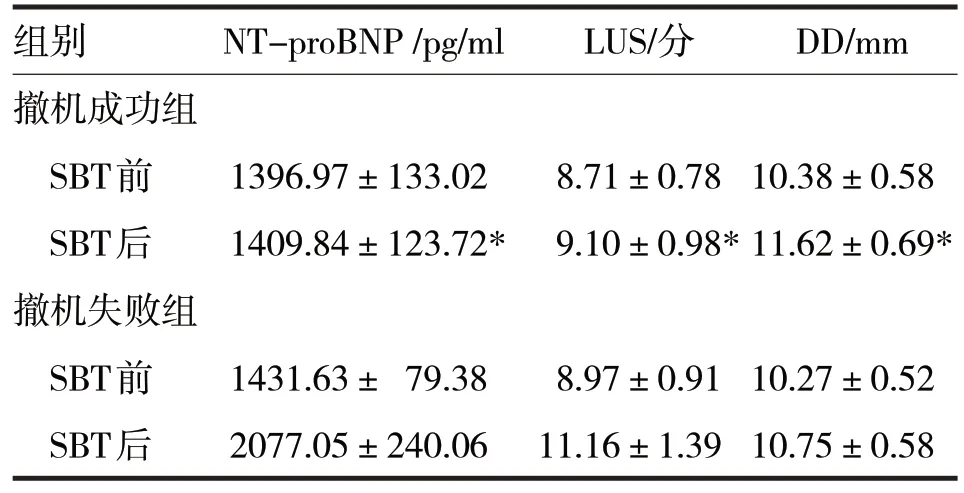
表2 两组患者SBT前后NT-proBNP水平和LUS及DD的变化
由表2 可见,两组患者SBT 前NT-proBNP 水平和LUS、DD 比较,差异均无统计学意义(t分别=-1.03、-1.98、0.68,P均>0.05);SBT 后,撤机成功组患者的NT-proBNP 水平、LUS 明显低于撤机成功组,DD 高于撤机失败组,差异均有统计学意义(t分别=-12.97、-6.61、4.57,P均<0.05)。
2.3 LUS及DD对撤机结果的预测见图1
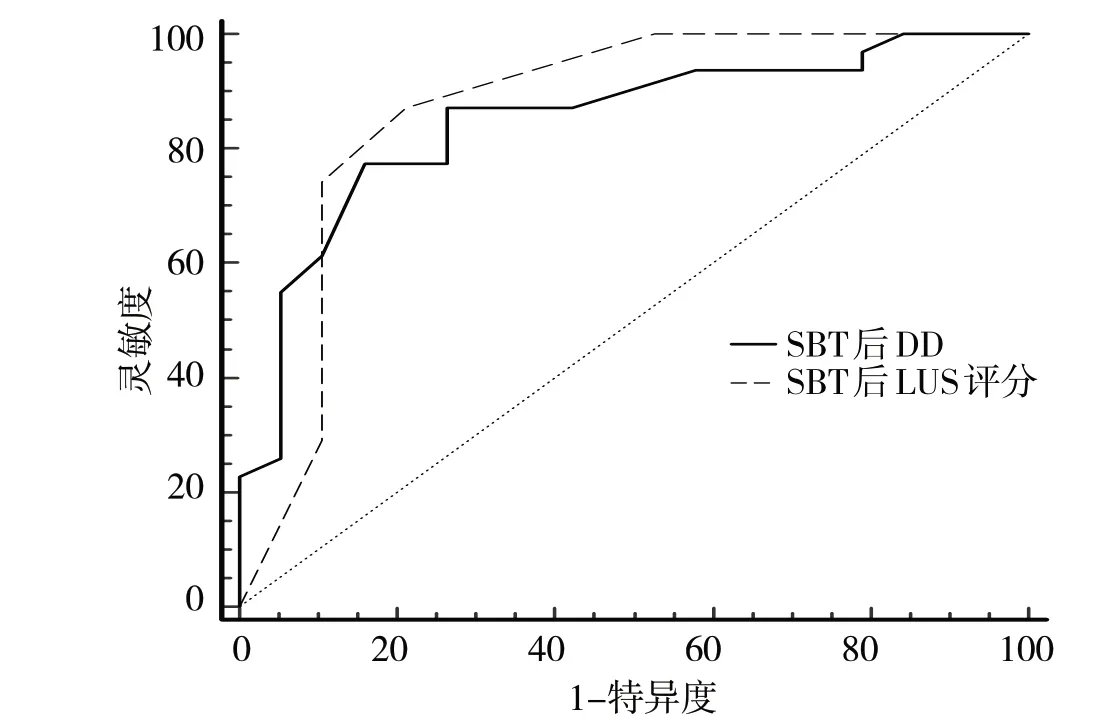
图1 LUS及DD预测撤机结果的ROC曲线
由图1 可见,LUS 和DD 的ROC 曲线下面积分别为0.86 及0.84,截断值为SBT 后LUS≤10.50 分,SBT 后DD>11.20 mm,二者能预测COPD 患者成功撤机的灵敏度分别为78.90%及77.40%,特异度为87.10%及84.20%。
3 讨论
胸片是呼吸系统疾病常用的影像诊断方法,但胸片对肺水肿检测的敏感性较差[10、11],CT 克服了这一限制,但CT检查增加危重患者转运风险。长期以来,肺因富含气体一直被认为是超声检查的禁区。随着超声诊断技术的不断发展,目前国内外已将超声广泛应用于肺炎、膈肌功能障碍、急性呼吸窘迫综合征等疾病的检查[12、13],国外学者甚至将超声作为COPD 院前检查的必备工具[14],但将肺部超声作为COPD撤机评估工具未见文献报道。
COPD 患者病程长,多合并心功能不全,常因呼吸困难需要气管插管,引起呼吸困难中的很大部分原因为心功能不全,而心功能不全也是导致SBT 失败的常见原因。NT-proBNP 是监测心功能不全的一个有效指标。肺部超声中的“B”线在评估肺水肿时也可视为一个有力征象。COPD 患者撤机拔管后,有创机械通气转为了自主呼吸,患者胸内压下降,静脉回流增加。若患者合并心功能不全,回心血量增多势必导致肺水增多,从而出现撤机失败。本次研究中,失败组患者SBT 后NT-proBNP 水平及LUS 明显升高。肺部B 线的产生是因为肺组织中液体含量增加,超声波通过气、液界面时产生一种强烈混响后形成的特殊征象。当肺水增多时,超声可见更多的B 线,LUS 分将明显增高。本次研究中,撤机失败患者肺部B 线增多,LUS 分值明显升高,说明COPD 患者发生肺水肿时,肺部超声能有效监测。本次研究结果显示,LUS 预测撤机结果,其ROC 曲线下面积为0.86,截断值为SBT 后LUS≤10.5 分,灵敏度为78.90%,特异度为87.10%,说明LUS 有良好的预测价值,但本次研究中LUS 截断值低于文献报道之15.5 分[15],可能与COPD 患者肺组织含气量多导致肺内气、液比例改变有关。因此,在临床上请注意,部分COPD 患者出现肺水肿时,可能由于肺泡内气体和水的比例发生了明显改变,声波在气、液间阻抗增大,肺部B 线可能反而较非COPD 患者少,使肺部超声可能有趋向“正常化”表现,容易让临床医生判断错误。
COPD 患者肺因过度充气膨胀导致胸壁和膈肌发生几何形状改变。COPD 急性加重时,呼吸负荷进一步增加,容易出现膈肌功能障碍。COPD 患者呼吸力学的损害可通过超声监测膈肌移动度来评估[5]。膈肌被认为是最重要的呼吸肌,在吸气过程中担负90%以上的通气做功。据统计,在需要插管的危重患者中,膈肌功能障碍的患病率可能超过60%,研究认为DD<10 mm为可诊断为膈肌功能障碍,其与呼吸机撤机失败风险明显相关[16]。本次研究中,DD 预测撤机ROC 曲线下面积0.84,截断值为SBT 后DD>11.2 mm,灵敏度分别为77.40%,特异度为84.20%,低于李立等[16]报道的DD 截断值17.9 mm,分析可能原因是COPD 患者的膈肌受过度膨胀肺组织的挤压而下降,膈面较为平坦,同时活动度减弱,膈肌收缩的效率较正常人降低。
综上所述,COPD 患者SBT 前后行胸部超声检查有助于判断合适的撤机时机,SBT 后LUS≤10.5 分或DD>11.2 mm,应尽早撤机,反之,撤机决策需要暂缓,以免增加拔管失败风险。本次研究尚存有不足之处,比如病例总数偏少,在后续研究中需要增加病例数量。由于COPD 插管原因中还有感染加重因素,故需要明确LUS 对COPD 合并感染时的诊断效能。同时,膈肌超声指标单一,可以增加膈肌增厚分数等进一步研究。

