生物素标记多杀菌素衍生物合成及其抗肿瘤活性研究
许娜,彭婷,罗志勇,邹自征,马大友,刘苏友,刘丽君*(.中南大学湘雅药学院,长沙4003;.中南大学生命科学学院,长沙 4003)
天然产物及其衍生物是发现新药的重要来源[1],很多天然产物具有良好的抗肿瘤活性,可以直接作为抗肿瘤药物或先导化合物。多杀菌素(spinosyn) 是刺糖多胞菌Saccharopolys poraspinosa发酵液中提取的大环内酯类化合物。它是一种新型的生物源广谱绿色低毒杀虫剂,于20世纪90年代初期开发并推向市场[2]。研究显示,多杀菌素还能够抑制细菌和病毒感染,促进伤口愈合,同时对多种肿瘤细胞有抑制活性[3]。多杀菌素A(spinosyn A,见图1)是其主要成分,它不仅生物活性高,而且对非靶标生物的毒性很低[4]。多杀菌素在抗肿瘤药物研究领域结构新颖,但是其抗肿瘤作用机制仍不明确,值得进一步研究。
小分子探针是确定活性化合物生物靶点的重要工具,其中生物素标记探针是发现活性天然产物靶点蛋白的有效手段[5-8]。生物素标记探针主要由三部分组成,分别是生物素、连接基团和活性基团[9]。连接基团是将活性基团和生物素连接起来的长链或短链结构,它的结构会影响到探针的生物活性和稳定性[10]。连接基团的主要功能是调节生物素和活性基团的空间距离,避免生物素和活性基团的空间干扰。常用的连接基团有长链脂肪烷烃[11]、多肽片段[12]或乙二醇[13]等。
为了研究多杀菌素衍生物的抗肿瘤作用机制,本试验设计并合成带有生物素标记的多杀菌素衍生物,来研究其体外抗肿瘤活性。
1 材料
D-生物素(上海瑞永生物科技有限公司,纯度≥99%);氯乙酰氯、1,3-二溴丙烷、1,6-二溴己烷(萨恩化学技术有限公司,纯度均为98%);其他试剂均为市售分析纯或化学纯。Bruker DRX型核磁共振仪(400 MHz,500 MHz);X-4 型数字显微熔点仪;安捷伦6200/6500 series Q-TOF MS(HR-ESI-MS)型质谱仪。多杀菌素A 按文献方法由多杀菌素甲醇重结晶得到,纯度大于95%[14]。
2 方法与结果
本研究在多杀菌素A 的福乐糖胺氮原子上引入含有不同连接基团的生物素,合成生物素标记的多杀菌素衍生物(见图1),并测试它们的体外抗肿瘤活性,研究不同连接基团对生物素标记多杀菌素衍生物抗肿瘤活性的影响。

图1 生物素标记多杀菌素衍生物的设计Fig 1 Design of biotin-labeled spinosyn compounds
2.1 生物素标记多杀菌素衍生物的合成
化合物2 的合成路线如图2所示[15],多杀菌素A 福乐糖胺氮原子发生脱甲基反应得到多杀菌素B。多杀菌素B 在弱碱条件下和氯乙酰氯发生乙酰化反应得到中间体1,最后中间体1 和生物素通过亲核反应得到生物素标记的化合物2。

图2 化合物2 的合成路线Fig 2 Synthetic route for compound 2
化合物5、6 和7 的合成路线如图3所示,多杀菌素B 在弱碱条件下,与1,3-二溴丙烷或1,6-二溴己烷发生亲核取代反应,分别得到中间体3 或4。3 或4 以二甲基酰胺(DMF)为溶剂,在弱碱条件下与生物素发生酯化反应得到生物素标记的化合物5 或6。在乙腈溶剂中,化合物6和碘甲烷发生N-甲基化反应,得到生物素标记的季铵盐化合物7。

图3 化合物5、6 和7 的合成路线Fig 3 Synthetic route for compound 5,6 and 7
2.2 结构鉴定
2.2.1N-(3-氯乙酰基)多杀菌素(1)的合成
向50 mL 单口圆底烧瓶中,加入多杀菌素B 300 mg(0.42 mmol)、二氯甲烷20 mL 和三乙胺59 μL(0.42 mmol),最后加入氯乙酰氯 94 μL(1.26 mmol),回流搅拌2 h,抽滤,用二氯甲烷(3×20 mL)和水15 mL 萃取,合并有机相,无水硫酸钠干燥。除去溶剂后,经硅胶柱层析[V(乙酸乙酯)∶V(石油醚)=4∶1]纯化,得淡黄色固体173 mg, 产率52%。mp.103~106℃;1H-NMR(500 MHz,CDCl3)δ:6.77(s,1H),5.90~5.85(m,1H),5.82~5.77(m,1H),4.85(s,1H),4.70~4.63(m,1H),4.53~4.46(m,1H),4.34~4.28(m,1H),4.17~4.13(m,1H),4.10~4.03(m,2H),3.71~3.61(m,2H),3.57~3.53(m,4H),3.52~3.43(m,8H),3.43~3.37(m,1H),3.33~3.26(m,1H),3.14~3.08(m,2H),3.04~2.98(m,1H),2.95(s,1H),2.90~2.83(m,1H),2.81~2.77(m,1H),2.43~2.37(m,1H),2.29~2.22(m,1H),2.20~2.12(m,1H),2.06~2.01(m,1H),1.97~1.89(m,2H),1.80~1.71(m,2H),1.59~1.41(m,7H),1.38~1.30(m,2H),1.29~1.25(m,3H),1.22~1.12(m,7H),0.95~0.84(m,2H),0.84~0.78(m,3H);13C-NMR(125 MHz,CDCl3)δ:202.6,172.3,167.0,147.6,144.0,129.3,128.7,103.1,95.4,82.2,81.0,80.5,76.7,76.5,76.0,71.8,67.8,60.8,59.2,58.9,57.6,49.4,47.5,46.0,41.7,41.4,41.1,37.3,36.2,34.1,30.7,30.0,28.3,28.0,26.1,21.5,18.1,17.7,16.0,9.3;高分辨率质谱计算值(C42H64ClNO11[M +H]+):816.4065,实测值:816.4083。
2.2.2 多杀菌素-乙酰基-生物素(2)的合成向50 mL 单口圆底烧瓶中加入DMF 1.5 mL、化合物1 100 mg(0.13 mmol)和D-生物素31 mg(0.13 mmol),最后加入碳酸钾18 mg(0.13 mmol),室温搅拌12 h。向反应液中加入冰水15 mL,有大量白色沉淀析出。静置,抽滤,得白色固体。用V(正己烷)∶V(异丙醇)=6∶1 重结晶得白色粉末77 mg,产率61%。mp.144~148℃;1H-NMR(500 MHz,CDCl3)δ:6.79(s,1H),5.90(d,J=9.9 Hz,1H),5.81(m,1H),4.88(d,J=12.9 Hz,1H),4.87(s,1H),4.79(s,1H),4.76(s,1H),4.71~4.63(m,2H),4.56~4.48(m,2H),4.39~4.31(m,2H),3.71~3.63(m,1H),3.58~3.56(m,4H),3.52~3.47(m,10H),3.33~3.29(m,1H),3.18~3.15(m,3H),3.04~3.02(m,1H),2.96~2.91(m,1H),2.90~2.84(m,4H),2.76(t,J=11.7 Hz,1H),2.57~2.49(m,1H),2.48~2.40(m,2H),2.31~2.25(m,1H),2.22~2.16(m,1H),1.97~1.15(m,31H),0.93~0.87(m,1H),0.85~0.82(m,3H)。13C-NMR(125 MHz,CDCl3)δ:202.7,173.4,172.5,166.8,147.7,144.1,129.37,128.8,103.1,95.5,82.3,81.1,77.7,76.1,71.9,68.0,61.7,61.3,61.1,60.9,60.2,59.0,57.7,55.6,49.5,47.6,46.0,41.5,41.2,40.5,37.4,36.3,34.3,34.2,33.5,33.4,31.6,30.8,30.1,28.4,28.1,28.0,26.1,25.3,24.8,22.6,21.6,18.2,17.8,16.2,14.1,9.3;高分辨率质谱计算值(C52H79N3O14S [M +H]+):1002.5361,实测值:1002.5408。
2.2.3N-(3-溴丙烷基)多杀菌素(3)的合成 向50 mL 单口圆底烧瓶中加入多杀菌素B 1 g(1.39 mmol)、乙腈20 mL 和385 mg 碳酸钾,最后加入1,3-二溴丙烷1.42 mL(13.90 mmol),45℃下搅拌48 h。除去溶剂,加入50 mL 水,用乙醇(3×60 mL)萃取,合并有机相,无水硫酸钠干燥。除去溶剂后经硅胶柱层析[V(乙酸乙酯)∶V(石油醚)=4∶1]纯化,得白色固体584 mg,产率42%。mp.105~108℃;1H-NMR(400 MHz,CDCl3)δ:6.78(s,1H),5.87(d,J=8.0 Hz,1H),5.80(d,J=8.0 Hz,1H),4.88(s,1H),4.70(m,1H),4.44(m,1H),4.30(m,1H),3.63(m,1H),3.58~3.52(m,4H),3.52~3.44(m,11H),3.35~3.24(m,1H),3.20~3.00(m,3H),2.85(m,1H),2.64~2.48(m,2H),2.40(d,J=8.0 Hz,1H),2.34~2.20(m,2H),2.16(s,4H),2.00~1.90(m,4H),1.88~1.72(m,2H),1.70(s,1H),1.60~1.40(m,8H),1.40~1.22(m,9H),1.16(d,J=10 Hz,3H),0.90(m,1H),0.80(t,J=7.6 Hz,3H);13C-NMR(125 MHz,CDCl3)δ:202.9,172.6,147.6,144.1,129.3,128.7,103.4,95.3,95.2,82.2,80.9,80.5,77.6,75.9,73.4,67.9,64.6,60.9,60.8,59.0,58.9,57.7,51.9,49.4,47.6,47.5,46.0,41.5,41.1,37.3,36.9,36.2,34.3,34.1,31.0,30.0,28.4,21.6,19.6,19.0,17.8,16.1,9.4;高分辨率质谱计算值(C43H68BrNO10[M +H]+):837.4026,实测值:837.4046.
2.2.4N-(3-溴己烷基)多杀菌素(4)的合成产率73%,mp.95~98 ℃;高分辨率质谱计算值(C46H74BrNO10[M +H]+):880.4574,实测值:880.4602。
多杀菌素-丙烷基-生物素(5)的合成:向50 mL 单口圆底烧瓶中加入DMF 1.5 mL、化合物3 100 mg(0.12 mmol)和D-生物素32 mg(0.13 mmol),最后加入碳酸钾17 mg(0.12 mmol),室温搅拌12 h。向反应液中加入15 mL 水,用乙酸乙酯(3×25 mL)萃取,合并有机相,无水硫酸钠干燥。除去溶剂后经硅胶柱层析[V(乙酸乙酯)∶V(甲醇)=20∶1]纯化,再用V(正己烷)∶V(异丙醇)=6∶1 重结晶得白色粉末94 mg,产率79%。mp.146~150℃;1H-NMR(500 MHz,CDCl3)δ:6.78(s,1H),5.90(d,J=9.6 Hz,1H),5.82(m,1H),5.23(s,1H),4.95(s,1H),4.87(s,1H),4.71~4.67(m,1H),4.55~4.52(m,1H),4.44(d,J=7.1 Hz,1H),4.35~4.31(m,2H),4.16~4.12(m,2H),3.66~3.62(m,1H),3.59~3.56(m,4H),3.53~3.46(m,10H),3.33~3.27(m,1H),3.21~3.17(m,1H),3.13~3.11(m,2H),3.04~3.02(m,1H),2.99~2.93(m,1H),2.90~2.86(m,1H),2.76(d,J=12.8 Hz,1H),2.53~2.45(m,2H),2.45~2.40(m,1H),2.37~2.33(m,2H),2.30~2.12(m,6H),1.99~1.92(m,2H),1.82~1.18(m,30H),0.96~0.88(m,1H),0.84(t,J=7.4 Hz,3H);13C-NMR(125 MHz,CDCl3)δ:202.9,173.8,172.6,147.6,144.1,129.3,128.8,103.5,95.4,82.2,81.0,80.6,77.7,76.1,73.5,67.9,64.4,62.5,62.0,60.9,60.1,59.0,57.7,55.5,50.5,49.4,47.7,47.6,46.0,41.5,41.2,40.5,37.4,36.9,36.3,34.3,34.2,33.9,31.1,30.1,28.4,28.2,27.2,24.8,21.6,19.4,19.0,17.8,16.2,9.4;高分辨率质谱计算值(C53H83N3O13S [M +H]+):1002.5725,实测值:1002.5772。
2.2.5 多杀菌素-己烷基-生物素(6)的合成[15]
向50 mL 单口圆底烧瓶中加入DMF 1.5 mL、化合物4 100 mg(0.11 mmol)和D-生物素32 mg(0.13 mmol),最后加入碳酸钾17 mg(0.12 mmol),室温搅拌12 h。向反应液中加入15 mL水,用乙酸乙酯(3×25 mL)萃取,合并有机相,无水硫酸钠干燥。除去溶剂后经硅胶柱层析[V(乙酸乙酯)∶V(甲醇)=20∶1]纯化,再用V(正己烷)∶V(异丙醇)=6∶1 重结晶得白色粉末68 mg,产率57%。mp.124~129 ℃;1H-NMR(500 MHz,CDCl3)δ:6.78(s,1H),5.90(d,J=9.7 Hz,1H),5.82(m,1H),5.22(s,1H),4.97(s,1H),4.87(d,J=1.3 Hz,1H),4.73~4.64(m,1H),4.57~4.50(m,1H),4.44(d,J=6.6 Hz,1H),4.38~4.28(m,2H),4.08(t,J=6.7 Hz,2H),3.68~3.61(m,1H),3.59~3.56(m,4H),3.54~3.46(m,10H),3.33~3.27(m,1H),3.20~3.11(m,3H),3.06~2.99(m,1H),2.96~2.92(m,1H),2.91~2.86(m,1H),2.77(d,J=12.8 Hz,1H),2.43~2.33(m,5H),2.30~2.25(m,2H),2.19(s,3H),1.99~1.92(m,2H),1.74~1.61(m,10H),1.59~1.53(m,4H),1.52~1.45(m,6H),1.39~1.32(m,6H),1.30(d,J=6.2 Hz,4H),1.26~1.25(m,3H),1.20(d,J=6.8 Hz,4H),0.95~0.88(m,1H),0.84(t,J=7.5 Hz,3H);13C-NMR(125 MHz,CDCl3)δ:202.9,173.8,172.5,147.5,144.1,129.3,128.8,103.5,95.5,82.3,81.1,80.7,77.7,76.1,73.7,68.0,64.5,64.1,61.9,60.9,60.,59.0,57.7,55.4,54.0,49.4,47.7,47.6,46.1,41.5,41.2,40.5,37.4,37.2,36.3,34.4,34.2,33.9,31.1,30.2,28.7,28.4,28.4,28.3,26.8,25.9,24.8,21.6,19.4,19.0,17.8,16.2,9.2;高分辨率质谱计算值(C56H89N3O13S [M +H]+):1044.6194,实测值:1044.6234。
2.2.6N-甲基季铵盐多杀菌素-己烷基-生物素(7)的合成 向25 mL 单口圆底烧瓶中加入化合物6 102 mg(0.10 mmol)、乙腈15 mL 和碘甲烷18 μL(0.29 mmol),85 ℃ 搅拌48 h。除去溶剂,V(正己烷)∶V(异丙醇)=6∶1 重结晶得经淡黄色固体56 mg,收率48%。mp.134~141 ℃;1H-NMR(500 MHz,CDCl3)δ:6.79(s,1H),6.00(s,1H),5.95(s,1H),5.89(d,J=9.6 Hz,1H),5.79(d,J=9.8 Hz,1H),4.93~4.92(m,1H),4.86(s,1H),4.72~4.60(m,2H),4.43(s,1H),4.37(d,J=6.3 Hz,1H),4.32(m,1H),4.16~4.06(m,2H),3.82(s,1H),3.72~3.70(m,1H),3.59~3.55(m,4H),3.50~3.47(m,10H),3.30(s,3H),3.29(s,3H),3.26~3.24(m,1H),3.14~3.12(m,1H),3.10~3.06(m,2H),3.03~3.02(m,1H),2.97~3.95(m,1H),2.92~2.87(m,2H),2.44~1.15(m,44H),0.94~0.89(m,1H),0.84(t,J=7.4 Hz,3H);13C-NMR(125 MHz,CDCl3)δ:202.7,174.0,172.4,147.6,143.6,129.4,128.9,101.0,95.5,82.2,82.1,81.0,77.7,76.2,76.2,73.5,67.9,67.5,64.1,61.9,60.9,60.2,59.0,57.7,55.8,49.5,49.1,48.8,47.6,47.0,46.2,41.5,41.1,40.7,37.4,36.3,34.5,34.0,31.5,30.7,28.4,28.0,26.0,25.7,25.6,24.9,24.8,22.7,22.6,20.3,19.4,17.8,17.2,9.4;高分辨率质谱计算值(C57H92N3O13S [M +H]+),1058.6351,实测值 1058.6361。
2.3 抗肿瘤活性的研究
选用人乳腺癌MCF-7 细胞株(中国科学院昆明动物研究所),应用MTT 法[16]测试多杀菌素A和生物素标记多杀菌素衍生物分别在10、20 和40 μmol·L-1浓度下对肿瘤细胞的抗增殖活性,结果见图4。可见引入不同的连接基团对生物素标记多杀菌素衍生物的抗肿瘤增殖活性影响较大。在浓度为10 μmol·L-1时,多杀菌素A 和4 个生物素标记多杀菌素衍生物的抗肿瘤增殖活性均较差。在浓度为20 μmol·L-1时,多杀菌素A、化合物2、5、6、7 对MCF-7 细胞株的抑制率分别为70%、28%、2%、90%和9%,化合物6 的抑制活性最好。在浓度为40 μmol·L-1时,多杀菌素A、化合物2、5、6、7 对MCF-7 细胞株抑制率分别为100%、94%、89%、100% 和23%,化合物2、5、6 有很强的抑制活性,化合物 7 对MCF-7 细胞株抑制率低,表明季铵盐形式会抑制其抗肿瘤增殖活性。化合物6 对MCF-7 细胞株的抑制率高于其他生物素标记的衍生物2、5 和7,与母体多杀菌素A 的活性相当,因此,化合物6 可作为小分子探针进一步研究多杀菌素衍生物的抗肿瘤作用机制[17]。
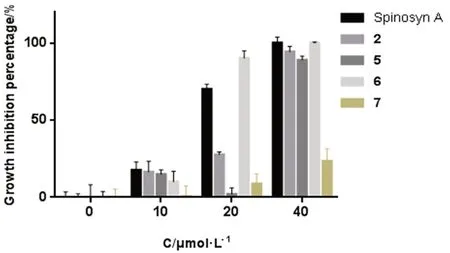
图4 化合物对MCF-7 的生长抑制活性Fig 4 Growth inhibition of compounds to MCF-7
3 结论
本文合成了4 个全新的生物素标记多杀菌素衍生物,所有中间体和目标化合物均经过1H-NMR、13C-NMR、HRMS 进行了结构表征。体外抗肿瘤活性研究显示生物素标记多杀菌素衍生物6 具有较好的抗肿瘤增殖活性,可作为生物素标记探针研究多杀菌素衍生物的抗肿瘤作用机制。

