娃娃菜(Brassica campestris)软腐病病原菌的分离与鉴定
赵欢欢,张元元,张映曈,胡花丽,周宏胜,罗淑芬,李鹏霞,,3,
(1.南京农业大学食品科技学院,江苏南京 210095;2.江苏省农业科学院农业设施与装备研究所,江苏南京 210095;3.江苏省高效园艺作物遗传改良重点实验室,江苏南京 210095)
娃娃菜(Brassica campestris)属于十字花科芸薹属,是一种小型白菜,外形精巧、口感细腻、风味清新。娃娃菜营养价值极高[1],糖类、蛋白质、维生素、膳食纤维等含量丰富,钠、钾含量几乎是大白菜的2~3倍[2],深受消费者欢迎,因此,娃娃菜的需求量与日俱增。但娃娃菜组织脆嫩、含水量高、叶表面积大,在采后运输及贮藏过程中极易遭受机械损伤[3],病原菌易从伤口处侵入,从而诱发各种病害,给娃娃菜产业带来了严重的损失。软腐病是导致娃娃菜采后品质劣变的一种最常见的细菌性病害[4]。软腐病发生时,起初由根茎部或叶部开始发病,病斑呈水渍状,半透明,并迅速向四周扩散蔓延,随后病斑开始流出黄色脓液,并散发出硫化氢的臭味,娃娃菜开始腐烂塌陷,彻底失去食用价值[5],造成了严重的经济损失[6]。因此,亟需对引起娃娃菜软腐病的病原菌进行分离鉴定并采取相应的防控措施,以期减少娃娃菜采后软腐病的发生。
植物细菌性软腐病在世界各地广泛发生,主要是由肠杆菌科(Enterobacteriaceae)的果胶杆菌属(Pectobacterium)和迪基氏菌属(Dickeya)侵染引起的[7]。Pectobacterium目前包括P.carotovorum(Pc)、P.atrosepticum(Pa)、P.betavascularum(Pb)和P.wasabiae(Pw)4个种,其中Pc又被进一步划分为P.carotovorumsubsp. carotovorum(Pcc)、P.carotovorumsubsp. odoriferum(Pco)和P.carotovorumsubsp. brasilience(Pcb)3个亚种[8,9]。Pco在全世界范围内寄主种类广泛,它通过产生和分泌果胶酶和纤维素酶等细胞壁降解酶,破坏蔬菜、花卉和大田经济作物等多种植物的细胞壁,最终导致植株腐烂死亡[10]。Li等[11]的研究表明,与Pc的其他亚种相比,被Pco侵染的植株损伤更为严重。Waleron等[12]首次发现Pco能够侵染菊苣叶,造成软腐病。随后,王茜等[13]发现Pco也是导致芹菜软腐病的主要病原菌,患软腐病的芹菜,其茎和叶柄腐烂,并发出刺鼻的恶臭,植株完全瘫软,彻底失去食用价值。晋知文等[14]也得出了类似的结果。此外,研究人员从大白菜[15]、甘薯[16]、菜花[17]和马铃薯[18]等软腐病株中也分离鉴定出了Pco,但有关娃娃菜采后软腐病的病原菌种类尚未见报道。
因此,本研究拟以新鲜娃娃菜为研究对象,选取典型软腐病病症叶片进行菌株的分离纯化、致病性测定、形态观察、生理生化鉴定、16S rDNA分析和特定基因序列测定,以期明确引起娃娃菜软腐病病原菌。研究结果将加深对娃娃菜软腐病致病机制的理解,同时为采取有针对性的防治措施奠定基础。
1 材料与方法
1.1 材料与仪器
新鲜“耕野”娃娃菜 于2019年6月份购自南京众彩蔬菜批发市场,挑选大小均一、无明显机械损伤的娃娃菜作为试验材料,于常温贮藏一定时间至发病;氯化钠 分析纯,上海久亿化学试剂有限公司;磷酸二氢钾、磷酸氢二钾、戊二醛 分析纯,上海麦克林生化科技有限公司;草酸铵结晶紫染液 上海如吉生物科技发展有限公司;番红染液 北京华越洋生物;碘液 北京索莱宝科技有限公司;NA、LB培养基 上海盛思生化科技有限公司。
M603Di型电子天平 意大利Bel公司;SYQDSX-280B高压灭菌锅 上海申安医疗器械厂;恒温培养箱 日本Sanyo公司;东胜·升PCR仪 南京十字架生物科技有限公司;SW-CJ-1B型净化工作台苏州净化设备有限公司;THZ-82气浴恒温振荡器金坛市医疗仪器厂。
1.2 实验方法
1.2.1 病原菌的分离与纯化 参照郑学立等[19]的方法并略作改动。用无菌袋采集典型软腐病症状的发病植株茎叶,在无菌袋中加入一定量生理盐水(固液比1:4),放入摇床,200 r/min,30 ℃振荡20 min,稀释至合适浓度,涂布于PCA平板,30 ℃培养24 h后,根据菌落形态挑取单个菌落进行纯化培养。
1.2.2 病原菌致病性测试 参照孙齐英等[20]的方法并略作修改。试验材料为新鲜健康无损伤的娃娃菜茎段(长4~5 cm,宽2~3 cm),用75%酒精擦拭消毒,置于无菌培养皿中,下衬一张无菌滤纸,并加入2 mL无菌水保持湿润。用灭菌小刀在茎段中心位置划2 mm×2 mm的十字型伤口,深度为1.5 mm左右。将纯化后的菌株用0.85%的无菌生理盐水洗涤3次,制备成浓度为105CFU/mL的菌悬液,滴加10 μL到植物十字型伤口中,每株菌15个平行。用封口膜密封后,放置于30 ℃培养箱,每隔5 h观察记录发病情况,同时设置0.85%无菌生理盐水作为阴性对照。
1.2.3 病原菌形态学鉴定
1.2.3.1 菌落的形态观察 采用三区划线法将致病菌株划线接种到NA平板上进行培养,在30 ℃条件下培养24 h,观察并记录单菌落的形态大小、颜色深浅、边缘是否光滑、透明度、菌面是否凸起、是否有荚膜等情况[21]。
1.2.3.2 扫描电镜观察 参照陈欣[22]的方法并略做改动。样品细胞以6000×g,4 ℃下离心后沉淀,用PBS溶液(0.2 mol/L,pH7.2)洗涤2次,用1 mL 4 ℃预冷过含有2.5%戊二醛的PBS溶液固定8 h以上。然后用PBS溶液(0.2 mol/L,pH7.2)冲洗3遍,加入1%锇酸静置4 h,再用无水乙醇脱水、乙酸异戊酯置换、CO2临界点干燥、离子金溅射镀金后,置于场发射扫描电子显微镜(EVO-LS10)下观察分析。
1.2.3.3 革兰氏染色反应 参照谭啸等[23]的方法并略作改动。在载玻片上滴一滴灭菌水,用接种针蘸取少量单菌落,于水中将菌体轻轻打散,放入30 ℃烘箱中风干固定,经草酸铵结晶紫染液初染、乙醇脱色、番红染液复染后,于显微镜下观察菌体染色情况及形态。
1.2.4 生理生化鉴定分析 对致病菌株进行生理生化鉴定,鉴定项目包括King’s B培养基、结晶紫果胶酸盐培养基(CVP)上生长、明胶液化、37 ℃生长、5%和7% NaCl生长、柠檬酸盐利用、糖醇发酵和产酸检测。具体方法参照《常见细菌系统鉴定手册》[24]。
1.2.5 16S rDNA分析 采用FastPure Bacteria DNA Isolation Mini Kit试剂盒提取细菌总DNA。用16S rDNA序列通用引物对细菌总DNA进行扩增,反应终止后,取PCR产物于1%琼脂糖凝胶电泳检测扩增结果。将扩增片段经胶回收后,送南京思普金生物科技公司测序。
将测序结果在NCBI(https://www.ncbi.nlm.nih.gov)数据库中进行BLAST比对分析。基于NCBI中已发表的Pectobacterium的16S rDNA序列,以及本实验获得的两株病原菌C-2和C-11的16S rDNA序列,使用MEGA 7软件采用UPGMA法构建系统发育树。
1.2.6 果胶酶基因序列测定 用果胶杆菌果胶酶基因扩增引物对细菌总DNA进行扩增。果胶酶基因扩增上游引物PccF为:5’-TTACCGGAGCCCGAGC TGTGGCGT-3’,下游引物PccR为:5’-CAGGAAGAT GTCGTTATCGCGAGT-3’,预计扩增片段约为450 bp。PCR扩增体系(20 μL):DNA扩增模板2 μL,2×Mix 10 μL,上游引物1 μL,下游引物1 μL,ddH2O 6 μL。果胶酶基因扩增条件:94 ℃预变性5 min;循环参数:94 ℃ 30 s,65 ℃ 30 s,72 ℃ 90 s,共30个循环;72 ℃延伸10 min。反应终止后,取PCR产物于1%琼脂糖凝胶电泳检测扩增结果。将扩增片段经胶回收后,送南京思普金生物科技公司测序。
1.3 数据处理
采用Excel2010作表,MEGA 7软件构建系统发育树。所有试验均进行3次重复。
2 结果与分析
2.1 病原菌的分离和致病性
将娃娃菜软腐病株进行处理,稀释均质液并涂布于培养平板上。挑取不同菌落形态的优势菌株,并将其纯化保存。三个批次共获得17株优势菌株,命名为A-1~A-3、B-1~B-3和C-1~C-11。
将分离出的17株菌的菌悬液接种到新鲜娃娃菜茎段上,33 h后,接种C-2和C-11的娃娃菜茎段上的病斑直径分别为31.6和40.2 cm,呈水渍状腐烂,且伴有恶臭,符合软腐病症状,而其他菌株均无强致病性,也不产生水渍状病斑(图1A)。
将C-2和C-11接种至室温贮藏的整颗娃娃菜基部,8 h时软腐症状的病斑从伤口处扩散,随着时间的延长,病斑面积逐渐扩大,基部腐烂塌陷,并发出恶臭(图1B),表明C-2和C-11均具有致病性。

图 1 C-2和C-11对娃娃菜离体(A)和活体(B)的致病性Fig.1 Pathogenicity of C-2 and C-11 in vitro (A)and in vivo (B)
2.2 病原菌的形态学鉴定结果
由图2A、图2B可以看出,病原菌C-2和C-11在LB培养基上呈乳白色圆形菌落,稍凸起,有光泽感,半透明,边缘圆润。菌体形态见电镜图2C、图2D,其基本特征为:菌体呈短杆状,两端钝圆,周生鞭毛。革兰氏染色结果表明,这两株菌均为革兰氏阴性菌(图2E、图2F)。这一结果符合Pectobacterium的特性[25]。
2.3 生理生化特征
通过生理生化指标鉴定(表1),发现C-2和C-11的生理生化指标测定结果均符合Pc的特性[11,26],C-2和C-11适宜在37 ℃生长,且可利用柠檬酸盐和明胶,这与Pa和Pw需在37 ℃以下生长及Pb无法利用柠檬酸盐和明胶的特性不同[9,27−28],因此,可以初步证实C-2和C-11属于Pc种。C-2和C-11均能够利用山梨醇发酵产酸,这与已发表的Pco菌株的特性相符[12],而Pcc和Pcb亚种则无法利用山梨醇。
2.4 16S rDNA分析及系统发育树构建结果
为了进一步明确C-2和C-11的分类地位,对其进行分子生物学的鉴定。收集C-2和C-11菌体,提取基因组DNA,以其为模板,采用16S rDNA通用引物进行扩增。扩增片段电泳结果如图3所示,得到的PCR产物大小均在1500 bp左右,符合预期长度。将目的片段进行胶回收,送测序公司测序。测序结果显示,C-2和C-11的16S rDNA基因序列全长为1428 bp和1434 bp。
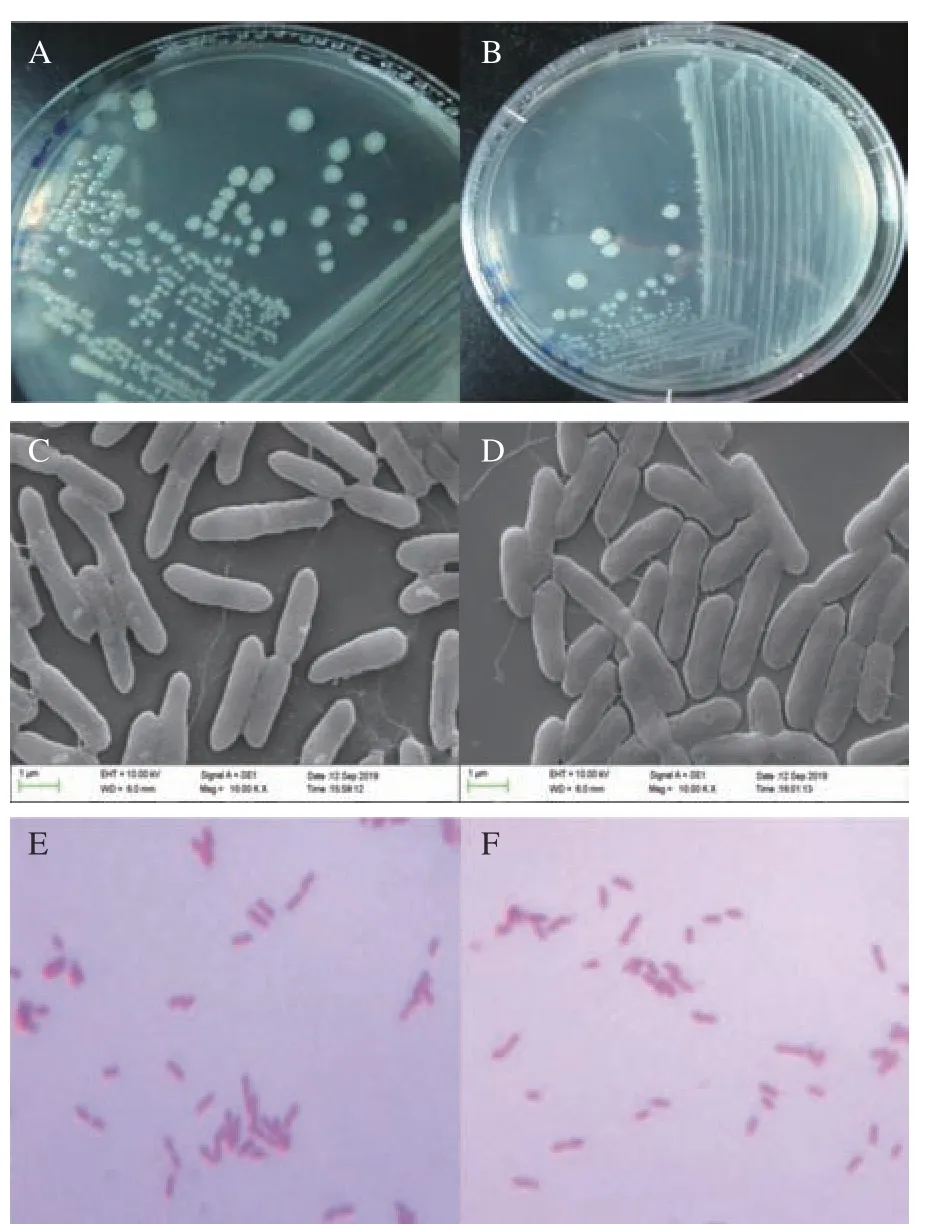
图 2 菌株C-2(左)和C-11(右)的形态观察结果Fig.2 Morphological observation results of C-2 (left)and C-11 (right) strains

图 3 C-2和C-11 16S rDNA序列PCR扩增产物电泳图Fig.3 Electrophoretogram of PCR products for the 16S rDNA sequences of C-2 and C-11
采用ClustalX比对C-2和C-11的16S rDNA基因序列,结果表明两个序列高度同源,仅在第31、432、472、481、1281和1401位碱基处有差异。将C-2和C-11的16S rDNA基因序列在NCBI数据库上(https://www.ncbi.nlm.nih.gov)进 行BLAST比对,结果显示菌株C-2(GenBank Accession No.MW 658361)和C-11(GenBank Accession No.MW658362)与多株Pc菌株显示较高同源性,其中C-2与PcPZ12菌株(GenBank Accession No.MN394034.1)同源性高达99.93%,C-11与PcY16菌株(GenBank Accession No.KP187496.1)同源性高达99.93%。因此C-2和C-11鉴定为肠杆菌科(Enterobacteriaceae)的果胶杆菌属P.carotovorum(Pc)种。釆用MEGA 7软件以16S rDNA相似序列构建系统发育树。结果如图4所示,菌株C-2与C-11与已发表的Pc株系亲缘关系较近,首先与Pco菌株聚类形成了Pco类群,Pco类群与Pcc和Pcb类群又聚类形成了Pc分枝。系统发育结果进一步证实了导致娃娃菜采后软腐病的病原菌属于Pco亚种,为娃娃菜软腐病的防治提供了理论依据。
2.5 果胶酶基因序列测定结果
果胶酶基因是胡萝卜软腐果胶杆菌亚种的特异性基因[29],为进一步确认16S rDNA的鉴定结果,以C-2和C-11的基因组为模板,扩增特异性果胶酶基因,电泳结果见图5。将目的片段胶回收,并送测序公司测序。结果显示,片段长度分别为403 bp和407 bp,符合预期长度。在NCBI(https://www.ncbi.nlm.nih.gov)数据库中进行BLAST比对,结果表明:C-2和C-11的果胶酶基因序列同源性为99%,且与Pc菌株EC4(GenBank Accession No.X16397)序列同源性达98.5%。

图 4 基于C-2和C-11菌株基因序列构建的系统发育树Fig.4 Phylogenetic tree based on gene sequence of strain C-2 and C-11

图 5 C-2和C-11的果胶酶基因序列PCR扩增产物电泳图Fig.5 Electrophoretogram of PCR products for the pectinase gene sequences of C-2 and C-11

表 1 C-2和C-11生理生化指标结果Table 1 Identification results of physiological and biochemical indexes of C-2 and C-11
3 结论
本研究从患软腐病的娃娃菜中分离得到的菌株进行致病性测试,发现只有接种菌株C-2和C-11的娃娃菜病斑呈水渍状,叶片粘稠,流出黄色脓状液体,并伴有恶臭,这与Waleron等[12]发现的菊苣软腐病的典型症状一致。
通过生理生化鉴定,发现C-2和C-11是革兰氏阴性菌,菌体呈短杆状。与Pa和Pw菌株在低于37 ℃条件下的生长特性以及Pb菌株不能利用柠檬酸盐和明胶的特性不同,C-2和C-11可在37 ℃和含有7%NaCl培养基中正常生长,可利用柠檬酸盐和明胶,并能够利用葡萄糖、果糖、蔗糖、甘油、半乳糖、水杨苷、麦芽糖、甘露醇和山梨醇作为碳源发酵产酸,这与已发表的Pco菌株表现一致[13]。研究表明,Pc可通过伤口侵入植物体内,产生高水平的胞外酶,如果胶裂解酶(pectate lyase,Pel)、聚半乳糖醛酸酶(polygalacturonase,Peh)和纤维素酶(cellulase,Cel)等,进而破坏植物细胞壁[22],使植物组织呈水渍状腐烂,并散发出刺鼻的气味。C-2和C-11在CVP培养基上能够产生典型的杯状凹陷,表明其具有利用果胶的能力,这与报道的Pco致病机理一致[12]。
16S rDNA序列测定、果胶酶序列同源性及系统发育树的构建进一步证明了以上结果。首先,通过测序发现C-2和C-11菌株16S rDNA序列准确长度为1428 bp和1434 bp,为16S rDNA基因的完整序列。其次,C-2和C-11的果胶酶基因序列与Pc菌株EC4(GenBank Accession No.X16397)序列同源性为98.5%。最后,将C-2和C-11的16S rDNA序列与已发表的软腐果胶杆菌菌株构建系统发育树。结果表明,菌株C-2和C-11与Pco菌株聚类形成了Pco类群,Pco类群与Pcc和Pcb类群又聚类形成了Pc分枝。而Pa、Pb和Pw菌株聚类后形成另外的分支。综合多种鉴定结果,C-2和C-11被鉴定为胡萝卜软腐果胶杆菌Pco亚种。
综上,本研究通过对娃娃菜软腐病株中致病菌的分离、致病力测试、革兰氏染色、电镜图观察、生理生化鉴定、16S rDNA序列鉴定、果胶酶基因序列测定分析和系统进化树构建等多种方式,确定了导致娃娃菜软腐病的主要致病菌为胡萝卜软腐果胶杆菌亚种Pectobacterium carotovorumsubsp. odoriferum(Pco),这一结果为有针对性地开展对该病害的综合控制技术提供了理论依据。

