有氧运动诱导Bcl-2-caspase-3/PARP 信号通路干预CUMS 抑郁小鼠海马神经细胞凋亡的机制研究
刘瑞莲,屈红林,陈伊琳,毛海峰
抑郁症是一种患病率、复发率和自杀率较高的精神类疾病,严重影响机体健康,给社会、家庭和个人造成巨大危害,虽然有大量学者提出炎症反应[1]、神经营养因子异常[2]、DNA 甲基化调控、去甲肾上腺素学说[3]、五羟色胺(5-HT)学说[4]、神经通路学说,以及遗产因素、神经生化因素和心理社会因素的假说,但其确切的发病机制尚不十分明确。当前临床上多采用药物治疗、心理疗法、物理治疗、中医治疗等方法,治疗起效慢、应答率低、治愈率低的现状已经使其成为当今全世界的重大难题之一,已有较多研究结果显示,通过运动对抑郁症进行干预具有明显的优势,但其作用机制的研究尚处于起步阶段。V.KRISHNAN等[5-6]证实抑郁症发病过程中存在明显的海马区域神经元凋亡与萎缩现象,研究指出神经元凋亡诱导的海马组织损伤可能是诱发抑郁症患者器质性病变的基础之一[7]。作为应激性损伤的主要靶器官的海马是记忆、学习和情绪控制的重要区域,其损伤通常造成空间记忆缺失、方位定向错误。细胞凋亡又称为细胞程序化死亡[8],主要参与细胞分化、调节机体发育、正常细胞更新以及某些疾病的病理改变[9-10],其中海马神经细胞凋亡已经在抑郁症患者与动物实验的海马病理改变中得以验证[11-12]。有氧运动抗海马神经细胞凋亡已经在阿尔茨海默病[13]、血管性痴呆[14]等神经损伤类,糖尿病[15]、肥胖症[16]等代谢类疾病,以及有氧运动促进药物治疗抑郁症等方面得以证实[17]。课题组前期的实验研究[18]已证实有氧运动可通过激活BDNF及其miR-195的靶向调控发挥抗凋亡作用改善抑郁小鼠海马功能,但具体的作用机制尚不深入。在前期项目研究的基础上,结合高通量测序结合生物信息学分析方法筛选出运动干预海马神经凋亡的机制与5-HT、Bcl-2、Caspase-3 和PARP 等的差异表达可能密切相关,本研究拟通过验证有氧运动改善抑郁小鼠海马5-HT、Bcl-2、Caspase-3 和 PARP 的变化,探讨 Bcl-2/Caspase-3/PARP 信号通路参与有氧运动改善抑郁症小鼠海马神经细胞凋亡的作用机制。
1 材料与方法
1.1 实验对象与分组
SPF 级健康雄性 8 周龄 KM 小鼠 36 只,体重 25~30 g,由湖南斯莱克景达实验动物有限公司提供,实验动物合格证号:SCXK湘2016-0002。所有小鼠在室温(25±1)℃,相对湿度为50%的环境中自由饮水、标准饮食。36 只小鼠按随机数字法分为3 组(n=12):空白对照组(Control 组,CG)、不可预知性应激模型组(CUMS 组,MG)和造模运动干预组(CUMS+Exercise组,CE)。
1.2 抑郁模型构建与判定
MG 组和CE 组小鼠借鉴相关文献[19-20],采用28天慢性不可预见性应激刺激构建抑郁模型,即选用包括昼夜调整、禁食、禁水、倾斜鼠笼、改变光照性质、潮湿垫料、温水游泳、低温游泳、水平震荡、束缚、白噪音等在内的13 种应激方式,按每天2~3 种刺激方式随机数字法生成刺激方案,为避免因相同刺激引起的适应性,微调刺激方案,确保相邻时间不重复刺激方式。
神经行为学评定。糖水偏好指数(sucrose preference test,SPT):P.WILLNER 等[21]的研究提出糖水偏好指数下降可作为评价抑郁模型的核心指标,其可用于评价实验小鼠的快感缺失。测试时,先适应性训练小鼠含糖饮水。适应期后,禁食禁水10 h 后,每只小鼠的鼠笼放置2 个水瓶,分别为蒸馏水和含1%蔗糖的蔗糖水[22-23],200 mL/瓶,供小鼠自由饮水,30 min 后交换两瓶水的位置,实验1 h 后称取两瓶水中的重量,计算蔗糖偏好指数(%)。糖水偏好指数与动物的快感程度呈正相关,其值越小则表明动物快感缺失越严重[24]。与空白对照组,糖水偏好指数呈显著性减小,即可判定为抑郁造模成功。强迫游泳(forced swimming test,FST):测试时将小鼠单独放置于直径为10 cm 的强迫游泳仪玻璃缸中,水深30 cm,水温(25±2)℃,计时6 min,记录后4 min 内游泳累计不动时间。强迫游泳时间越长,抑郁症状也就越严重[25]。
1.3 有氧运动方案
CE 组小鼠在造模评定完成后,次日进行适应性跑台运动,适应性训练按照0坡度,10 m/min的速度训练10 min,之后每天递增10 min,直到60 min。间歇一天后,参照T.G.BEDFORD[26]改良训练方案进行中低强度正式训练,即按照0坡度、10 m/min,60 min/天,每周6天,连续训练8周。
1.4 样本处理
所有小鼠禁食过夜。次日以1%的戊巴比妥钠(50 mg/kg)腹腔注射麻醉,每组随机选取6 只小鼠进行脑在体固定,脑固定完成后,冰上剥离颅骨,取出脑组织于4%的多聚甲醛固定48 h 以上;另外6 只小鼠冰浴下分离小鼠海马组织,称重后分两管,左侧海马用于Western blot检测,右侧海马用于提取总RNA,用于 RT-PCR 检测。 ELISA 试剂盒购自 ABclonal(USA),兔抗多克隆抗体 Bcl-2、BDNF、APRP、5-HT购自CUSABIO,PCR mRNA 引物由生工生物工程(上海)股份有限公司设计。
1.4.1 海马组织Nissl 染色 固定好的脑组织石蜡包埋,全自动切片机下沿冠状面切出厚度为5 µm 的切片。切片经脱蜡、复水、染色、冲洗、脱水、分色、透明,中性树胶封片,显微镜下观察海马神经元形态并拍照。
1.4.2 海马神经细胞凋亡检测 实验选用TUNEL 细胞凋亡检测试剂盒检测海马神经细胞凋亡。石蜡切片同上,切片二甲苯脱蜡、梯度酒精复水、蛋白酶K 工作液37 ℃反应30 min,PBS漂洗、室温固定30 min,浸入封闭液室温封闭10 min,PBS 漂洗后标记反应。先用TdT 酶反应液37 ℃避光反应1 h,SSC 室温15 min终止反应,PBS 漂洗,浸入0.3% H2O2PBS 中封闭内源性过氧化物酶,室温孵育5 min,PBS 漂洗,Streptavidin-HRP工作液37 ℃反应1 h,PBS漂洗后DAB显色,选择性进行复染,中性树胶封片,显微镜下观察计数黄褐色阳性细胞数。计数时每组随机选取6只小鼠的切片,每片随机选取5个视野计数阳性染色细胞数。
1.4.3 免疫荧光检测5-HT、PARP 石蜡切片经脱蜡、梯度酒精脱水、抗原修复、PBST 漂洗,BSA 试剂37 ℃湿盒封闭20 min,抗体染色,4 ℃孵育过夜,一抗对应种属的荧光二抗工作液,室温避光孵育1 h,滴加含有DAPI 的抗荧光衰减封片剂封片,荧光显微镜下观察。
1.4.4 Western blot检测Bcl-2、PARP和Caspase-3的蛋白表达 海马组织冰上匀浆器匀浆后,4 ℃下12 000 r/min离心15 min,取上清,蛋白裂解液提取总蛋白,酶标仪测定蛋白质浓度,蛋白浓度定量为2µg/µL。等量蛋白质上样,电泳分离、转膜,3%脱脂牛奶封闭2 h,4 ℃一抗孵育过夜,TBST 漂洗、二抗室温孵育 1 h,TBST 清晰,ECL曝光显影。Image J图像分析,目的蛋白与β-actin内参灰度比值测定蛋白水平。
1.4.5 RT-PCR 检测相关基因表达 分离海马后,冰浴电动匀浆器匀浆裂解白细胞,苯酚氯仿法提取总RNA,超微量紫外分光光度计检测总RNA浓度/纯度,Takara 反转录试剂盒转录成cDNA,以cDNA 为模板,两步法RT-PCR检测海马组织mRNA的差异表达。采用2-ΔΔCt法计算海马组织基因表达水平。相关引物经NCBI Blast 基因库检索核验后,由生工生物工程(上海)股份有限公司合成、纯化。其引物序列见表1。
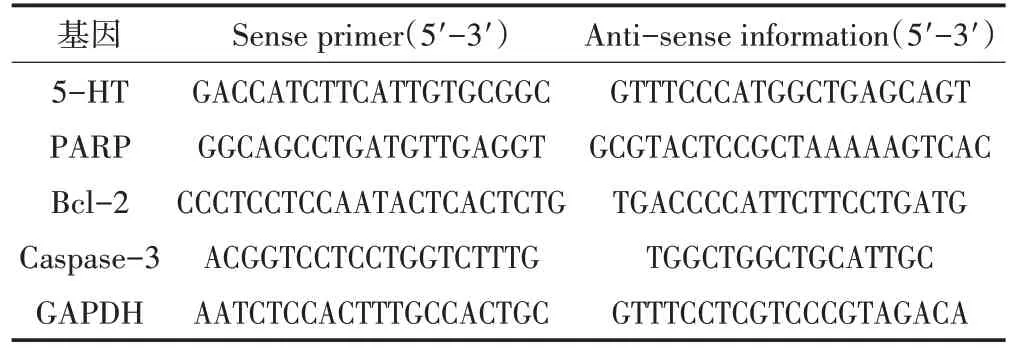
表1 引物序列Table1 The Gene Primers
1.5 数理处理
采用SPSS20.0 统计分析软件对原始实验数据进行整理分析,计量资料以均数±标准差(M±SD)表示,实验数据差异性检验采用ANOVA 方差分析,针对不呈正态分布的相关数据,组间比较采用卡方检验,符合正态分布的相关数据采用Kruskal-Wallis 检验,P〈0.05为差异具有统计学意义。
2 研究结果
2.1 神经行为学评定结果
与CG 相比MG 小鼠糖水偏好指数显著降低(P〈0.01),强迫游泳不动时间明显延长(P〈0.01);与MG相比,CE 小鼠的糖水偏好指数显著升高(P〈0.01),强迫游泳不动时间显著缩短(P〈0.01)(见表2)。

表2 有氧运动干预CUMS抑郁小鼠神经行为学评定结果(n=12)Table2 The Evaluation Results of Aerobic Exercise Intervention CUMS Depression Mice Neurobehavioral(n=12)
2.2 小鼠海马Nissl染色检测结果
Nissl 染色的结果可以看到正常小鼠海马神经细胞内可见清晰、颗粒状尼氏体,且神经元分布均匀,胞浆饱满;与CG 相比,MG 小鼠海马神经元排列稀疏,伴有神经元丢失,细胞间隙增宽,尼氏体核固缩、变窄,着色变浅,这与郭纯等[27]的研究结果相似;运动干预后的抑郁小鼠海马神经元数目增多,虽然仍有核固缩现象,但核固缩现象减少,染色趋于清晰(见图1)。

图1 有氧运动干预CUMS抑郁小鼠海马组织Nissl染色结果(×400)Figure1 The Nissl Staining Results of Aerobic Exercise Interven‐tion Hippocampus in CUMS Depressed Mice.(×400)
2.3 有氧运动干预CUMS 抑郁小鼠海马神经细胞凋亡
与CG 相比,TUNEL 法细胞凋亡检测结果显示模型组小鼠海马神经细胞凋亡数显著增加(P〈0.01);与MG 相比,CE 小鼠海马神经细胞凋亡数显著降低(P〈0.05)(见表3)。

表3 有氧运动对抑郁模型小鼠海马神经细胞凋亡的影响(n=6)(×100)Table3 Effect of Aerobic Exercise on Neurons Apoptosis in Hip‐pocampus Area in Mice Model of Depression(n=6)(×100)
2.4 小鼠海马免疫荧光检测结果
免疫荧光检测结果显示,与CG 相比,MG 小鼠海马5-HT 表达强度降低(P〈0.05),PARP 表达强度升高(P〈0.05);与MG 相比,CE 小鼠海马组织5-HT 表达强度升高,PARP 表达强度降低,均呈显著性差异(P〈0.05)。
2.5 小鼠海马组织Western blot检测结果
与CG 小鼠海马组织Western blot 的检测结果相比,MG 小鼠 Bcl-2 蛋白表达量显著下降(P〈0.05),Caspase-3、PARP 蛋白表达量显著上升(P〈0.05),有氧运动可显著增加抑郁小鼠海马的Bcl-2蛋白表达量(P〈0.01),降低PARP 的蛋白含量(P〈0.05),所不同的是CE 组小鼠海马组织Caspase-3 的蛋白表达量虽下降,但没有统计学差异(P〉0.05)(见图2)。

图2 有氧运动干预抑郁小鼠海马组织蛋白含量的检测分析结果(蛋白/β-actin,n=6)Figure 2 The Results of Aerobic Exercise Intervention on the Protein Content of Hippocampus in Depressed Mice.(Protein/βactin,n=6)
2.6 小鼠海马组织RT-PCR检测结果
与 CG 相比,MG 小鼠海马组织 5-HT、Bcl-2 表达水平明显下调(P〈0.05、P〈0.01),Caspase-3、PARP(P〈0.01)显著上调(P〈0.05、P〈0.01);与MG 相比,有氧运动干预后抑郁小鼠海马组织5-HT 与Bcl-2 表达明显上调(P〈0.01),Caspase-3(P〈0.05)与 PARP(P〈0.01)表达水平显著性下调。
3 分析与讨论
3.1 实验小鼠抑郁造模及运动干预效果分析
实验中对造模小鼠采用机体无外伤性刺激的慢性不可预见性刺激因素与抑郁症患者身心疾病的致病过程有较高的形似性,且具有高效、抑郁状态持续时间长等特点,成为经典的抑郁实验动物造模方法[28]。本实验通过28 天的抑郁造模,结果显示MG 小鼠糖水偏好指数显著下降,强迫游泳不动时间显著延长,Nissl染色结果可见明显的神经元萎缩和核固缩现象,5-HT 的蛋白含量和基因表达量均显著降低,这与P.W.ANDREWS 等证实抑郁期间脑细胞间隙内5-HT的低浓度密切相关[29-30]。提示实验抑郁造模小鼠的快感缺失,神经行为学和病理学改变明显,并伴有抑郁症患者海马组织5-HT 显著下降的典型表现,足以证实抑郁造模效果显著。5-HT 作为脑内的重要神经递质[31],广泛分布于大脑皮层和神经突触内,为自体活性物质,可使机体产生愉悦感,其含量与抑郁病理改变关系密切[32-33]。实验结果表明,有氧运动可提升CUMS 抑郁小鼠糖水偏好指数,改善其快感缺失的抑郁样行为,缩短强迫游泳的不动时间,增加其求生欲望。有氧运动还可以增加CUMS 抑郁小鼠海马组织5-HT 的蛋白含量,上调5-HT mRNA 的表达,具有显著性差异。神经元作为神经系统基本结构和功能单位,尼氏体是其特征性结构之一,广泛存在于神经元胞体和树突。Nissl染色结果显示,有氧运动可改善海马神经元锥体细胞形态,降低神经元萎缩,减少核固缩等病理改变[34]。
3.2 有氧运动干预抑郁小鼠海马神经细胞凋亡及其相关抗凋亡因子的差异表达结果分析
本实验的TUNEL 检测结果显示,MG 较 CG 小鼠海马神经细胞凋亡显著增加,这与以往的文献报道较为相似[35]。为期8 周的有氧运动干预后,能够显著降低抑郁小鼠海马神经细胞凋亡数量,虽然与CG 相比,仍具有显著性差异,但已经明显呈现出较好的恢复趋势。相关研究已经显示,抑郁病理性改变可诱导海马组织Bcl-2 蛋白含量下降,导致其作为重要的抗凋亡因子和细胞存活促进因子,阻止细胞色素由线粒体释放至细胞质的能力下降[36]。Bcl-2可稳定线粒体,阻断内质网释放钙离子,调节线粒体信号分子的转导,中断DNA 凋亡,保护神经细胞免受凋亡损伤[37-38]。本实验的结果也显示抑郁小鼠海马组织Bcl-2 表达下调,有氧运动能显著上调Bcl-2 mRNA 表达,改善慢性应激性刺激导致的抑郁小鼠海马神经细胞凋亡,促进海马神经细胞血氧和营养供应,从而改善抑郁症状。
3.3 有氧运动诱导Bcl-2-Caspase-3/PARP信号通路干预抑郁小鼠海马神经细胞凋亡的机制分析
Caspase-3 是介导细胞凋亡的核心蛋白酶[39],可通过酶解灭活凋亡抑制物、细胞外基质及骨架蛋白,裂解DNA 修复分子等启动Caspase 级联反应,诱发细胞凋亡[40]。本实验同其他实验研究结果相似,慢性应激抑郁实验动物海马组织Caspase-3 蛋白水平升高,基因表达上调,海马神经细胞凋亡[41-42]。作为Caspase-3作用底物的PARP 是一种DNA 损伤传感器,是典型的蛋白质翻译的后修饰酶,对DNA 断端十分敏感。正常情况下,活性较低的PARP 与DNA 断裂端关系密切[43],能识别DNA 缺口并与之结合到多种核蛋白,比如DNA聚合酶、组蛋白、DNA拓扑异构酶及转录因子等,调节多种生理过程[44];病理状态下,DNA损伤严重时,细胞内PARP 被大量激活,致使多聚ADP 核糖积聚,凋亡诱导因子核转位等一系列病理改变,进一步诱导DNA 断裂,导致细胞凋亡的发生。与相关凋亡、自噬研究的结果相一致[45],本实验发现抑郁小鼠海马组织存在明显的Caspase-3 及其底物PARP mRNA 表达上调,促凋亡蛋白含量增加,抗凋亡因子Bcl-2 mRNA 表达下调,提示CUMS 抑郁刺激因子可诱导小鼠海马神经细胞凋亡的增加。有氧运动能够通过调控Bcl-2-Caspase-3/PARP 信号通路上调抗凋亡因子Bcl-2 表达,下调Caspase-3 及其下游信号分子PARP的表达,表明系统持续的规律运动可能是抗抑郁海马神经细胞凋亡药物开发的潜在手段。
4 结 论
本实验通过神经行为学、病理学和分子生物学检测手段和方法,证实了有氧运动可通过上调海马组织抗凋亡因子Bcl-2 和胆碱类神经递质5-HT 的表达,下调Caspase-3 及其底物PARP 的表达,发挥抗抑郁小鼠海马神经细胞凋亡的作用,改善小鼠神经行为学功能,其作用可能通过Bcl-2-caspase-3/PRAP 信号通路发挥抗凋亡作用。该成果可为有氧运动成为运动治疗抑郁症的辅助手段提供机制上的实验证据,并为进一步通过多种途径和技术方法深入探讨有氧运动拮抗抑郁海马神经细胞凋亡的作用机制提供新的研究思路。

